- Introduction
- Matériel et méthodes
- Sujet
- Electrophysiologie
- Réflexe Bulbocavernosus
- Réponses aux potentiels évoqués somatosensoriels du nerf pudendal
- Analyse statistique
- Résultats
- Caractéristiques générales des patients
- Mesures du BCR
- Mesures de la PSEP
- Discussion
- Déclaration éthique
- Contributions des auteurs
- Déclaration de conflit d’intérêts
- Remerciements
- Funding
Introduction
La différenciation entre la maladie de Parkinson (MP) et les autres maladies parkinsoniennes est une question difficile dans le diagnostic clinique (1). Les symptômes de l’atrophie multisystémique avec parkinsonisme prédominant (MSA-P) et de la MP sont superposés et similaires. Dix pour cent des patients susceptibles d’être atteints de la maladie de Parkinson sont finalement diagnostiqués comme ayant une atrophie multisystémique (2). La maladie de Parkinson affecte principalement le système moteur et influence parfois le système nerveux autonome ; cependant, l’ASM-P affecte principalement le système nerveux autonome. Lorsque le système nerveux autonome est altéré, on observe souvent une constipation, des problèmes de vessie et une hypotension orthostatique (3, 4). Le parkinsonisme associé à un trouble du système nerveux autonome fait qu’il est difficile de différencier les patients atteints de l’ASM-P de ceux atteints de la MP (5). Différentes méthodes ont été utilisées pour aider à faire cette distinction et, parmi celles-ci, les méthodes d’imagerie ont été les plus populaires (6). D’autres méthodes basées sur les troubles du système nerveux autonome ont également été étudiées (7). Malgré ces tentatives précédentes, un examen objectif qui inclut le système nerveux autonome et qui rend une plus grande possibilité de diagnostic différentiel est toujours nécessaire.
Le réflexe bulbocavernosus (BCR) provoque la contraction du muscle bulbocavernosus en stimulant le nerf pudendal, et cette contraction peut être enregistrée en utilisant la technique de l’électromyogramme. Le BCR teste les signaux afférents et efférents du nerf pudendal ainsi que de la moelle sacrée (8). Une lésion de l’arc réflexe influence les latences et les amplitudes du RCB. Au cours des 20 dernières années, le RCB a été utilisé dans le diagnostic de diverses maladies neurogènes, notamment l’impuissance neurogène, le choc spinal et le syndrome cauda équin (9-11). Les réponses aux potentiels évoqués somatiques du nerf pudendal (PSEP) partagent la même voie que le BCR avant de pénétrer dans la moelle épinière. Par conséquent, les PSP et la RCB pourraient être utilisés pour localiser une lésion dans la voie. Des recherches antérieures de notre groupe suggèrent qu’une anomalie de la BCR existe chez les patients atteints d’ASA (12). Étant donné que l’ASM et la MP partagent les mêmes symptômes de troubles du système nerveux autonome, cette anomalie pourrait également exister chez les patients atteints de MP. Dans cette étude, nous avons l’intention de distinguer les patients atteints d’ASA-P et de la MP en utilisant la mesure du RCB. Plus précisément, notre étude a comparé les latences et les amplitudes de la RCB et de la PSEP chez 38 patients susceptibles de souffrir de l’ASA-P, 32 patients atteints de la MP et 30 sujets sains et normaux. Des analyses statistiques ont été réalisées pour différencier le SAEM-P et la MP.
Matériel et méthodes
Sujet
Dans cette étude, 38 patients probables du SAEM-P et 32 patients de la MP ont été sélectionnés pour participer aux investigations électrophysiologiques entre décembre 2012 et octobre 2014. Tous les patients ont été adressés au premier hôpital affilié de l’université de médecine de Wenzhou. Tous les patients atteints d’ASA-P répondaient aux critères d’inclusion publiés en 2008 (13). Les patients probables de l’ASM-P ont été diagnostiqués par deux critères d’inclusion : une défaillance autonome impliquant une incontinence urinaire (incapacité à contrôler l’évacuation de l’urine de la vessie, avec dysfonctionnement érectile chez les hommes) ou une baisse orthostatique de la pression artérielle et un parkinsonisme peu sensible à la lévodopa (bradykinésie avec rigidité, tremblements ou instabilité posturale). De même, tous les patients atteints de la MP répondaient aux critères de diagnostic clinique de la Movement Disorder Society (14). Les patients atteints de la MP étaient caractérisés par des tremblements au repos, une rigidité, une akinésie et une instabilité posturale. En outre, tous les patients ont été évalués par imagerie par résonance magnétique (IRM) et par une visite de suivi. Nous avons également recruté 30 sujets sains sans antécédents de maladies neurologiques ou psychiatriques comme groupe témoin. Tous les témoins sains ont subi des examens cliniques et neurologiques approfondis. Les sujets ayant des antécédents de parkinsonisme, d’ataxie, de dysfonctionnement autonome ou de maladies neurologiques (par exemple, épilepsie ou accident vasculaire cérébral) ont été exclus. De plus, les sujets masculins souffrant de maladies prostatiques ont été exclus. L’IRM a été utilisée pour exclure les sujets présentant des lésions cérébrovasculaires ou d’occupation de l’espace.
Tous les participants ont donné leur consentement éclairé écrit conformément à la Déclaration d’Helsinki et ont accepté de participer à l’étude. Cette étude a été menée sous l’approbation du comité de décision éthique de l’administration de la recherche du premier hôpital affilié de l’université médicale de Wenzhou (CR2009041).
Electrophysiologie
Le système EMG/EP Keypoint (Dantec, Bristol, UK) a été utilisé pour réaliser les tests BCR et PSEP. Une électrode de masse a été placée contre la cuisse des patients en position de lithotomie. La température de la surface de la peau était maintenue au-dessus de 32°C.
Réflexe Bulbocavernosus
Chez les hommes, des électrodes de stimulation en forme d’anneau étaient placées sur le corps ou à la racine du pénis. Le pôle positif était situé au niveau de la corona glandis. Chez les femelles, des électrodes de stimulation en forme de pince étaient placées près de la symphyse pubienne. Les pôles positif et négatif étaient placés sur le clitoris et les lèvres vulvaires, respectivement. Le RCB a été enregistré par des électrodes-aiguilles concentriques insérées dans le scrotum, dans la région périanale, près de la ligne médiane. L’intensité du stimulus était de sept fois le seuil sensoriel de l’individu, et l’impédance de l’électrode était <5 kΩ. La stimulation de l’onde carrée était de 1,9 impulsions/s, et nous avons enregistré la valeur moyenne de 20 ondes de réflexion. Le temps de balayage était de 5 ms/division, la plage de bande passante était de 10 Hz à 2 kHz, et le temps de persistance était de 100 ms. Les latences étaient calculées en fonction du début du stimulus et du début de la réponse réflexe.
Réponses aux potentiels évoqués somatosensoriels du nerf pudendal
Les électrodes utilisées pour évoquer les potentiels du nerf pudendal étaient identiques à celles utilisées pour évoquer le RCB, et elles étaient appliquées aux mêmes endroits. Cependant, l’intensité du stimulus était trois fois supérieure au seuil sensoriel de l’individu. De même, l’impédance des électrodes était maintenue à 5 kΩ. La fréquence de l’onde carrée était de 5 impulsions/s et la moyenne était calculée sur 200 ondes. Le temps de balayage était fixé à 0,2 ms/division, et le temps de persistance pertinent était de 100 ms, avec une bande passante allant de 10 Hz à 5 kHz. L’électrode d’enregistrement était située 2 cm derrière Cz, et l’électrode de référence était placée sur le front à Fpz. L’onde P41 du PSEP a été détectée après la délivrance du stimulus.
Analyse statistique
Les données ont été analysées à l’aide du progiciel statistique pour les sciences sociales 22.0 (IBM, CA, USA) et de Stata SE 12 (StataCorp, LP, USA). La distribution normale et l’homogénéité de la variance ont été identifiées à l’aide du test de Kolmogorov-Smirnov et du test de Shapiro-Wilk. Un test de chi-deux a été utilisé pour comparer les taux d’élicitation des RCB entre les groupes MSA-P, PD et témoin. Une analyse de variance à sens unique (ANOVA) a été utilisée pour analyser les différences dans les paramètres de RCB entre les trois groupes (MSA-P, PD et contrôle) chez les mâles. Les paramètres du PSEP ont également été analysés avec une ANOVA. Un test de comparaison multiple de Bonferroni a été appliqué lorsque des différences significatives ont été identifiées. Ce test a révélé d’autres contrastes entre les groupes. Un test de rang de Kruskal-Wallis a été utilisé pour comparer les paramètres BCR et PSEP entre les trois groupes (MSA-P, PD et contrôle) chez les femelles. Un test de Nemenyi a été appliqué pour évaluer plus avant les différences entre chaque groupe. Une analyse de la caractéristique de fonctionnement du récepteur (ROC) a été utilisée pour évaluer la spécificité et la sensibilité des paramètres BCR. Une valeur de p ≤ 0,05 a été considérée comme statistiquement significative.
Résultats
Caractéristiques générales des patients
Trente-huit patients MSA-P probables et 32 patients PD ont participé à l’étude. L’âge des patients atteints d’ASA-P probable allait de 36 à 74 ans, et l’âge moyen était de 54,21 ± 7,92 ans. 39 % des patients (15 cas) présentaient une dysfonction érectile, 45 % des patients (17 cas) une incontinence urinaire et 76 % des patients (22 cas) une hypotension orthostatique. De plus, l’âge des patients diagnostiqués comme souffrant de la MP variait de 35 à 77 ans, et l’âge moyen était de 55,23 ± 8,75 ans. 22 % des patients (7 cas) présentaient un dysfonctionnement érectile, 3 % des patients (1 cas) une incontinence urinaire et 16 % des patients (5 cas) une hypotension orthostatique. Les groupes MSA-P et PD souffraient tous deux d’une défaillance autonome (voir tableau 1).
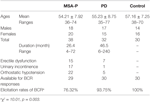
Tableau 1. Caractéristiques générales et taux d’élicitation des latences du réflexe bulbocavernosus (BCR) entre l’atrophie multisystémique avec parkinsonisme prédominant (MSA-P), la maladie de Parkinson (PD) et les groupes témoins.
Mesures du BCR

Tableau 2. Comparaison des latences moyennes ou médianes du réflexe bulbocavernosus entre l’atrophie systémique multiple avec parkinsonisme prédominant (MSA-P), la maladie de Parkinson (PD) et les groupes témoins.

Figure 1. Latences et amplitudes du réflexe bulbocaverneux (BCR) entre l’atrophie multisystémique avec parkinsonisme prédominant (MSA-P), la maladie de Parkinson (PD) et les groupes témoins chez les hommes (A) et les femmes (B). Les latences du BCR n’étaient pas significativement différentes entre le groupe témoin et les patients atteints de la maladie de Parkinson, mais les patients atteints de l’ASM présentaient des latences plus longues que les autres groupes chez les hommes (C) et les femmes (D). Les amplitudes du BCR étaient significativement plus faibles chez les patients MSA-P que celles du groupe témoin, et les amplitudes des patients PD se situaient entre les amplitudes du groupe témoin et celles du groupe MSA-P.

Tableau 3. Comparaison des amplitudes moyennes ou médianes du réflexe bulbocavernosus entre l’atrophie multisystémique avec parkinsonisme prédominant (MSA-P), la maladie de Parkinson (PD) et les groupes témoins.
Mesures de la PSEP
Aucune différence significative n’existait entre les groupes MSA-P, PD et témoins, que ce soit chez les hommes ou les femmes (voir tableau 4).

Tableau 4. Comparaison des latences et des amplitudes moyennes des réponses au potentiel évoqué par le somatosensoriel du nerf pudendal P41 entre l’atrophie du système multiple avec un parkinsonisme prédominant (MSA-P), la maladie de Parkinson (PD) et les groupes témoins.
Discussion
Dans cette étude, nous avons découvert qu’une différence trouvée dans les paramètres BCR pourrait aider à distinguer le MSA-P et la PD. Les patients MSA-P présentaient un taux d’élicitation du BCR inférieur à celui des patients PD (76,3 vs 90,9%). Les paramètres de la RCB ont révélé des différences entre les groupes MSA-P, PD et de contrôle. Les patients atteints d’ASA-P présentaient des latences plus longues et des amplitudes plus faibles que le groupe PD. De plus, ces deux paramètres pouvaient distinguer de manière significative le MSA-P en utilisant une courbe ROC.
La voie afférente somatique sensorielle du BCR inclut le nerf pudendal. La voie motrice somatique efférente est composée des segments spinaux S2-S4, y compris le noyau d’Onuf et le nerf pudendal. Une impulsion contracte le muscle bulbocavernosus (8, 15). La voie afférente sensorielle somatique des PPSE comprend deux segments, et le segment antérieur partage la même voie afférente avec le BCR. Une impulsion est ensuite transmise au cortex cérébral par la moelle épinière. La combinaison du BCR et des PSEP pourrait être utilisée pour localiser une lésion dans certaines neuropathies, comme la vessie neurogène diabétique et le syndrome cauda equine.
Dans cette étude, les patients MSA-P et PD avaient un BCR anormal et des PSEP normaux. Les taux d’élicitation des patients MSA-P étaient inférieurs à ceux des patients PD. De plus, nous n’avons pas réussi à déclencher le BCR chez 23,68 % des patients atteints d’ASA-P. La lésion de l’arc réflexe dans le RCB des patients atteints de l’ASA-P était plus grave que chez les patients atteints de la maladie de Parkinson. De plus, les patients atteints de l’ASA-P présentaient des amplitudes du RCB inférieures à celles des patients atteints de la maladie de Parkinson. Cependant, les PSEP n’ont révélé aucune différence entre les patients atteints de l’ASA-P, de la MP et les sujets témoins. Les données PSEP ne peuvent pas être utilisées pour distinguer les patients MSA-P des patients PD dans notre étude. Le parcours des PSEP semble être complet chez les patients MSA-P et PD. Comme le BCR et les PSE partagent la même voie afférente, les lésions sont probablement situées sur la voie efférente, qui comprend les segments spinaux S2-S4, y compris le noyau d’Onuf, ou sur le nerf pudendal. Ces conclusions confirment les résultats de plusieurs études antérieures. Konno et al. (16) ont trouvé une perte par privation des motoneurones somatiques dans le noyau d’Onuf. De plus, les études précédentes de Ref. (17) ont trouvé que l’électromyographie du sphincter anal externe (EAS-EMG) partage la même voie que le BCR. De plus, leurs résultats montrent également la dégénérescence de la cellule de la corne antérieure du noyau d’Onuf. Selon ces études, la lésion du BCR est probablement positionnée dans le noyau d’Onuf. Il est également important de noter que par rapport à l’EAS-EMG, les méthodes utilisées dans notre étude sont non invasives.
La maladie de Parkinson est caractérisée par des symptômes moteurs, tels que le tremblement au repos, la rigidité et la lenteur des mouvements, qui peuvent tous être expliqués par la dégénérescence des neurones du système nerveux central. Cependant, les symptômes non-moteurs des patients atteints de la maladie de Parkinson, tels que la constipation, les problèmes de vessie et l’hypotension orthostatique, ont récemment fait l’objet d’une attention croissante. Dans cette étude, nous avons constaté que les amplitudes du BCR étaient inférieures à celles du groupe témoin, mais supérieures à celles du groupe MSA-P. Cela suggère que certaines lésions sont probablement plus importantes que celles du groupe témoin. Cela suggère que certaines lésions impliquent très probablement le RCB chez les patients atteints de la maladie de Parkinson, mais que cette condition est plus grave chez les patients du groupe MSA-P. Le système nerveux autonome est plus gravement affecté chez les patients atteints de l’ASA-M.
Les symptômes non-moteurs communs aux patients atteints de la maladie de Parkinson et de l’ASA-M rendent difficile le diagnostic différentiel de l’ASA-M et de la maladie de Parkinson, surtout à un stade précoce. De multiples tests ont été utilisés au cours des dernières décennies pour tenter de résoudre ce problème. Des méthodes d’imagerie, telles que la tomographie par émission de positons, l’image pondérée en diffusion et l’image du tenseur de diffusion, ont déjà été utilisées (18-20). L’application de l’IRM améliore effectivement la précision clinique (6, 21). De plus, l’imagerie 3T pondérée par la susceptibilité est plus sensible aux modifications du putaminal et à l’asymétrie des lésions (21). L’utilisation de la volumétrie cérébrale avec l’IRM est parfois inefficace (22). Chez les patients atteints de MP et d’ASM-P légèrement symptomatiques, la perfusion cérébrale est modifiée par la méthode de tomographie par émission monophotonique (23). Cependant, avec cette technique, certains facteurs d’influence peuvent perturber les résultats, et le processus d’analyse des données est complexe et prend du temps. En outre, le coût de l’examen radiologique doit également être pris en compte, notamment dans les pays en développement. D’autres méthodes, comme la mesure des niveaux de liquide céphalo-rachidien, manquent de précision (24, 25). L’examen de la fonction nerveuse autonome est devenu un axe de recherche ces dernières années (7, 26, 27). Cette méthode consiste en une batterie de tests autonomes cardiovasculaires, notamment l’hypotension orthostatique, la pression artérielle systolique et diastolique et d’autres tests. En utilisant cette méthode, Pilleri et al. (28) ont découvert que les patients atteints d’AMS présentaient une fréquence cardiaque nocturne plus élevée et une diminution nocturne de la fréquence cardiaque par rapport aux patients atteints de la MP. Les méthodes ci-dessus présentent des avantages et des inconvénients ; aucun test ne peut avoir à lui seul une sensibilité et une spécificité favorables. Un examen objectif offre une plus grande possibilité de diagnostic différentiel précis.
Notre étude présente certaines limites. Par exemple, la population de l’échantillon de notre étude était limitée aux patients disponibles. En outre, tous les patients atteints de MSA-P et de PD ont été diagnostiqués cliniquement plutôt que pathologiquement.
En conclusion, nous avons observé une différence entre les patients MSA-P et PD dans le BCR. De plus, nous considérons le test BCR comme une approche non invasive, convaincante, objective et économique pour discriminer les patients MSA-P et PD. Une étude complémentaire avec plus de cas permettra de valider nos résultats. D’autres applications incluant la trace de l’altération du BCR avec la progression du MSA-P ou l’association entre les paramètres du BCR et le pronostic peuvent nous aider à mieux surveiller ces maladies neurologiques dévastatrices.
Déclaration éthique
Tous les participants ont donné leur consentement éclairé écrit conformément à la Déclaration d’Helsinki et ont accepté de participer à l’étude. Cette étude a été menée sous l’approbation du comité de décision éthique de l’administration de la recherche du premier hôpital affilié de l’université médicale de Wenzhou (CR2009041).
Contributions des auteurs
H-jH et X-yZ ont analysé les données, rédigé et révisé l’article. Z-yW a participé à la rédaction et a révisé l’article. XW et W-lZ ont réalisé les tests cliniques et collecté les données. B-cC et C-fL ont conçu et dessiné l’étude et obtenu l’approbation éthique.
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Remerciements
Nous remercions sincèrement Feng-ming Zhang de l’école des premières sciences médicales cliniques, de l’université médicale de Wenzhou, pour son aide dans l’expérience et l’acquisition de fonds.
Funding
Ce travail a été financé par le Undergraduate Innovation Project de WMU (No. wyx2016101006).
2. Hughes AJ, Daniel SE, Kilford L, Lees AJ. Précision du diagnostic clinique de la maladie de Parkinson idiopathique : une étude clinico-pathologique de 100 cas. J Neurol Neurosurg Psychiatry (1992) 55(3):181-4. doi:10.1136/jnnp.55.3.181
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Terao Y, Fukuda H, Tokushige S, Inomata-Terada S, Yugeta A, Hamada M, et al. Is multiple system atrophy with cerebellar ataxia (MSA-C) like spinocerebellar ataxia and multiple system atrophy with parkinsonism (MSA-P) like Parkinson’s disease ? Une étude de la saccade sur la physiopathologie. Clin Neurophysiol (2016) 127(2):1491-502. doi:10.1016/j.clinph.2015.07.035
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Skinner SA, Vodusek DB. Enregistrement peropératoire du réflexe bulbocavernosus. J Clin Neurophysiol (2014) 31(4):313-22. doi:10.1097/WNP.0000000000000054
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Ashraf VV, Taly AB, Nair KP, Rao S, Sridhar. Rôle des tests neurophysiologiques cliniques dans l’évaluation de la dysfonction érectile chez les personnes atteintes de troubles de la moelle épinière. Neurol India (2005) 53(1):32-5 ; discussion 35-6. doi:10.4103/0028-3886.15048
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Niu X, Shao B, Ni P, Wang X, Chen X, Zhu B, et al. Réponses du réflexe bulbocavernosus et des potentiels évoqués somatiques du nerf pudendal chez les patientes atteintes de maladies du système nerveux. J Clin Neurophysiol (2010) 27(3):207-11. doi:10.1097/WNP.0b013e3181dd4fca
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Konno H, Yamamoto T, Iwasaki Y, Iizuka H. Syndrome de Shy-Drager et sclérose latérale amyotrophique. Études cytoarchitectoniques et morphométriques des neurones autonomes sacrés. J Neurol Sci (1986) 73(2):193-204. doi:10.1016/0022-510x(86)90130-9
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Han W, Cui LY, Hua D, Li BH. Relation entre le dysfonctionnement autonome de l’atrophie du système multiple et l’électromyogramme du sphincter anal externe. Chin J Neurol (2006) 2:109-12. doi:10.3760/j.issn:1006-7876.2006.02.010
CrossRef Full Text | Google Scholar
19. Cnyrim CD, Kupsch A, Ebersbach G, Hoffmann KT. Imagerie du tenseur de diffusion dans la maladie de Parkinson idiopathique et l’atrophie multisystémique (type parkinsonien). Neurodegener Dis (2014) 13(1):1-8. doi:10.1159/000348512
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Hwang I, Sohn CH, Kang KM, Jeon BS, Kim HJ, Choi SH, et al. Differentiation of parkinsonism-predominant multiple system atrophy from idiopathic Parkinson disease using 3T susceptibility-weighted MR imaging, focusing on putaminal change and lesion asymmetry. AJNR Am J Neuroradiol (2015) 36(12):2227-34. doi:10.3174/ajnr.A4442
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Huppertz HJ, Moller L, Sudmeyer M, Hilker R, Hattingen E, Egger K, et al. Différenciation des syndromes parkinsoniens neurodégénératifs par analyse d’imagerie par résonance magnétique volumétrique et classification par machine à vecteurs de support. Mov Disord (2016) 31(10):1506-17. doi:10.1002/mds.26715
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Song IU, Yoo I, Chung YA, Jeong J. La valeur de la TEMP de perfusion cérébrale pour la différenciation entre la maladie de Parkinson idiopathique légèrement symptomatique et la variante Parkinson de l’atrophie du système multiple. Nucl Med Commun (2015) 36(10):1049-54. doi:10.1097/MNM.0000000000000354
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Ghaemi M, Hilker R, Rudolf J, Sobesky J, Heiss WD. Differentiating multiple system atrophy from Parkinson’s disease : contribution of striatal and midbrain MRI volumetry and multi-tracer PET imaging. J Neurol Neurosurg Psychiatry (2002) 73(5):517-23. doi:10.1136/jnnp.73.5.517
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Baschieri F, Calandra-Buonaura G, Doria A, Mastrolilli F, Palareti A, Barletta G, et al. Le test autonome cardiovasculaire réalisé avec une nouvelle approche instrumentale intégrée est utile pour différencier le MSA-P du PD à un stade précoce. Parkinsonism Relat Disord (2015) 21(5):477-82. doi:10.1016/j.parkreldis.2015.02.011
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Roy S, Srivastava AK, Jaryal AK, Deepak KK. Les réponses cardiovasculaires pendant le test de pression à froid sont différentes dans la maladie de Parkinson et l’atrophie du système multiple avec parkinsonisme. Clin Auton Res (2015) 25(4):219-24. doi:10.1007/s10286-015-0294-x
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Pilleri M, Levedianos G, Weis L, Gasparoli E, Facchini S, Biundo R, et al. Profil circadien de la fréquence cardiaque dans le diagnostic différentiel entre la maladie de Parkinson et l’atrophie du système multiple. Parkinsonism Relat Disord (2014) 20(2):217-21. doi:10.1016/j.parkreldis.2013.11.006
PubMed Abstract | CrossRef Full Text | Google Scholar
.