- Einführung
- Materialien und Methoden
- Probanden
- Elektrophysiologie
- Bulbocavernosus-Reflex
- Somatosensorisch evozierte Potentiale des Nervus pudendus
- Statistische Analyse
- Ergebnisse
- Allgemeine Patientenmerkmale
- BCR-Messungen
- PSEP-Messungen
- Diskussion
- Ethikerklärung
- Beiträge der Autoren
- Erklärung zu Interessenkonflikten
- Danksagung
- Finanzierung
Einführung
Die Unterscheidung zwischen Morbus Parkinson (PD) und anderen parkinsonschen Erkrankungen ist ein schwieriges Thema in der klinischen Diagnose (1). Die Symptome der multiplen Systematrophie mit vorherrschendem Parkinsonismus (MSA-P) und des Morbus Parkinson überlagern sich und sind ähnlich. Bei zehn Prozent der wahrscheinlichen Parkinson-Patienten wird schließlich eine MSA diagnostiziert (2). Morbus Parkinson betrifft vorwiegend das motorische System und beeinflusst manchmal auch das autonome Nervensystem; MSA-P hingegen betrifft hauptsächlich das autonome Nervensystem. Wenn das autonome Nervensystem verändert ist, treten häufig Verstopfung, Blasenprobleme und orthostatische Hypotonie auf (3, 4). Der Parkinsonismus in Verbindung mit einer Störung des autonomen Nervensystems erschwert die Unterscheidung zwischen MSA-P und Parkinson-Patienten (5). Für diese Unterscheidung wurden verschiedene Methoden angewandt, von denen die bildgebenden Verfahren am weitesten verbreitet sind (6). Andere Methoden, die auf Störungen des autonomen Nervensystems beruhen, wurden ebenfalls untersucht (7). Trotz dieser bisherigen Versuche ist eine objektive Untersuchung, die das autonome Nervensystem mit einbezieht und eine bessere Möglichkeit zur Differenzialdiagnose bietet, immer noch erforderlich.
Der Bulbocavernosusreflex (BCR) verursacht die Kontraktion des Bulbocavernosusmuskels durch Stimulation des Nervus pudendus, und diese Kontraktion kann mit der Elektromyogrammtechnik aufgezeichnet werden. Der BCR testet die afferenten und efferenten Signale des N. pudendus sowie des Sakralstrangs (8). Eine Läsion des Reflexbogens beeinflusst die Latenzen und Amplituden des BCR. In den letzten 20 Jahren wurde der BCR zur Diagnose verschiedener neurogener Erkrankungen eingesetzt, darunter neurogene Impotenz, spinaler Schock und Cauda-Equine-Syndrom (9-11). Die somatosensorisch evozierten Potenziale des Pudendusnervs (PSEP) teilen sich vor dem Eintritt in das Rückenmark denselben Weg mit dem BCR. Daher könnten die PSEP zusammen mit dem BCR zur Lokalisierung einer Läsion in diesem Pfad verwendet werden. Frühere Forschungsarbeiten unserer Gruppe deuten darauf hin, dass bei MSA-Patienten eine Abnormalität der BCR vorliegt (12). Da MSA und Morbus Parkinson die gleichen Symptome von Störungen des autonomen Nervensystems aufweisen, könnte die Anomalie auch bei Morbus Parkinson-Patienten vorhanden sein. In dieser Studie beabsichtigen wir, anhand der BCR-Messung zwischen MSA-P- und PD-Patienten zu unterscheiden. Konkret wurden in unserer Studie die Latenzen und Amplituden der BCR und des PSEP bei 38 wahrscheinlichen MSA-P-Patienten, 32 PD-Patienten und 30 normalen, gesunden Probanden verglichen. Statistische Analysen wurden durchgeführt, um zwischen MSA-P und PD zu unterscheiden.
Materialien und Methoden
Probanden
In dieser Studie wurden 38 wahrscheinliche MSA-P-Patienten und 32 PD-Patienten ausgewählt, die zwischen Dezember 2012 und Oktober 2014 an den elektrophysiologischen Untersuchungen teilnahmen. Alle Patienten wurden an das First Affiliated Hospital der Wenzhou Medical University überwiesen. Alle MSA-P-Patienten erfüllten die im Jahr 2008 veröffentlichten Einschlusskriterien (13). Wahrscheinliche MSA-P-Patienten wurden anhand von zwei Einschlusskriterien diagnostiziert: autonomes Versagen mit Harninkontinenz (Unfähigkeit, den Urinabgang aus der Blase zu kontrollieren, mit erektiler Dysfunktion bei Männern) oder orthostatischer Blutdruckabfall und schlecht auf Levodopa ansprechender Parkinsonismus (Bradykinesie mit Rigidität, Tremor oder posturaler Instabilität). Ebenso erfüllten alle PD-Patienten die klinischen Diagnosekriterien der Movement Disorder Society (14). PD-Patienten waren durch Tremor in Ruhe, Rigidität, Akinesie und posturale Instabilität gekennzeichnet. Darüber hinaus wurden alle Patienten mittels Magnetresonanztomographie (MRT) und einer Nachuntersuchung untersucht. Wir rekrutierten auch 30 gesunde Probanden ohne neurologische oder psychiatrische Erkrankungen in der Vorgeschichte als Kontrollgruppe. Alle gesunden Kontrollpersonen wurden einer gründlichen klinischen und neurologischen Untersuchung unterzogen. Probanden mit einer Vorgeschichte von Parkinsonismus, Ataxie, autonomen Funktionsstörungen oder neurologischen Erkrankungen (z. B. Epilepsie oder Schlaganfall) wurden ausgeschlossen. Außerdem wurden männliche Probanden mit Prostataerkrankungen ausgeschlossen. Mittels MRT wurden Probanden mit zerebrovaskulären oder raumfordernden Läsionen ausgeschlossen.
Alle Teilnehmer gaben ihre schriftliche Einwilligung nach Aufklärung gemäß der Deklaration von Helsinki und stimmten der Teilnahme an der Studie zu. Diese Studie wurde mit Genehmigung des Ethikausschusses der Forschungsverwaltung des First Affiliated Hospital of Wenzhou Medical University (CR2009041) durchgeführt.
Elektrophysiologie
Das Keypoint EMG/EP-System (Dantec, Bristol, UK) wurde zur Durchführung der BCR- und PSEP-Tests verwendet. Eine Masseelektrode wurde am Oberschenkel der Patienten in Steinschnittlage angebracht. Die Temperatur der Hautoberfläche wurde über 32°C gehalten.
Bulbocavernosus-Reflex
Bei Männern wurden ringförmige Stimulationselektroden am Körper oder an der Peniswurzel angebracht. Der positive Pol befand sich an der Corona glandis. Bei den weiblichen Tieren wurden Klemmen-Stimulationselektroden in der Nähe der Schambeinfuge angebracht. Der positive und der negative Pol wurden an der Klitoris bzw. an den Schamlippen angebracht. Der BCR wurde mit konzentrischen Nadelelektroden aufgezeichnet, die im Hodensack in der Perianalregion nahe der Mittellinie angebracht wurden. Die Stimulationsintensität betrug das Siebenfache der individuellen sensorischen Schwelle, und die Elektrodenimpedanz betrug <5 kΩ. Die Stimulation der Rechteckwelle erfolgte mit 1,9 Impulsen/s, und es wurde der Durchschnittswert von 20 Reflexionswellen aufgezeichnet. Die Abtastzeit betrug 5 ms/Teilung, der Bandbreitenbereich lag zwischen 10 Hz und 2 kHz, und die Nachleuchtdauer betrug 100 ms. Die Latenzen wurden auf der Grundlage des Beginns des Stimulus und des Beginns der Reflexantwort berechnet.
Somatosensorisch evozierte Potentiale des Nervus pudendus
Die Elektroden, die zur Evozierung der Potentiale des Nervus pudendus verwendet wurden, waren identisch mit denen, die zur Evozierung des BCR verwendet wurden, und sie wurden an denselben Stellen angebracht. Die Intensität des Stimulus war jedoch dreimal so hoch wie die sensorische Schwelle der Person. Ebenso wurde die Elektrodenimpedanz bei 5 kΩ gehalten. Die Frequenz der Rechteckwelle betrug 5 Pulse/s und wurde über 200 Wellen gemittelt. Die Abtastzeit wurde auf 0,2 ms/Teilung eingestellt, und die relevante Nachleuchtdauer betrug 100 ms, wobei die Bandbreite von 10 Hz bis 5 kHz reichte. Die Aufzeichnungselektrode befand sich 2 cm hinter Cz, und die Referenzelektrode wurde auf der Stirn bei Fpz platziert. Die PSEP-Welle P41 wurde nach der Stimulusabgabe erfasst.
Statistische Analyse
Die Daten wurden mit dem Statistical Package for the Social Sciences 22.0 (IBM, CA, USA) und Stata SE 12 (StataCorp, LP, USA) analysiert. Normalverteilung und Homogenität der Varianz wurden mit dem Kolmogorov-Smirnov-Test und dem Shapiro-Wilk-Test ermittelt. Ein Chi-Quadrat-Test wurde verwendet, um die Auslöseraten der BCRs zwischen den MSA-P-, PD- und Kontrollgruppen zu vergleichen. Mit einer einseitigen Varianzanalyse (ANOVA) wurden die Unterschiede in den BCR-Parametern zwischen den drei Gruppen (MSA-P, PD und Kontrolle) bei den Männern analysiert. Die PSEP-Parameter wurden ebenfalls mit einer ANOVA analysiert. Wenn signifikante Unterschiede festgestellt wurden, wurde ein Bonferroni-Mehrfachvergleichstest durchgeführt. Dieser Test ergab weitere Kontraste zwischen den Gruppen. Ein Kruskal-Wallis-Rangtest wurde verwendet, um die BCR- und PSEP-Parameter zwischen den drei Gruppen (MSA-P, PD und Kontrolle) bei den weiblichen Tieren zu vergleichen. Zur weiteren Bewertung der Unterschiede zwischen den einzelnen Gruppen wurde ein Nemenyi-Test durchgeführt. Zur Bewertung der Spezifität und Sensitivität der BCR-Parameter wurde eine ROC-Analyse (Receiver Operating Characteristic) durchgeführt. Ein Wert von p ≤ 0,05 wurde als statistisch signifikant angesehen.
Ergebnisse
Allgemeine Patientenmerkmale
Achtunddreißig Patienten mit wahrscheinlicher MSA-P und 32 Patienten mit PD nahmen an der Studie teil. Das Alter der wahrscheinlichen MSA-P-Patienten reichte von 36 bis 74 Jahren, und das Durchschnittsalter betrug 54,21 ± 7,92 Jahre. 39 % der Patienten (15 Fälle) hatten eine erektile Dysfunktion, 45 % der Patienten (17 Fälle) eine Harninkontinenz und 76 % der Patienten (22 Fälle) eine orthostatische Hypotonie. Darüber hinaus lag das Alter der diagnostizierten Parkinson-Patienten zwischen 35 und 77 Jahren, das Durchschnittsalter betrug 55,23 ± 8,75 Jahre. 22 % der Patienten (7 Fälle) hatten eine erektile Dysfunktion, 3 % der Patienten (1 Fall) eine Harninkontinenz und 16 % der Patienten (5 Fälle) eine orthostatische Hypotonie. Sowohl die MSA-P- als auch die PD-Gruppe litten unter autonomen Störungen (siehe Tabelle 1).
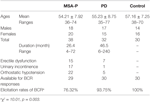
Tabelle 1. Allgemeine Merkmale und Auslöseraten der Latenzen des Bulbocavernosusreflexes (BCR) zwischen Gruppen mit multipler Systematrophie und vorherrschendem Parkinsonismus (MSA-P), Parkinson-Krankheit (PD) und Kontrollgruppen.
BCR-Messungen

Tabelle 2. Vergleich der mittleren bzw. medianen Bulbocavernosus-Reflexlatenzen zwischen Multiple-System-Atrophie mit vorherrschendem Parkinsonismus (MSA-P), Parkinson-Krankheit (PD) und Kontrollgruppen.

Abbildung 1. Latenzen und Amplituden des Bulbocavernosus-Reflexes (BCR) bei Männern (A) und Frauen (B) im Vergleich zur Kontrollgruppe bei multipler Systematrophie mit vorherrschendem Parkinsonismus (MSA-P) und Morbus Parkinson (PD). Die BCR-Latenzen unterschieden sich nicht signifikant zwischen Kontroll- und Morbus-Parkinson-Patienten, aber MSA-Patienten hatten im Vergleich zu den anderen Gruppen bei Männern (C) und Frauen (D) längere Latenzen. Die BCR-Amplituden waren bei MSA-P-Patienten signifikant niedriger als in der Kontrollgruppe, und die Amplituden der PD-Patienten lagen zwischen denen der Kontrollgruppe und denen der MSA-P-Patienten.

Tabelle 3. Vergleich der mittleren bzw. medianen Bulbocavernosusreflex-Amplituden zwischen multipler Systematrophie mit vorherrschendem Parkinsonismus (MSA-P), Morbus Parkinson (PD) und Kontrollgruppen.
PSEP-Messungen
Weder bei den Männern noch bei den Frauen gab es signifikante Unterschiede zwischen der MSA-P-, der PD- und der Kontrollgruppe (siehe Tabelle 4).

Tabelle 4. Vergleich der mittleren somatosensorisch evozierten P41-Latenzen und -Amplituden des Nervus pudendus zwischen MSA-P (Multiple System Atrophie mit vorherrschendem Parkinsonismus), Morbus Parkinson (PD) und Kontrollgruppen.
Diskussion
In dieser Studie entdeckten wir, dass ein Unterschied in den BCR-Parametern helfen könnte, zwischen MSA-P und PD zu unterscheiden. MSA-P-Patienten wiesen eine niedrigere BCR-Erregungsrate auf als PD-Patienten (76,3 vs. 90,9 %). Die BCR-Parameter wiesen Unterschiede zwischen den MSA-P-, PD- und Kontrollgruppen auf. MSA-P-Patienten wiesen längere Latenzen und geringere Amplituden auf als die PD-Gruppe. Darüber hinaus konnten diese beiden Parameter die MSA-P anhand einer ROC-Kurve signifikant unterscheiden.
Die afferente somatische sensorische Bahn der BCR umfasst den N. pudendus. Die efferente somatische Bewegungsbahn besteht aus den Spinalsegmenten S2-S4, einschließlich des Onuf-Kerns und des Nervus pudendus. Ein Impuls kontrahiert den Musculus bulbocavernosus (8, 15). Die afferente somatische Sinnesbahn der PSEPs besteht aus zwei Segmenten, wobei das vordere Segment die gleiche afferente Bahn mit dem BCR teilt. Ein Impuls wird dann über das Rückenmark an die Großhirnrinde weitergeleitet. Die Kombination von BCR und PSEPs könnte zur Lokalisierung einer Läsion bei einigen Neuropathien wie der diabetischen neurogenen Blase und dem Cauda-Equine-Syndrom verwendet werden.
In dieser Studie wiesen MSA-P- und PD-Patienten eine abnorme BCR und normale PSEPs auf. Die Auslöseraten von MSA-P-Patienten waren niedriger als die von PD-Patienten. Außerdem konnten wir bei 23,68 % der MSA-P-Patienten den BCR nicht auslösen. Die Läsion des Reflexbogens in der BCR der MSA-P-Patienten war gravierender als bei den PD-Patienten. Außerdem wiesen die MSA-P-Patienten geringere BCR-Amplituden auf als die PD-Patienten. Die PSEP zeigten jedoch keine Unterschiede zwischen den MSA-P-, PD- und Kontrollpersonen. Die PSEP-Daten können in unserer Studie nicht zur Unterscheidung zwischen MSA-P- und PD-Patienten verwendet werden. Der Pfad der PSEPs schien sowohl bei den MSA-P- als auch bei den PD-Patienten vollständig zu sein. Da die BCR und die PSEPs denselben afferenten Pfad nutzen, sind die Läsionen wahrscheinlich auf dem efferenten Pfad zu finden, der aus den Spinalsegmenten S2-S4, einschließlich des Onuf-Kerns, oder dem Nervus pudendus besteht. Diese Befunde unterstützen die Ergebnisse mehrerer früherer Studien. Konno et al. (16) stellten einen Deprivationsverlust der somatischen Motoneuronen im Onuf-Kern fest. Außerdem haben die früheren Studien von Ref. (17) herausgefunden, dass die Elektromyographie des äußeren Analsphinkters (EAS-EMG) denselben Signalweg wie die BCR nutzt. Darüber hinaus zeigen ihre Ergebnisse auch die Degeneration der vorderen Hornzelle des Onuf-Kerns. Diesen Studien zufolge ist die Läsion im BCR wahrscheinlich im Onuf-Kern lokalisiert. Wichtig ist auch, dass die in unserer Studie verwendeten Methoden im Vergleich zum EAS-EMG nicht-invasiv sind.
Die Parkinson-Krankheit ist durch motorische Symptome wie Ruhetremor, Steifheit und Verlangsamung der Bewegungen gekennzeichnet, die alle durch die Degeneration von Neuronen im zentralen Nervensystem erklärt werden können. Die nicht-motorischen Symptome von Parkinson-Patienten, wie Verstopfung, Blasenprobleme und orthostatische Hypotonie, haben jedoch in letzter Zeit zunehmend an Aufmerksamkeit gewonnen. In dieser Studie stellten wir fest, dass die BCR-Amplituden niedriger waren als in der Kontrollgruppe, aber höher als in der MSA-P-Gruppe. Dies deutet darauf hin, dass bestimmte Läsionen bei Morbus-Parkinson-Patienten höchstwahrscheinlich den BCR betreffen, dieser Zustand bei MSA-P-Patienten jedoch schwerwiegender ist. Das autonome Nervensystem ist bei MSA-P-Patienten stärker betroffen.
Gemeinsame nicht-motorische Symptome bei Morbus Parkinson und MSA-P-Patienten erschweren die Unterscheidung zwischen MSA-P- und Morbus Parkinson-Patienten, vor allem in einem frühen Stadium. In den letzten Jahrzehnten wurden verschiedene Tests eingesetzt, um dieses Problem zu lösen. Bildgebende Verfahren wie die Positronen-Emissions-Tomographie, diffusionsgewichtete Bilder und Diffusionstensor-Bilder wurden bereits eingesetzt (18-20). Die Anwendung von MRT verbessert die klinische Genauigkeit (6, 21). Außerdem ist die suszeptibilitätsgewichtete 3T-Bildgebung anfälliger für putaminale Veränderungen und Läsionsasymmetrie (21). Die Verwendung der Hirnvolumetrie mit MRT ist manchmal ineffizient (22). Bei leicht symptomatischen Parkinson-Patienten und MSA-P-Patienten wird die Hirnperfusion mit Hilfe der Einzelphotonen-Emissions-Computertomographie untersucht (23). Allerdings können bei dieser Technik einige Einflussfaktoren die Ergebnisse stören, und die Datenanalyse ist komplex und zeitaufwändig. Darüber hinaus sollten auch die Kosten der radiologischen Untersuchung berücksichtigt werden, insbesondere in Entwicklungsländern. Andere Methoden, wie die Messung des Liquorspiegels, sind nicht sehr genau (24, 25). Die Untersuchung der autonomen Nervenfunktion ist in den letzten Jahren zu einem Forschungsschwerpunkt geworden (7, 26, 27). Diese Methode besteht aus einer Batterie von kardiovaskulären autonomen Tests, einschließlich orthostatischer Hypotonie, systolischem und diastolischem Blutdruck und anderen Tests. Mit dieser Methode fanden Pilleri et al. (28) heraus, dass MSA-Patienten im Vergleich zu Parkinson-Patienten eine erhöhte nächtliche Herzfrequenz und einen geringeren nächtlichen Abfall der Herzfrequenz aufweisen. Die oben genannten Methoden haben Vor- und Nachteile; kein einziger Test kann sowohl eine hohe Sensitivität als auch eine hohe Spezifität aufweisen. Eine objektive Untersuchung bietet eine bessere Möglichkeit für eine genaue Differenzialdiagnose.
Unsere Studie hat einige Einschränkungen. Zum Beispiel war die Stichprobenpopulation unserer Studie auf verfügbare Patienten beschränkt. Außerdem wurden alle Patienten mit MSA-P und PD klinisch und nicht pathologisch diagnostiziert.
Zusammenfassend lässt sich sagen, dass wir einen Unterschied zwischen MSA-P- und PD-Patienten in der BCR beobachtet haben. Außerdem halten wir den BCR-Test für einen nicht-invasiven, überzeugenden, objektiven und wirtschaftlichen Ansatz zur Unterscheidung zwischen MSA-P- und Parkinson-Patienten. Eine ergänzende Studie mit mehr Fällen wird unsere Ergebnisse bestätigen. Weitere Anwendungen, einschließlich der Verfolgung der BCR-Veränderung mit dem Fortschreiten der MSA-P oder der Assoziation zwischen BCR-Parametern und der Prognose, könnten uns helfen, diese verheerenden neurologischen Krankheiten besser zu überwachen.
Ethikerklärung
Alle Teilnehmer gaben ihre schriftliche Einwilligung nach Aufklärung in Übereinstimmung mit der Deklaration von Helsinki und stimmten der Teilnahme an der Studie zu. Diese Studie wurde mit Genehmigung des Ethikausschusses der Forschungsverwaltung des First Affiliated Hospital of Wenzhou Medical University (CR2009041) durchgeführt.
Beiträge der Autoren
H-jH und X-yZ analysierten die Daten, schrieben und überarbeiteten den Artikel. Z-yW beteiligte sich an der Abfassung und Überarbeitung des Artikels. XW und W-lZ führten die klinischen Tests durch und sammelten die Daten. B-cC und C-fL konzipierten und gestalteten die Studie und holten die ethische Genehmigung ein.
Erklärung zu Interessenkonflikten
Die Autoren erklären, dass die Forschung ohne jegliche kommerzielle oder finanzielle Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagung
Wir danken Feng-ming Zhang von der School of the First Clinical Medical Sciences, Wenzhou Medical University, für die Unterstützung bei den Experimenten und die Beschaffung von Finanzmitteln.
Finanzierung
Diese Arbeit wurde durch das Undergraduate Innovation Project der WMU (Nr. wyx2016101006) finanziert.
2. Hughes AJ, Daniel SE, Kilford L, Lees AJ. Genauigkeit der klinischen Diagnose des idiopathischen Parkinson-Syndroms: eine klinisch-pathologische Studie über 100 Fälle. J Neurol Neurosurg Psychiatry (1992) 55(3):181-4. doi:10.1136/jnnp.55.3.181
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Terao Y, Fukuda H, Tokushige S, Inomata-Terada S, Yugeta A, Hamada M, et al. Is multiple system atrophy with cerebellar ataxia (MSA-C) like spinocerebellar ataxia and multiple system atrophy with parkinsonism (MSA-P) like Parkinson’s disease? Eine Sakkadenstudie zur Pathophysiologie. Clin Neurophysiol (2016) 127(2):1491-502. doi:10.1016/j.clinph.2015.07.035
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Skinner SA, Vodusek DB. Intraoperative Aufzeichnung des Bulbocavernosusreflexes. J Clin Neurophysiol (2014) 31(4):313-22. doi:10.1097/WNP.0000000000000054
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Ashraf VV, Taly AB, Nair KP, Rao S, Sridhar. Rolle der klinischen neurophysiologischen Tests bei der Bewertung der erektilen Dysfunktion bei Menschen mit Rückenmarkserkrankungen. Neurol India (2005) 53(1):32-5; Diskussion 35-6. doi:10.4103/0028-3886.15048
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Niu X, Shao B, Ni P, Wang X, Chen X, Zhu B, et al. Bulbocavernosus reflex and pudendal nerve somatosensory-evoked potentials responses in female patients with nerve system diseases. J Clin Neurophysiol (2010) 27(3):207-11. doi:10.1097/WNP.0b013e3181dd4fca
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Konno H, Yamamoto T, Iwasaki Y, Iizuka H. Shy-Drager-Syndrom und amyotrophe Lateralsklerose. Zytoarchitektonische und morphometrische Studien der sakralen autonomen Neuronen. J Neurol Sci (1986) 73(2):193-204. doi:10.1016/0022-510x(86)90130-9
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Han W, Cui LY, Hua D, Li BH. Beziehung zwischen der autonomen Dysfunktion der multiplen Systematrophie und dem Elektromyographen des äußeren Analsphinkters. Chin J Neurol (2006) 2:109-12. doi:10.3760/j.issn:1006-7876.2006.02.010
CrossRef Full Text | Google Scholar
19. Cnyrim CD, Kupsch A, Ebersbach G, Hoffmann KT. Diffusion Tensor Imaging bei idiopathischem Morbus Parkinson und Multisystematrophie (parkinsonscher Typ). Neurodegener Dis (2014) 13(1):1-8. doi:10.1159/000348512
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Hwang I, Sohn CH, Kang KM, Jeon BS, Kim HJ, Choi SH, et al. Differentiation of parkinsonism-predominant multiple system atrophy from idiopathic Parkinson disease using 3T susceptibility-weighted MR imaging, focusing on putaminal change and lesion asymmetry. AJNR Am J Neuroradiol (2015) 36(12):2227-34. doi:10.3174/ajnr.A4442
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Huppertz HJ, Moller L, Sudmeyer M, Hilker R, Hattingen E, Egger K, et al. Differentiation of neurodegenerative parkinsonian syndromes by volumetric magnetic resonance imaging analysis and support vector machine classification. Mov Disord (2016) 31(10):1506-17. doi:10.1002/mds.26715
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Song IU, Yoo I, Chung YA, Jeong J. The value of brain perfusion SPECT for differentiation between mildly symptomatic idiopathic Parkinson’s disease and the Parkinson variant of multiple system atrophy. Nucl Med Commun (2015) 36(10):1049-54. doi:10.1097/MNM.0000000000000354
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Ghaemi M, Hilker R, Rudolf J, Sobesky J, Heiss WD. Unterscheidung der Atrophie des multiplen Systems von der Parkinson-Krankheit: Beitrag der MRT-Volumetrie des Striatums und des Mittelhirns und der Multi-Tracer-PET-Bildgebung. J Neurol Neurosurg Psychiatry (2002) 73(5):517-23. doi:10.1136/jnnp.73.5.517
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Baschieri F, Calandra-Buonaura G, Doria A, Mastrolilli F, Palareti A, Barletta G, et al. Cardiovascular autonomic testing performed with a new integrated instrumental approach is useful in differentiating MSA-P from PD at an early stage. Parkinsonism Relat Disord (2015) 21(5):477-82. doi:10.1016/j.parkreldis.2015.02.011
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Roy S, Srivastava AK, Jaryal AK, Deepak KK. Kardiovaskuläre Reaktionen während des kalten Drucktests sind bei Morbus Parkinson und Multipler Systematrophie mit Parkinsonismus unterschiedlich. Clin Auton Res (2015) 25(4):219-24. doi:10.1007/s10286-015-0294-x
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Pilleri M, Levedianos G, Weis L, Gasparoli E, Facchini S, Biundo R, et al. Heart rate circadian profile in the differential diagnosis between Parkinson disease and multiple system atrophy. Parkinsonism Relat Disord (2014) 20(2):217-21. doi:10.1016/j.parkreldis.2013.11.006
PubMed Abstract | CrossRef Full Text | Google Scholar