- Introduction
- Materiały i Metody
- Podmiot
- Elektrofizjologia
- Bulbocavernosus Reflex
- Pudendal Nerve Somatosensory-Evoked Potential Responses
- Analiza statystyczna
- Wyniki
- Generalna charakterystyka pacjentów
- Pomiary BCR
- PomiaryPSEP
- Discussion
- Oświadczenie etyczne
- Wkład autorów
- Oświadczenie o konflikcie interesów
- Podziękowania
- Funding
Introduction
Różnicowanie pomiędzy chorobą Parkinsona (PD) a innymi chorobami parkinsonowskimi jest trudnym zagadnieniem w diagnostyce klinicznej (1). Objawy zaniku wieloukładowego z dominującym parkinsonizmem (MSA-P) i PD nakładają się na siebie i są podobne. U 10% pacjentów z PD, u których istnieje prawdopodobieństwo PD, ostatecznie rozpoznaje się MSA (2). PD wpływa przede wszystkim na układ ruchowy i czasami na autonomiczny układ nerwowy; MSA-P wpływa jednak głównie na autonomiczny układ nerwowy. Kiedy autonomiczny układ nerwowy jest zmieniony, często pojawiają się zaparcia, problemy z pęcherzem i niedociśnienie ortostatyczne (3, 4). Parkinsonizm połączony z zaburzeniami autonomicznego układu nerwowego utrudnia różnicowanie między MSA-P a pacjentami z PD (5). W celu ułatwienia tego rozróżnienia stosowano różne metody, z których najbardziej popularne są metody obrazowe (6). Badano również inne metody oparte na zaburzeniach autonomicznego układu nerwowego (7). Pomimo tych wcześniejszych prób, nadal potrzebne jest obiektywne badanie obejmujące autonomiczny układ nerwowy i dające większe możliwości diagnostyki różnicowej.
Odruch z mięśnia kulszowo-jamistego (BCR) wywołuje skurcz mięśnia kulszowo-jamistego poprzez stymulację nerwu ramiennego, a skurcz ten może być rejestrowany za pomocą techniki elektromiogramu. BCR testuje sygnały aferentne i eferentne nerwu pudendalnego, jak również rdzenia krzyżowego (8). Uszkodzenie łuku odruchowego wpływa na latencję i amplitudę BCR. W ciągu ostatnich 20 lat BCR był wykorzystywany w diagnostyce różnych chorób neurogennych, w tym impotencji neurogennej, wstrząsu rdzeniowego i zespołu cauda equine (9-11). Odpowiedzi potencjałów wywołanych somatosensorycznie z nerwu pudendalnego (PSEP) mają tę samą drogę z BCR przed wejściem do rdzenia kręgowego. Dlatego PSEP wraz z BCR mogą być wykorzystane do lokalizacji uszkodzenia w tym szlaku. Poprzednie badania naszej grupy sugerują, że nieprawidłowość BCR występuje u pacjentów z MSA (12). Biorąc pod uwagę, że MSA i PD mają te same objawy zaburzeń autonomicznego układu nerwowego, nieprawidłowość ta może występować również u pacjentów z PD. W niniejszym badaniu zamierzamy dokonać rozróżnienia między pacjentami z MSA-P i PD za pomocą pomiaru BCR. W szczególności porównano latencję i amplitudę BCR i PSEP u 38 prawdopodobnych pacjentów z MSA-P, 32 pacjentów z PD i 30 zdrowych osób. Przeprowadzono analizy statystyczne w celu zróżnicowania między MSA-P i PD.
Materiały i Metody
Podmiot
W tym badaniu 38 prawdopodobnych pacjentów z MSA-P i 32 pacjentów z PD zostało wybranych do udziału w badaniach elektrofizjologicznych między grudniem 2012 a październikiem 2014 roku. Wszyscy pacjenci zostali skierowani do First Affiliated Hospital of Wenzhou Medical University. Wszyscy pacjenci z MSA-P spełniali kryteria włączenia opublikowane w 2008 roku (13). Prawdopodobni pacjenci z MSA-P byli diagnozowani na podstawie dwóch kryteriów włączenia: niewydolności autonomicznej obejmującej nietrzymanie moczu (niezdolność do kontrolowania uwalniania moczu z pęcherza, z zaburzeniami erekcji u mężczyzn) lub ortostatyczny spadek ciśnienia krwi i słabo reagujący na lewodopę parkinsonizm (bradykinezja ze sztywnością, drżeniem lub niestabilnością postawy). Podobnie, wszyscy pacjenci z PD spełniali kliniczne kryteria diagnostyczne Movement Disorder Society (14). Pacjenci z PD charakteryzowali się drżeniem spoczynkowym, sztywnością, akinezją i niestabilnością postawy. Ponadto, wszyscy pacjenci byli oceniani w badaniu rezonansu magnetycznego (MRI) i podczas wizyty kontrolnej. Zrekrutowaliśmy również 30 zdrowych osób bez historii chorób neurologicznych lub psychiatrycznych jako grupę kontrolną. Wszystkie zdrowe grupy kontrolne przeszły dokładne badania kliniczne i neurologiczne. Wykluczono osoby z parkinsonizmem, ataksją, dysfunkcją autonomiczną lub chorobami neurologicznymi (np. padaczką lub udarem) w wywiadzie. Ponadto wykluczono mężczyzn z chorobami prostaty. Z badania MRI wykluczono osoby ze zmianami naczyniowo-mózgowymi lub zajmującymi przestrzeń.
Wszyscy uczestnicy wyrazili pisemną świadomą zgodę zgodnie z Deklaracją Helsińską i wyrazili zgodę na udział w badaniu. Badanie zostało przeprowadzone za zgodą Ethical Decision Committee of the Research Administration at the First Affiliated Hospital of Wenzhou Medical University (CR2009041).
Elektrofizjologia
System Keypoint EMG/EP (Dantec, Bristol, Wielka Brytania) został użyty do przeprowadzenia testów BCR i PSEP. Elektrodę uziemiającą umieszczano na udzie pacjentów w pozycji litotomijnej. Temperaturę powierzchni skóry utrzymywano powyżej 32°C.
Bulbocavernosus Reflex
U mężczyzn elektrody stymulujące w kształcie pierścienia umieszczano na ciele lub u nasady prącia. Biegun dodatni znajdował się przy corona glandis. U kobiet elektrody stymulujące w kształcie klamer umieszczano w okolicy spojenia łonowego. Biegun dodatni i ujemny umieszczano odpowiednio na łechtaczce i wargach sromowych. BCR rejestrowano za pomocą koncentrycznych elektrod igłowych wprowadzanych do moszny w okolicy okołoodbytniczej w pobliżu linii pośrodkowej. Natężenie bodźca wynosiło siedmiokrotność progu czuciowego danej osoby, a impedancja elektrody <5 kΩ. Stymulacja falą kwadratową wynosiła 1,9 impulsu/s, rejestrowano średnią wartość z 20 fal odbitych. Czas skanowania wynosił 5 ms/podział, zakres szerokości pasma od 10 Hz do 2 kHz, a czas trwania 100 ms. Latencje obliczano na podstawie początku bodźca i początku odpowiedzi odruchowej.
Pudendal Nerve Somatosensory-Evoked Potential Responses
Elektrody używane do wywoływania potencjałów nerwu pudendalnego były identyczne z tymi używanymi do wywoływania BCR i były przyłożone do tych samych miejsc. Jednakże, intensywność bodźca była trzykrotnie wyższa od progu czuciowego danej osoby. Podobnie, impedancja elektrody była utrzymywana na poziomie 5 kΩ. Częstotliwość fali kwadratowej wynosiła 5 impulsów/s i była uśredniona dla 200 fal. Czas skanowania ustawiono na 0,2 ms/podział, a odpowiedni czas trwania wynosił 100 ms, przy szerokości pasma od 10 Hz do 5 kHz. Elektroda rejestrująca umieszczona była 2 cm za Cz, a elektroda referencyjna na czole na Fpz. Fala PSEP P41 była wykrywana po dostarczeniu bodźca.
Analiza statystyczna
Dane analizowano przy użyciu Statistical Package for the Social Sciences 22.0 (IBM, CA, USA) i Stata SE 12 (StataCorp, LP, USA). Rozkład normalny i jednorodność wariancji określono za pomocą testu Kołmogorowa-Smirnowa i testu Shapiro-Wilka. Test chi kwadrat zastosowano do porównania częstości wywoływania BCR pomiędzy grupami MSA-P, PD i kontrolną. Jednokierunkową analizę wariancji (ANOVA) zastosowano do analizy różnic w parametrach BCR pomiędzy trzema grupami (MSA-P, PD i kontrolną) u mężczyzn. Parametry PSEP również analizowano za pomocą ANOVA. W przypadku stwierdzenia istotnych różnic zastosowano test wielokrotnych porównań Bonferroniego. Test ten ujawnił dalsze kontrasty między grupami. Test rang Kruskala-Wallisa zastosowano do porównania parametrów BCR i PSEP pomiędzy trzema grupami (MSA-P, PD i kontrolna) u kobiet. W celu dalszej oceny różnic między poszczególnymi grupami zastosowano test Nemenyi. Do oceny swoistości i czułości parametrów BCR wykorzystano analizę ROC (receiver operating characteristic). Wartość p ≤ 0,05 uznawano za istotną statystycznie.
Wyniki
Generalna charakterystyka pacjentów
W badaniu wzięło udział 38 prawdopodobnych pacjentów z MSA-P i 32 pacjentów z PD. Wiek pacjentów z prawdopodobnym MSA-P wahał się od 36 do 74 lat, a średnia wieku wynosiła 54,21 ± 7,92 roku. U 39% pacjentów (15 przypadków) występowały zaburzenia erekcji, u 45% pacjentów (17 przypadków) nietrzymanie moczu, a u 76% pacjentów (22 przypadki) niedociśnienie ortostatyczne. Ponadto wiek pacjentów z rozpoznaną PD wahał się od 35 do 77 lat, a średnia wieku wynosiła 55,23 ± 8,75 lat. U 22% pacjentów (7 przypadków) występowały zaburzenia erekcji, u 3% pacjentów (1 przypadek) nietrzymanie moczu, a u 16% pacjentów (5 przypadków) niedociśnienie ortostatyczne. Zarówno w grupie MSA-P, jak i PD wystąpiła niewydolność autonomiczna (patrz Tabela 1).
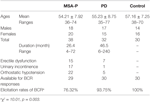
Tabela 1. Ogólna charakterystyka i częstość wywoływania latencji odruchu z bulbocavernosus (BCR) pomiędzy grupami zaniku wieloukładowego z dominującym parkinsonizmem (MSA-P), choroby Parkinsona (PD) i grupami kontrolnymi.
Pomiary BCR

Tabela 2. Porównanie średniej lub mediany latencji odruchu bulbocavernosus pomiędzy grupą zaniku wieloukładowego z dominującym parkinsonizmem (MSA-P), chorobą Parkinsona (PD) i grupą kontrolną.

Rysunek 1. Latencje i amplitudy odruchu pęcherzowo-jamistego (Bulbocavernosus reflex – BCR) pomiędzy grupami atrofii wieloukładowej z dominującym parkinsonizmem (MSA-P), choroby Parkinsona (PD) i grupą kontrolną u mężczyzn (A) i kobiet (B). Latencja BCR nie różniła się istotnie między grupą kontrolną a grupą pacjentów z PD, ale pacjenci z MSA mieli wydłużoną latencję w porównaniu z innymi grupami u mężczyzn (C) i kobiet (D). Amplitudy BCR były znacząco niższe u pacjentów z MSA-P niż w grupie kontrolnej, a amplitudy u pacjentów z PD mieściły się pomiędzy amplitudami w grupie kontrolnej i MSA-P.

Tabela 3. Porównanie średnich lub median amplitud odruchu bulbocavernosus pomiędzy grupą zaniku wieloukładowego z dominującym parkinsonizmem (MSA-P), chorobą Parkinsona (PD) i grupą kontrolną.
PomiaryPSEP
Nie było istotnych różnic pomiędzy MSA-P, PD i grupami kontrolnymi ani u mężczyzn ani u kobiet (patrz Tabela 4).

Tabela 4. Comparison of the mean pudendal nerve somatosensory-evoked potential responses P41 latencies and amplitudes between multiple system atrophy with predominant parkinsonism (MSA-P), Parkinson’s disease (PD), and control groups.
Discussion
W tym badaniu odkryliśmy, że różnica stwierdzona w parametrach BCR może pomóc w odróżnieniu MSA-P od PD. Pacjenci z MSA-P wykazywali niższy wskaźnik elicytacji BCR niż pacjenci z PD (76,3 vs 90,9%). Parametry BCR wykazały różnice pomiędzy grupami MSA-P, PD i kontrolną. Pacjenci z MSA-P wykazywali dłuższe latencje i niższe amplitudy w porównaniu z grupą PD. Ponadto oba te parametry mogły istotnie różnicować MSA-P przy użyciu krzywej ROC.
Doferentna somatyczna droga czuciowa BCR obejmuje nerw pośrodkowy. Eferencyjna somatyczna droga ruchowa składa się z segmentów rdzeniowych S2-S4, w tym z jądra Onufa i nerwu pośrodkowego. Impuls powoduje skurcz mięśnia bulbocavernosus (8, 15). Aferentna somatyczna droga czuciowa PSEP składa się z dwóch segmentów, przy czym segment przedni ma wspólną drogę aferentną z BCR. Impuls jest następnie przekazywany do kory mózgowej przez rdzeń kręgowy. Połączenie BCR i PSEP może być użyte do zlokalizowania zmiany w niektórych neuropatiach, takich jak cukrzycowy pęcherz neurogenny i zespół cauda equine.
W tym badaniu, pacjenci z MSA-P i PD mieli nieprawidłowe BCR i normalne PSEP. Wskaźniki elicytacji u pacjentów z MSA-P były niższe niż u pacjentów z PD. Ponadto, nie udało się wywołać BCR u 23,68% pacjentów z MSA-P. Uszkodzenie łuku odruchowego w BCR u pacjentów z MSA-P było poważniejsze niż u pacjentów z PD. Ponadto, pacjenci z MSA-P wykazywali niższe amplitudy BCR niż pacjenci z PD. Jednakże PSEP nie wykazały żadnych różnic pomiędzy pacjentami z MSA-P, PD i osobami z grupy kontrolnej. Dane z PSEP nie mogą być użyte do rozróżnienia między pacjentami z MSA-P i PD w naszym badaniu. Ścieżka PSEPs wydawała się być kompletna zarówno u pacjentów z MSA-P jak i PD. Ponieważ BCR i PSEP mają ten sam szlak aferentny, zmiany są prawdopodobnie zlokalizowane na szlaku eferentnym, który składa się z segmentów rdzeniowych S2-S4, w tym jądra Onufa, lub na nerwie pudendalnym. Wyniki te potwierdzają rezultaty kilku wcześniejszych badań. Konno i wsp. (16) stwierdzili deprywacyjną utratę somatycznych neuronów ruchowych w jądrze Onufa. Co więcej, wcześniejsze badania Ref. (17) wykazały, że elektromiografia zewnętrznego zwieracza odbytu (EAS-EMG) współdzieli tę samą ścieżkę z BCR. Ponadto, ich wyniki wskazują również na degenerację komórek rogów przednich jądra Onufa. Jak wynika z tych badań, zmiana w BCR jest prawdopodobnie umiejscowiona w jądrze Onufa. Ważne jest również, aby zauważyć, że w porównaniu z EAS-EMG, metody stosowane w naszym badaniu są nieinwazyjne.
Choroba Parkinsona charakteryzuje się objawami motorycznymi, takimi jak drżenie spoczynkowe, sztywność i powolność ruchów, które mogą być wyjaśnione przez degenerację neuronów w centralnym układzie nerwowym. Jednak ostatnio coraz więcej uwagi poświęca się objawom niezwiązanym z ruchem u pacjentów z PD, takim jak zaparcia, problemy z pęcherzem moczowym i niedociśnienie ortostatyczne. W tym badaniu stwierdziliśmy, że amplitudy BCR były niższe niż w grupie kontrolnej, ale wyższe niż w grupie MSA-P. Sugeruje to, że pewne zmiany najprawdopodobniej dotyczą BCR u pacjentów z PD, ale stan ten jest poważniejszy u pacjentów z MSA-P. Autonomiczny układ nerwowy jest poważniej zaburzony u pacjentów z MSA-P.
Wspólne objawy pozamotoryczne u pacjentów z PD i MSA-P utrudniają różnicowanie diagnostyki pacjentów z MSA-P i PD, zwłaszcza na wczesnym etapie. W ciągu ostatnich kilku dekad stosowano wiele testów w celu rozwiązania tego problemu. Metody obrazowania, takie jak pozytonowa tomografia emisyjna, obraz ważony dyfuzją i obraz tensora dyfuzji, były stosowane już wcześniej (18-20). Zastosowanie MRI poprawia dokładność kliniczną (6, 21). Ponadto, obrazowanie 3T metodą podatności jest bardziej podatne na zmiany putaminalne i asymetrię zmian (21). Zastosowanie wolumetrii mózgu z MRI jest niekiedy nieefektywne (22). U łagodnie objawowych pacjentów z PD i MSA-P perfuzja mózgu jest zmieniana za pomocą metody tomografii komputerowej z emisją pojedynczych fotonów (23). Jednak w przypadku tej techniki jakiś czynnik wpływający może zaburzyć wyniki, a proces analizy danych jest złożony i czasochłonny. Ponadto należy wziąć pod uwagę koszt badania radiologicznego, zwłaszcza w krajach rozwijających się. Inne metody, takie jak pomiar stężenia płynu mózgowo-rdzeniowego, nie są wystarczająco dokładne (24, 25). Badanie funkcji nerwów autonomicznych stało się w ostatnich latach przedmiotem zainteresowania badaczy (7, 26, 27). Metoda ta obejmuje baterię testów autonomicznych układu sercowo-naczyniowego, w tym hipotensję ortostatyczną, skurczowe i rozkurczowe ciśnienie krwi oraz inne testy. Stosując tę metodę, Pilleri i wsp. (28) stwierdzili, że pacjenci z MSA wykazują zwiększoną nocną częstość akcji serca i zmniejszony nocny spadek częstości akcji serca w porównaniu z pacjentami z PD. Powyższe metody mają swoje zalety i wady; żaden pojedynczy test nie może mieć zarówno korzystnej czułości, jak i swoistości. Obiektywne badanie daje większą możliwość dokładnej diagnostyki różnicowej.
Nasze badanie ma pewne ograniczenia. Na przykład, populacja próby w naszym badaniu była ograniczona do dostępnych pacjentów. Ponadto, wszyscy pacjenci z MSA-P i PD zostali zdiagnozowani klinicznie, a nie patologicznie.
W podsumowaniu, zaobserwowaliśmy różnicę między pacjentami z MSA-P i PD w BCR. Ponadto uważamy, że test BCR jest nieinwazyjnym, przekonującym, obiektywnym i ekonomicznym podejściem do dyskryminacji między pacjentami z MSA-P i PD. Uzupełniające badania z większą liczbą przypadków potwierdzą nasze wyniki. Dalsze zastosowania, w tym śledzenie zmian BCR z progresją MSA-P lub związek między parametrami BCR a rokowaniem, mogą pomóc nam lepiej monitorować te wyniszczające choroby neurologiczne.
Oświadczenie etyczne
Wszyscy uczestnicy wyrazili pisemną świadomą zgodę zgodnie z Deklaracją Helsińską i wyrazili zgodę na udział w badaniu. Badanie zostało przeprowadzone za zgodą Ethical Decision Committee of the Research Administration at the First Affiliated Hospital of Wenzhou Medical University (CR2009041).
Wkład autorów
H-jH i X-yZ przeanalizowali dane, napisali i poprawili artykuł. Z-yW uczestniczył w pisaniu i poprawił artykuł. XW i W-lZ przeprowadzili badania kliniczne i zebrali dane. B-cC i C-fL wymyślili i zaprojektowali badanie oraz uzyskali zgodę etyczną.
Oświadczenie o konflikcie interesów
Autorzy oświadczają, że badania zostały przeprowadzone przy braku jakichkolwiek komercyjnych lub finansowych powiązań, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Podziękowania
Wdzięczni jesteśmy Feng-ming Zhang ze Szkoły Pierwszych Klinicznych Nauk Medycznych, Wenzhou Medical University, za pomoc w przeprowadzeniu eksperymentu i pozyskaniu finansowania.
Funding
Ta praca została sfinansowana przez Undergraduate Innovation Project of WMU (No. wyx2016101006).
2. Hughes AJ, Daniel SE, Kilford L, Lees AJ. Accuracy of clinical diagnosis of idiopathic Parkinson’s disease: a clinico-pathological study of 100 cases. J Neurol Neurosurg Psychiatry (1992) 55(3):181-4. doi:10.1136/jnnp.55.3.181
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Terao Y, Fukuda H, Tokushige S, Inomata-Terada S, Yugeta A, Hamada M, et al. Is multiple system atrophy with cerebellar ataxia (MSA-C) like spinocerebellar ataxia and multiple system atrophy with parkinsonism (MSA-P) like Parkinson’s disease? A saccade study on pathophysiology. Clin Neurophysiol (2016) 127(2):1491-502. doi:10.1016/j.clinph.2015.07.035
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Skinner SA, Vodusek DB. Śródoperacyjna rejestracja odruchu bulbocavernosus. J Clin Neurophysiol (2014) 31(4):313-22. doi:10.1097/WNP.00000000000054
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Ashraf VV, Taly AB, Nair KP, Rao S, Sridhar. Role of clinical neurophysiological tests in evaluation of erectile dysfunction in people with spinal cord disorders. Neurol India (2005) 53(1):32-5; dyskusja 35-6. doi:10.4103/0028-3886.15048
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Niu X, Shao B, Ni P, Wang X, Chen X, Zhu B, et al. Bulbocavernosus reflex and pudendal nerve somatosensory-evoked potentials responses in female patients with nerve system diseases. J Clin Neurophysiol (2010) 27(3):207-11. doi:10.1097/WNP.0b013e3181dd4fca
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Konno H, Yamamoto T, Iwasaki Y, Iizuka H. Shy-Drager syndrome and amyotrophic lateral sclerosis. Cytoarchitectonic and morphometric studies of sacral autonomic neurons. J Neurol Sci (1986) 73(2):193-204. doi:10.1016/0022-510x(86)90130-9
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Han W, Cui LY, Hua D, Li BH. Związek między dysfunkcją autonomiczną atrofii wieloukładowej a elektromiografem zewnętrznego zwieracza odbytu. Chin J Neurol (2006) 2:109-12. doi:10.3760/j.issn:1006-7876.2006.02.010
CrossRef Full Text | Google Scholar
19. Cnyrim CD, Kupsch A, Ebersbach G, Hoffmann KT. Diffusion tensor imaging in idiopathic Parkinson’s disease and multisystem atrophy (parkinsonian type). Neurodegener Dis (2014) 13(1):1-8. doi:10.1159/000348512
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Hwang I, Sohn CH, Kang KM, Jeon BS, Kim HJ, Choi SH, et al. Differentiation of parkinsonism-predominantant multiple system atrophy from idiopathic Parkinson disease using 3T susceptibility-weighted MR imaging, focusing on putaminal change and lesion asymmetry. AJNR Am J Neuroradiol (2015) 36(12):2227-34. doi:10.3174/ajnr.A4442
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Huppertz HJ, Moller L, Sudmeyer M, Hilker R, Hattingen E, Egger K, et al. Differentiation of neurodegenerative parkinsonian syndromes by volumetric magnetic resonance imaging analysis and support vector machine classification. Mov Disord (2016) 31(10):1506-17. doi:10.1002/mds.26715
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Song IU, Yoo I, Chung YA, Jeong J. The value of brain perfusion SPECT for differentiation between mildly symptomatic idiopathic Parkinson’s disease and the Parkinson variant of multiple system atrophy. Nucl Med Commun (2015) 36(10):1049-54. doi:10.1097/MNM.00000000000354
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Ghaemi M, Hilker R, Rudolf J, Sobesky J, Heiss WD. Differentiating multiple system atrophy from Parkinson’s disease: contribution of striatal and midbrain MRI volumetry and multi-tracer PET imaging. J Neurol Neurosurg Psychiatry (2002) 73(5):517-23. doi:10.1136/jnnp.73.5.517
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Baschieri F, Calandra-Buonaura G, Doria A, Mastrolilli F, Palareti A, Barletta G, et al. Cardiovascular autonomic testing performed with a new integrated instrumental approach is useful in differentiating MSA-P from PD at an early stage. Parkinsonism Relat Disord (2015) 21(5):477-82. doi:10.1016/j.parkreldis.2015.02.011
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Roy S, Srivastava AK, Jaryal AK, Deepak KK. Cardiovascular responses during cold pressor test are different in Parkinson disease and multiple system atrophy with parkinsonism. Clin Auton Res (2015) 25(4):219-24. doi:10.1007/s10286-015-0294-x
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Pilleri M, Levedianos G, Weis L, Gasparoli E, Facchini S, Biundo R, et al. Heart rate circadian profile in the differential diagnosis between Parkinson disease and multiple system atrophy. Parkinsonism Relat Disord (2014) 20(2):217-21. doi:10.1016/j.parkreldis.2013.11.006
PubMed Abstract | CrossRef Full Text | Google Scholar
.