- Bevezetés
- Anyagok és módszerek
- Alanyok
- Elektrofiziológia
- Bulbocavernosus reflex
- Pudendális ideg szomatoszenzoros kiváltott potenciálválaszok
- Statisztikai elemzés
- Eredmények
- Általános betegjellemzők
- BCR mérések
- PSEP mérések
- Diszkusszió
- Etikai nyilatkozat
- A szerzők hozzájárulása
- Érdekütközésre vonatkozó nyilatkozat
- Köszönet
- Finanszírozás
Bevezetés
A Parkinson-kór (PD) és más parkinsonos betegségek megkülönböztetése nehéz kérdés a klinikai diagnózisban (1). A domináns parkinsonizmussal járó multiplex rendszeratrófia (MSA-P) és a Parkinson-kór tünetei egymásra épülnek és hasonlóak. A valószínűsíthetően Parkinson-kóros betegek tíz százalékánál végül MSA-t diagnosztizálnak (2). A PD túlnyomórészt a motoros rendszert érinti, és néha a vegetatív idegrendszert is befolyásolja; az MSA-P azonban elsősorban a vegetatív idegrendszert érinti. A vegetatív idegrendszer megváltozásakor gyakran előfordul székrekedés, hólyagproblémák és ortosztatikus hipotenzió (3, 4). A vegetatív idegrendszeri zavarral párosuló parkinsonizmus miatt nehéz különbséget tenni az MSA-P és a Parkinson-kóros betegek között (5). A megkülönböztetés segítésére különböző módszereket alkalmaztak, amelyek közül a képalkotó módszerek a legnépszerűbbek (6). Más, a vegetatív idegrendszeri zavarokon alapuló módszereket is vizsgáltak (7). E korábbi kísérletek ellenére még mindig szükség van egy olyan objektív vizsgálatra, amely a vegetatív idegrendszert is bevonja, és amely nagyobb lehetőséget ad a differenciáldiagnózisra.
A bulbocavernosus reflex (BCR) a pudendalis ideg ingerlésével a bulbocavernosus izom összehúzódását okozza, és ez az összehúzódás elektromiogram technikával rögzíthető. A BCR a nervus pudendalis afferens és efferens jeleit, valamint a keresztcsonti gerincvelőt vizsgálja (8). A reflexív sérülése befolyásolja a BCR latenciáit és amplitúdóit. Az elmúlt 20 évben a BCR-t különböző neurogén betegségek, köztük a neurogén impotencia, a spinalis sokk és a cauda equine szindróma diagnózisában használták (9-11). A szeméremideg szomatoszenzoros kiváltott potenciálválaszai (PSEP) a gerincvelőbe való bejutás előtt ugyanazon az úton haladnak, mint a BCR. Ezért a PSEP a BCR-rel együtt felhasználható a pályán belüli elváltozás lokalizálására. Csoportunk korábbi kutatásai arra utalnak, hogy a BCR rendellenessége MSA betegeknél fennáll (12). Tekintettel arra, hogy az MSA és a Parkinson-kór közös tünetei a vegetatív idegrendszeri zavarok, a rendellenesség a Parkinson-kórban szenvedő betegeknél is fennállhat. Ebben a vizsgálatban a BCR-mérés segítségével kívánunk különbséget tenni az MSA-P és a PD betegek között. Pontosabban, vizsgálatunkban összehasonlítottuk a BCR és a PSEP latenciáit és amplitúdóit 38 valószínűsíthető MSA-P betegnél, 32 PD betegnél és 30 normál, egészséges személynél. Statisztikai elemzéseket végeztünk az MSA-P és a PD közötti különbségtétel érdekében.
Anyagok és módszerek
Alanyok
A vizsgálatban 38 valószínűsíthető MSA-P beteget és 32 PD beteget választottunk ki, akik 2012 decembere és 2014 októbere között vettek részt az elektrofiziológiai vizsgálatokban. Valamennyi beteget a Wenzhou Orvosi Egyetem első kapcsolt kórházába utalták. Valamennyi MSA-P beteg megfelelt a 2008-ban közzétett befogadási kritériumoknak (13). A valószínűsíthető MSA-P betegeket két felvételi kritérium alapján diagnosztizálták: vizeletinkontinenciával járó vegetatív elégtelenség (a vizelet hólyagból való kibocsátásának kontrollálására való képtelenség, férfiaknál merevedési zavarral) vagy ortosztatikus vérnyomáscsökkenés és rosszul levodopára reagáló parkinsonizmus (bradikinézia merevséggel, remegéssel vagy poszturális instabilitással). Hasonlóképpen minden Parkinson-kóros beteg megfelelt a Movement Disorder Society klinikai diagnosztikai kritériumainak (14). A PD-betegeket nyugalmi tremor, rigiditás, akinézia és poszturális instabilitás jellemezte. Ezenkívül minden beteget mágneses rezonanciás képalkotás (MRI) és egy nyomonkövetési vizit során értékeltek. Kontrollcsoportként 30 egészséges, neurológiai vagy pszichiátriai betegséggel nem rendelkező személyt is felvettünk. Minden egészséges kontrollszemély alapos klinikai és neurológiai vizsgálaton esett át. A parkinsonizmus, ataxia, autonóm diszfunkció vagy neurológiai betegségek (pl. epilepszia vagy stroke) miatt kórelőzményben szereplő alanyokat kizártuk. Kizárták továbbá a prosztatabetegségben szenvedő férfi alanyokat. Az MRI segítségével kizárták az agyi érrendszeri vagy térfoglaló elváltozásokban szenvedő alanyokat.
Minden résztvevő a Helsinki Nyilatkozatnak megfelelően írásos beleegyezését adta, és beleegyezett a vizsgálatban való részvételbe. A vizsgálatot a Wenzhou Orvosi Egyetem Első Kórházának Kutatási Igazgatósága Etikai Döntéshozó Bizottságának jóváhagyásával végezték (CR2009041).
Elektrofiziológia
A BCR és PSEP vizsgálatok elvégzésére a Keypoint EMG/EP rendszert (Dantec, Bristol, Egyesült Királyság) használták. Egy földelő elektródát helyeztek el a lithotómia helyzetben lévő betegek combjánál. A bőrfelület hőmérsékletét 32°C felett tartották.
Bulbocavernosus reflex
A férfiaknál gyűrű alakú ingerlő elektródákat helyeztek el a testen vagy a pénisz tövénél. A pozitív pólus a corona glandisnál helyezkedett el. Nőknél bilincs-stimuláló elektródákat helyeztek el a szeméremtest szimphízisének közelében. A pozitív és negatív pólusokat a csiklóra, illetve a szeméremajkakra helyezték. A BCR-t a herezacskóba a perianális régióban, a középvonal közelében a herezacskóba helyezett koncentrikus tűelektródákkal rögzítették. Az ingerintenzitás az egyén érzékelési küszöbének hétszerese volt, és az elektródák impedanciája <5 kΩ volt. A négyszöghullám ingerlése 1,9 impulzus/s volt, és 20 reflexiós hullám átlagértékét rögzítettük. A pásztázási idő 5 ms/osztás volt, a sávszélesség-tartomány 10 Hz és 2 kHz között volt, a perzisztenciaidő pedig 100 ms. A latenciákat az ingerület kezdete és a reflexválasz kezdete alapján számoltuk ki.
Pudendális ideg szomatoszenzoros kiváltott potenciálválaszok
A pudendális idegpotenciálok kiváltására használt elektródák azonosak voltak a BCR kiváltására használtakkal, és ugyanazokra a helyekre helyeztük őket. Az inger intenzitása azonban az egyén érzékelési küszöbének háromszorosa volt. Hasonlóképpen, az elektródák impedanciáját 5 kΩ-on tartottuk. A négyszöghullám frekvenciája 5 impulzus/s volt, és 200 hullámra átlagolták. A pásztázási időt 0,2 ms/osztás értékre állítottuk be, a vonatkozó perzisztenciaidő pedig 100 ms volt, 10 Hz és 5 kHz közötti sávszélességgel. A felvételi elektróda a Cz mögött 2 cm-re, a referenciaelektróda pedig a homlokon, az Fpz-nél volt elhelyezve. A PSEP P41 hullámot az inger leadása után detektáltuk.
Statisztikai elemzés
Az adatokat a Statistical Package for the Social Sciences 22.0 (IBM, CA, USA) és a Stata SE 12 (StataCorp, LP, USA) segítségével elemeztük. A normál eloszlást és a variancia homogenitását a Kolmogorov-Smirnov teszt és a Shapiro-Wilk teszt segítségével állapítottuk meg. Chi-négyzet tesztet használtunk a BCR-ek kiváltási arányának összehasonlítására az MSA-P, a PD és a kontrollcsoportok között. Egyirányú varianciaanalízist (ANOVA) használtunk a BCR paraméterek közötti különbségek elemzésére a három csoport (MSA-P, PD és kontroll) között a hímeknél. A PSEP paramétereket szintén ANOVA-val elemezték. Bonferroni többszörös összehasonlító tesztet alkalmaztunk, amikor szignifikáns különbségeket azonosítottunk. Ez a teszt további kontrasztokat tárt fel a csoportok között. Kruskal-Wallis rangtesztet alkalmaztunk a BCR és PSEP paraméterek összehasonlítására a három (MSA-P, PD és kontroll) között a nőstényeknél. Nemenyi tesztet alkalmaztunk az egyes csoportok közötti különbségek további értékelésére. A BCR-paraméterek specificitásának és érzékenységének értékelésére ROC-analízist (receiver operating characteristic analysis) alkalmaztak. A p ≤ 0,05 értéket statisztikailag szignifikánsnak tekintették.
Eredmények
Általános betegjellemzők
A vizsgálatban 38 valószínűsíthető MSA-P beteg és 32 PD beteg vett részt. A valószínűsíthető MSA-P betegek életkora 36 és 74 év között mozgott, az átlagéletkor 54,21 ± 7,92 év volt. A betegek 39%-ának (15 eset) merevedési zavara, 45%-ának (17 eset) vizeletinkontinenciája és 76%-ának (22 eset) ortosztatikus hipotenziója volt. Ezenkívül a diagnosztizált Parkinson-kóros betegek életkora 35 és 77 év között volt, az átlagéletkor 55,23 ± 8,75 év volt. A betegek 22%-ának (7 eset) volt merevedési zavara, a betegek 3%-ának (1 eset) vizeletinkontinencia, és a betegek 16%-ának (5 eset) ortosztatikus hipotenziója. Mind az MSA-P, mind a PD csoportban autonóm elégtelenségben szenvedett (lásd az 1. táblázatot).
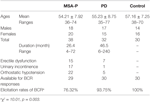
Táblázat 1. táblázat. A bulbocavernosus reflex (BCR) latenciáinak általános jellemzői és kiváltási arányai a domináns parkinsonizmussal járó multiplex rendszeratrófia (MSA-P), a Parkinson-kór (PD) és a kontrollcsoportok között.
BCR mérések

Táblázat 2. táblázat. Az átlagos vagy medián bulbocavernosus reflex latenciák összehasonlítása a multiplex rendszer atrófia domináns parkinsonizmussal (MSA-P), a Parkinson-kór (PD) és a kontrollcsoportok között.

1. ábra. Bulbocavernosus reflex (BCR) latenciák és amplitúdók a multiplex rendszer atrófia domináns parkinsonizmussal (MSA-P), Parkinson-kór (PD) és kontrollcsoportok között férfiaknál (A) és nőknél (B). A BCR latenciák nem különböztek szignifikánsan a kontroll és a PD betegek között, de az MSA betegek latenciái meghosszabbodtak a többi csoporthoz képest a férfiaknál (C) és a nőknél (D). A BCR-amplitúdók szignifikánsan alacsonyabbak voltak az MSA-P betegeknél, mint a kontrollcsoportban, és a PD betegek amplitúdói a kontroll és az MSA-P amplitúdók közé estek.

3. táblázat. Az átlagos vagy medián bulbocavernosus reflex amplitúdók összehasonlítása a multiplex rendszer atrófia domináns parkinsonizmussal (MSA-P), a Parkinson-kór (PD) és a kontrollcsoportok között.
PSEP mérések
Nem volt szignifikáns különbség az MSA-P, a PD és a kontrollcsoportok között sem a férfiak, sem a nők esetében (lásd 4. táblázat).

4. táblázat. A pudendalis ideg szomatoszenzoros kiváltott potenciálválaszok átlagos P41 latenciáinak és amplitúdóinak összehasonlítása a multiplex rendszer atrófia domináns parkinsonizmussal (MSA-P), a Parkinson-kór (PD) és a kontrollcsoportok között.
Diszkusszió
Ebben a vizsgálatban felfedeztük, hogy a BCR paraméterekben talált különbség segíthet az MSA-P és a PD megkülönböztetésében. Az MSA-P betegek alacsonyabb BCR kiváltási arányt mutattak, mint a PD betegek (76,3 vs. 90,9%). A BCR paraméterek különbséget mutattak az MSA-P, a PD és a kontrollcsoportok között. Az MSA-P betegek hosszabb latenciákat és alacsonyabb amplitúdókat mutattak, mint a PD csoport. Ezenkívül mindkét paraméter szignifikánsan meg tudta különböztetni az MSA-P-t egy ROC-görbe segítségével.
A BCR afferens szomatikus szenzoros pályája magában foglalja a pudendalis idegeket. Az efferens szomatikus motoros pálya az S2-S4 gerincvelői szegmensekből áll, beleértve az Onuf magot és a pudendalis ideget. Az impulzus összehúzza a bulbocavernosus izmot (8, 15). A PSEP-k afferens szomatikus szenzoros pályája két szegmensből áll, és az elülső szegmens ugyanazon az afferens pályán osztozik a BCR-rel. Az impulzus ezután a gerincvelőn keresztül az agykéregbe jut. A BCR és a PSEP-k kombinációja felhasználható az elváltozás lokalizálására bizonyos neuropathiákban, mint például a diabéteszes neurogén hólyag és a cauda equine szindróma.
Ebben a vizsgálatban az MSA-P és a PD betegeknél kóros BCR és normális PSEP volt. Az MSA-P betegek kiváltási aránya alacsonyabb volt, mint a PD betegeké. Ezenkívül az MSA-P betegek 23,68%-ánál nem sikerült a BCR-t kiváltani. Az MSA-P betegek BCR-ében a reflexív sérülése súlyosabb volt, mint a PD betegeknél. Továbbá az MSA-P betegek alacsonyabb BCR amplitúdót mutattak, mint a PD betegek. A PSEP-k azonban nem mutattak különbséget az MSA-P, a PD és a kontrollszemélyek között. A PSEP-adatok nem használhatók az MSA-P és a PD betegek megkülönböztetésére a mi vizsgálatunkban. A PSEP-k útja teljesnek tűnt mind az MSA-P, mind a PD betegeknél. Mivel a BCR és a PSEP-k ugyanazt az afferens pályát használják, az elváltozások valószínűleg az efferens pályán helyezkednek el, amely az S2-S4 gerincvelői szegmensekből áll, beleértve az Onuf magot is, vagy a pudendalis idegben. Ezek az eredmények alátámasztják több korábbi vizsgálat eredményeit. Konno és munkatársai (16) a szomatikus motoros neuronok deprivációs veszteségét találták az Onuf magban. Továbbá a korábbi tanulmányok a Ref. (17) azt találták, hogy a külső anális záróizom elektromiográfia (EAS-EMG) ugyanazon az útvonalon osztozik a BCR-rel. Ezenkívül eredményeik az Onuf mag elülső szarvsejtjének degenerációját is mutatják. E vizsgálatok szerint a BCR-ben lévő elváltozás valószínűleg az Onuf magban helyezkedik el. Azt is fontos megjegyezni, hogy az EAS-EMG-hez képest a mi vizsgálatunkban alkalmazott módszerek nem invazívak.
A Parkinson-kórra jellemzőek a motoros tünetek, mint például a nyugalmi remegés, a merevség és a mozgás lassúsága, amelyek mind a központi idegrendszerben lévő idegsejtek degenerációjával magyarázhatók. Az utóbbi időben azonban egyre nagyobb figyelmet kapnak a Parkinson-kóros betegek nem motoros tünetei, mint például a székrekedés, a hólyagproblémák és az ortosztatikus hipotenzió. Ebben a vizsgálatban azt találtuk, hogy a BCR-amplitúdók alacsonyabbak voltak, mint a kontrollcsoportban, de magasabbak, mint az MSA-P csoportban. Ez arra utal, hogy bizonyos elváltozások valószínűleg a BCR-t érintik a PD betegeknél, de ez az állapot súlyosabb az MSA-P betegeknél. A vegetatív idegrendszer súlyosabban érintett az MSA-P betegeknél.
A PD és az MSA-P betegek közös nem-motoros tünetei megnehezítik az MSA-P és a PD betegek differenciált diagnózisát, különösen a korai szakaszban. Az elmúlt évtizedekben többféle tesztet alkalmaztak, hogy megpróbálják megoldani ezt a problémát. Korábban olyan képalkotó módszereket alkalmaztak, mint a pozitronemissziós tomográfia, a diffúzió súlyozott kép és a diffúziós tenzor kép (18-20). Az MRI alkalmazása valóban javítja a klinikai pontosságot (6, 21). Ezenkívül a 3T szuszceptibilitás-súlyozott képalkotás érzékenyebb a putaminális változásokra és az elváltozás aszimmetriájára (21). Az agyi volumetria alkalmazása MRI-vel néha nem hatékony (22). Enyhe tüneteket mutató PD- és MSA-P-betegeknél az agyi perfúzió az egyfotonemissziós komputertomográfiás módszerrel megváltozik (23). Ezzel a technikával azonban valamilyen befolyásoló tényező megzavarhatja az eredményeket, és az adatelemzés folyamata összetett és időigényes. Ezenkívül a radiológiai vizsgálat költségeit is figyelembe kell venni, különösen a fejlődő országokban. Más módszerek, például az agy-gerincvelői folyadék szintjének mérése nem elég pontos (24, 25). A vegetatív idegműködés vizsgálata az utóbbi években került a kutatások középpontjába (7, 26, 27). Ez a módszer kardiovaszkuláris autonóm tesztek sorozatából áll, beleértve az ortosztatikus hipotenziót, a szisztolés és diasztolés vérnyomást és egyéb vizsgálatokat. E módszer alkalmazásával Pilleri és munkatársai (28) azt találták, hogy az MSA-betegeknél a PD-betegekhez képest megnövekedett éjszakai szívfrekvencia és csökkent éjszakai szívfrekvencia-csökkenés volt megfigyelhető. A fenti módszereknek vannak előnyei és hátrányai; egyetlen teszt sem rendelkezhet egyszerre kedvező érzékenységgel és specificitással. Az objektív vizsgálat nagyobb lehetőséget biztosít a pontos differenciáldiagnózisra.
Vizsgálatunknak vannak bizonyos korlátai. Például vizsgálatunk mintapopulációja a rendelkezésre álló betegekre korlátozódott. Ezenkívül az összes MSA-P és PD beteget klinikai, nem pedig patológiai diagnózissal diagnosztizáltuk.
Végeredményben különbséget figyeltünk meg az MSA-P és a PD betegek között a BCR-ben. Ezenkívül a BCR-tesztet nem invazív, meggyőző, objektív és gazdaságos megközelítésnek tartjuk az MSA-P és a PD betegek megkülönböztetésére. Kiegészítő vizsgálat több esettel validálja eredményeinket. További alkalmazások, beleértve a BCR-változás nyomát az MSA-P progressziójával vagy a BCR-paraméterek és a prognózis közötti összefüggést, segíthetnek abban, hogy jobban nyomon követhessük ezeket a pusztító neurológiai betegségeket.
Etikai nyilatkozat
Minden résztvevő a Helsinki Nyilatkozatnak megfelelően írásos beleegyezését adta, és beleegyezett a vizsgálatban való részvételbe. A vizsgálatot a Wenzhou Orvosi Egyetem Első Hozzátartozó Kórházának Kutatási Igazgatóságának Etikai Döntőbizottsága jóváhagyásával végezték (CR2009041).
A szerzők hozzájárulása
H-jH és X-yZ elemezték az adatokat, írták és átdolgozták a cikket. Z-yW részt vett a cikk megírásában és átdolgozta azt. XW és W-lZ végezte a klinikai vizsgálatokat és gyűjtötte az adatokat. B-cC és C-fL fogalmazták meg és tervezték meg a vizsgálatot, és szerezték be az etikai jóváhagyást.
Érdekütközésre vonatkozó nyilatkozat
A szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális érdekellentétként értelmezhetők.
Köszönet
Hálásan köszönjük Feng-ming Zhangnak a Wenzhou Orvosi Egyetem Első Klinikai Orvosi Tudományok Iskolájából a kísérlethez nyújtott segítségét és a finanszírozás megszerzését.
Finanszírozás
Ezt a munkát a WMU egyetemi innovációs projektje (No. wyx2016101006) támogatta.
2. Hughes AJ, Daniel SE, Kilford L, Lees AJ. Az idiopátiás Parkinson-kór klinikai diagnózisának pontossága: 100 eset klinikai-patológiai vizsgálata. J Neurol Neurosurg Psychiatry (1992) 55(3):181-4. doi:10.1136/jnnp.55.3.181
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Terao Y, Fukuda H, Tokushige S, Inomata-Terada S, Yugeta A, Hamada M, et al. Is multiple system atrophy with cerebellar ataxia (MSA-C) like spinocerebellar ataxia and multiple system atrophy with parkinsonism (MSA-P) like Parkinson’s disease? A patofiziológiát vizsgáló saccade tanulmány. Clin Neurophysiol (2016) 127(2):1491-502. doi:10.1016/j.clinph.2015.07.035
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Skinner SA, Vodusek DB. A bulbocavernosus reflex intraoperatív rögzítése. J Clin Neurophysiol (2014) 31(4):313-22. doi:10.1097/WNP.00000000000000000054
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Ashraf VV, Taly AB, Nair KP, Rao S, Sridhar. A klinikai neurofiziológiai vizsgálatok szerepe a gerincvelő-rendellenességben szenvedők merevedési zavarainak értékelésében. Neurol India (2005) 53(1):32-5; vita 35-6. doi:10.4103/0028-3886.15048
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Niu X, Shao B, Ni P, Wang X, Chen X, Zhu B, et al. Bulbocavernosus reflex és a pudendalis ideg szomatoszenzoros kiváltott potenciálok válaszai idegrendszeri betegségben szenvedő női betegeknél. J Clin Neurophysiol (2010) 27(3):207-11. doi:10.1097/WNP.0b013e3181dd4fca
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Konno H, Yamamoto T, Iwasaki Y, Iizuka H. Shy-Drager-szindróma és amyotrófiás laterálszklerózis. A szakrális autonóm neuronok citoarchitektonikai és morfometriai vizsgálatai. J Neurol Sci (1986) 73(2):193-204. doi:10.1016/0022-510x(86)90130-9
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Han W, Cui LY, Hua D, Li BH. Kapcsolat a multiplex rendszer atrófia autonóm diszfunkciója és a külső anális sphincter elektromiográfia között. Chin J Neurol (2006) 2:109-12. doi:10.3760/j.issn:1006-7876.2006.02.010
CrossRef Full Text | Google Scholar
19. Cnyrim CD, Kupsch A, Ebersbach G, Hoffmann KT. Diffúziós tenzor képalkotás idiopátiás Parkinson-kórban és multiszisztémás atrófiában (parkinsoni típusú). Neurodegener Dis (2014) 13(1):1-8. doi:10.1159/000348512
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Hwang I, Sohn CH, Kang KM, Jeon BS, Kim HJ, Choi SH, et al. A parkinsonizmus-predomináns multiplex rendszeratrófia megkülönböztetése az idiopátiás Parkinson-kórtól 3T szuszceptibilitás-súlyozott MR-képalkotás segítségével, a putaminális változásra és az elváltozás aszimmetriájára összpontosítva. AJNR Am J Neuroradiol (2015) 36(12):2227-34. doi:10.3174/ajnr.A4442
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Huppertz HJ, Moller L, Sudmeyer M, Hilker R, Hattingen E, Egger K, et al. Differentiation of neurodegenerative parkinsonian syndromes by volumetric magnetic resonance imaging analysis and support vector machine classification. Mov Disord (2016) 31(10):1506-17. doi:10.1002/mds.26715
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Song IU, Yoo I, Chung YA, Jeong J. Az agyi perfúziós SPECT értéke az enyhe tünetekkel járó idiopátiás Parkinson-kór és a multiplex rendszer atrófia Parkinson-változatának megkülönböztetésében. Nucl Med Commun (2015) 36(10):1049-54. doi:10.1097/MNM.0000000000000354
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Ghaemi M, Hilker R, Rudolf J, Sobesky J, Heiss WD. A multiplex rendszer atrófiájának megkülönböztetése a Parkinson-kórtól: a striatális és középagyi MRI volumetria és a multi-tracer PET képalkotás hozzájárulása. J Neurol Neurosurg Psychiatry (2002) 73(5):517-23. doi:10.1136/jnnp.73.5.517
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Baschieri F, Calandra-Buonaura G, Doria A, Mastrolilli F, Palareti A, Barletta G, et al. Új integrált műszeres megközelítéssel végzett kardiovaszkuláris autonóm vizsgálat hasznos az MSA-P és a PD korai stádiumban történő megkülönböztetésében. Parkinsonism Relat Disord (2015) 21(5):477-82. doi:10.1016/j.parkreldis.2015.02.011
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Roy S, Srivastava AK, Jaryal AK, Deepak KK. A kardiovaszkuláris válaszok a hideg presszorteszt során eltérőek a Parkinson-kórban és a parkinsonizmussal járó multiplex rendszeratrófiában. Clin Auton Res (2015) 25(4):219-24. doi:10.1007/s10286-015-0294-x
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Pilleri M, Levedianos G, Weis L, Gasparoli E, Facchini S, Biundo R, et al. Heart rate circadian profile in the differential diagnosis between Parkinson disease and multiple system atrophy. Parkinsonism Relat Disord (2014) 20(2):217-21. doi:10.1016/j.parkreldis.2013.11.006
PubMed Abstract | CrossRef Full Text | Google Scholar