Introduction
Diferenciace mezi Parkinsonovou nemocí (PD) a jinými parkinsonskými chorobami je v klinické diagnostice obtížným problémem (1). Příznaky atrofie více systémů s převažujícím parkinsonismem (MSA-P) a PD se překrývají a jsou si podobné. U deseti procent pacientů s pravděpodobnou PD je nakonec diagnostikována MSA (2). PD postihuje převážně motorický systém a někdy ovlivňuje autonomní nervový systém; MSA-P však postihuje především autonomní nervový systém. Při změně autonomního nervového systému se často objevuje zácpa, problémy s močovým měchýřem a ortostatická hypotenze (3, 4). Parkinsonismus spojený s poruchou autonomního nervového systému ztěžuje odlišení pacientů s MSA-P od pacientů s PD (5). K tomuto rozlišení se používají různé metody, z nichž se největší oblibě těší zobrazovací metody (6). Byly zkoumány i další metody založené na poruchách autonomního nervového systému (7). Navzdory těmto předchozím pokusům je stále zapotřebí objektivní vyšetření, které by zahrnovalo autonomní nervový systém a které by poskytovalo větší možnost diferenciální diagnostiky.
Bulbokavernózní reflex (BCR) způsobuje kontrakci bulbokavernózního svalu stimulací pudendálního nervu a tuto kontrakci lze zaznamenat pomocí techniky elektromyogramu. BCR testuje aferentní a eferentní signály pudendálního nervu i sakrálního provazce (8). Léze reflexního oblouku ovlivňuje latence a amplitudy BCR. V posledních 20 letech se BCR používá při diagnostice různých neurogenních onemocnění, včetně neurogenní impotence, míšního šoku a syndromu kaudy (9-11). Somatosenzorické potenciály vyvolané pudendálním nervem (PSEP) mají před vstupem do míchy stejnou dráhu jako BCR. Proto by PSEP spolu s BCR mohly být použity k lokalizaci léze v dráze. Předchozí výzkum naší skupiny naznačuje, že u pacientů s MSA existuje abnormalita BCR (12). Vzhledem k tomu, že MSA a PD mají stejné příznaky poruch autonomního nervového systému, může tato abnormalita existovat i u pacientů s PD. V této studii máme v úmyslu rozlišit pacienty s MSA-P a PD pomocí měření BCR. Konkrétně naše studie porovnávala latence a amplitudy BCR a PSEP u 38 pravděpodobných pacientů s MSA-P, 32 pacientů s PD a 30 normálních, zdravých osob. K rozlišení mezi MSA-P a PD byly provedeny statistické analýzy.
Materiál a metody
Subjekt
V této studii bylo vybráno 38 pravděpodobných pacientů s MSA-P a 32 pacientů s PD, kteří se zúčastnili elektrofyziologických vyšetření v období od prosince 2012 do října 2014. Všichni pacienti byli odesláni do První přidružené nemocnice lékařské univerzity ve Wen-čou. Všichni pacienti s MSA-P splňovali kritéria pro zařazení publikovaná v roce 2008 (13). Pravděpodobní pacienti s MSA-P byli diagnostikováni podle dvou zařazovacích kritérií: autonomní selhání zahrnující močovou inkontinenci (neschopnost kontrolovat uvolňování moči z močového měchýře, u mužů s erektilní dysfunkcí) nebo ortostatické snížení krevního tlaku a parkinsonismus špatně reagující na levodopu (bradykineze s rigiditou, tremorem nebo posturální nestabilitou). Stejně tak všichni pacienti s PD splňovali klinická diagnostická kritéria Společnosti pro poruchy hybnosti (14). Pacienti s PD byli charakterizováni tremorem v klidu, rigiditou, akinezí a posturální nestabilitou. Kromě toho byli všichni pacienti vyšetřeni v rámci magnetické rezonance (MRI) a následné návštěvy. Jako kontrolní skupinu jsme také přijali 30 zdravých osob bez anamnézy neurologického nebo psychiatrického onemocnění. Všechny zdravé kontrolní osoby podstoupily důkladné klinické a neurologické vyšetření. Osoby s parkinsonismem, ataxií, autonomní dysfunkcí nebo neurologickým onemocněním (např. epilepsií nebo cévní mozkovou příhodou) v anamnéze byly vyloučeny. Dále byli vyloučeni muži s onemocněním prostaty. Pomocí magnetické rezonance byly vyloučeny osoby s cerebrovaskulárními nebo prostorovými lézemi.
Všichni účastníci poskytli písemný informovaný souhlas v souladu s Helsinskou deklarací a souhlasili s účastí ve studii. Tato studie byla provedena na základě souhlasu Komise pro etické rozhodování Správy výzkumu při První přidružené nemocnici Lékařské univerzity ve Wen-čou (CR2009041).
Elektrofyziologie
K provádění testů BCR a PSEP byl použit systém Keypoint EMG/EP (Dantec, Bristol, Velká Británie). Zemnící elektroda byla umístěna proti stehnu pacientů v litotomické poloze. Teplota povrchu kůže byla udržována nad 32 °C.
Bulbokavernózní reflex
U mužů byly stimulační elektrody ve tvaru prstence umístěny na tělo nebo na kořen penisu. Pozitivní pól byl umístěn na corona glandis. U žen byly stimulační elektrody se svorkami umístěny v blízkosti pubické symfýzy. Kladný a záporný pól byly umístěny na klitorisu, respektive na vulvách. BCR byl zaznamenáván pomocí koncentrických jehlových elektrod zavedených do šourku v perianální oblasti poblíž střední čáry. Intenzita podnětu byla sedmkrát vyšší než smyslový práh jedince a impedance elektrod byla <5 kΩ. Stimulace čtvercovou vlnou byla 1,9 impulsu/s a zaznamenávali jsme průměrnou hodnotu 20 odrazových vln. Doba snímání byla 5 ms/díl, rozsah šířky pásma byl 10 Hz až 2 kHz a doba perzistence 100 ms. Latence byly vypočítány na základě začátku podnětu a začátku reflexní odpovědi.
Odpovědi somatosenzorických potenciálů pudendálního nervu
Elektrody použité k vyvolání potenciálů pudendálního nervu byly totožné s elektrodami použitými k vyvolání BCR a byly přiloženy na stejná místa. Intenzita podnětu však byla trojnásobkem smyslového prahu jedince. Stejně tak byla impedance elektrod udržována na hodnotě 5 kΩ. Frekvence čtvercové vlny byla 5 impulsů/s a byla zprůměrována na 200 vln. Doba snímání byla nastavena na 0,2 ms/díl a příslušná doba perzistence byla 100 ms, přičemž šířka pásma se pohybovala od 10 Hz do 5 kHz. Záznamová elektroda byla umístěna 2 cm za Cz a referenční elektroda byla umístěna na čele na Fpz. Po podání podnětu byla detekována vlna PSEP P41.
Statistická analýza
Údaje byly analyzovány pomocí programu Statistical Package for the Social Sciences 22.0 (IBM, CA, USA) a Stata SE 12 (StataCorp, LP, USA). Normální rozdělení a homogenita rozptylu byly identifikovány pomocí Kolmogorov-Smirnovova testu a Shapiro-Wilkova testu. K porovnání míry elicitace BCR mezi skupinami MSA-P, PD a kontrolními skupinami byl použit chí-kvadrát test. K analýze rozdílů v parametrech BCR mezi třemi skupinami (MSA-P, PD a kontrolní) u mužů byla použita jednosměrná analýza rozptylu (ANOVA). Parametry PSEP byly rovněž analyzovány pomocí ANOVA. Při zjištění významných rozdílů byl použit Bonferroniho test mnohonásobného porovnání. Tento test odhalil další kontrasty mezi skupinami. Pro porovnání parametrů BCR a PSEP mezi třemi skupinami (MSA-P, PD a kontrolní) u žen byl použit Kruskalův-Wallisův rank test. K dalšímu vyhodnocení rozdílů mezi jednotlivými skupinami byl použit Nemenyiho test. K vyhodnocení specificity a senzitivity parametrů BCR byla použita analýza operačních charakteristik přijímače (ROC). Hodnota p ≤ 0,05 byla považována za statisticky významnou.
Výsledky
Obecná charakteristika pacientů
Studie se zúčastnilo 38 pravděpodobných pacientů s MSA-P a 32 pacientů s PD. Věk pravděpodobných pacientů s MSA-P se pohyboval od 36 do 74 let a průměrný věk byl 54,21 ± 7,92 let. Erektilní dysfunkci mělo 39 % pacientů (15 případů), močovou inkontinenci 45 % pacientů (17 případů) a ortostatickou hypotenzi 76 % pacientů (22 případů). Věk pacientů s diagnostikovanou PD se navíc pohyboval od 35 do 77 let a průměrný věk byl 55,23 ± 8,75 let. Erektilní dysfunkci mělo 22 % pacientů (7 případů), močovou inkontinenci 3 % pacientů (1 případ) a ortostatickou hypotenzi 16 % pacientů (5 případů). Obě skupiny, MSA-P i PD, trpěly autonomním selháním (viz tabulka 1).
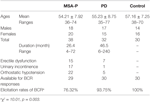
Tabulka 1. Obecné charakteristiky a míra elicitace latencí bulbokavernózního reflexu (BCR) mezi skupinami s atrofií více systémů s převažujícím parkinsonismem (MSA-P), Parkinsonovou nemocí (PD) a kontrolní skupinou.
Měření BCR

Tabulka 2. Srovnání průměrných nebo mediánových latencí bulbokavernózního reflexu mezi skupinami s atrofií mnohočetného systému s převažujícím parkinsonismem (MSA-P), Parkinsonovou chorobou (PD) a kontrolní skupinou

Obrázek 1. Srovnání průměrných nebo mediánových latencí bulbokavernózního reflexu. Latence a amplitudy bulbokavernózního reflexu (BCR) mezi skupinami s atrofií více systémů s převažujícím parkinsonismem (MSA-P), Parkinsonovou chorobou (PD) a kontrolní skupinou u mužů (A) a žen (B). Latence BCR se mezi kontrolními skupinami a skupinami pacientů s PD významně nelišily, ale pacienti s MSA měli prodloužené latence ve srovnání s ostatními skupinami u mužů (C) a žen (D). Amplitudy BCR byly u pacientů s MSA-P významně nižší než u kontrolní skupiny a amplitudy pacientů s PD spadaly mezi amplitudy kontrolní skupiny a skupiny s MSA-P.

Tabulka 3. Srovnání průměrných nebo mediánových amplitud bulbokavernózního reflexu mezi skupinami s atrofií více systémů s převažujícím parkinsonismem (MSA-P), Parkinsonovou chorobou (PD) a kontrolní skupinou.
Měření PSEP
Mezi skupinami MSA-P, PD a kontrolními skupinami nebyly žádné významné rozdíly ani u mužů, ani u žen (viz tabulka 4).

Tabulka 4. V tabulce 4 jsou uvedeny výsledky měření PSEP. Srovnání průměrných latencí a amplitud somatosenzorických potenciálů vyvolaných pudendálním nervem P41 mezi skupinami s atrofií mnohočetného systému s převažujícím parkinsonismem (MSA-P), Parkinsonovou nemocí (PD) a kontrolní skupinou.
Diskuse
V této studii jsme zjistili, že zjištěný rozdíl v parametrech BCR může pomoci rozlišit mezi MSA-P a PD. Pacienti s MSA-P vykazovali nižší míru elicitace BCR než pacienti s PD (76,3 vs 90,9 %). Parametry BCR odhalily rozdíly mezi skupinami MSA-P, PD a kontrolní skupinou. Pacienti s MSA-P vykazovali delší latence a nižší amplitudy než skupina s PD. Oba tyto parametry navíc dokázaly pomocí ROC křivky významně odlišit MSA-P.
Aferentní somatická senzorická dráha BCR zahrnuje pudendální nerv. Eferentní somatickou motorickou dráhu tvoří míšní segmenty S2-S4 včetně Onufova jádra a pudendálního nervu. Impuls stahuje bulbokavernózní sval (8, 15). Aferentní somatická senzorická dráha PSEP se skládá ze dvou segmentů a přední segment sdílí stejnou aferentní dráhu s BCR. Impuls je pak míchou přenášen do mozkové kůry. Kombinace BCR a PSEPs by mohla být použita k lokalizaci léze u některých neuropatií, jako je diabetický neurogenní močový měchýř a syndrom kaudy.
V této studii měli pacienti s MSA-P a PD abnormální BCR a normální PSEPs. Míra elicitace u pacientů s MSA-P byla nižší než u pacientů s PD. Kromě toho se nám nepodařilo vyvolat BCR u 23,68 % pacientů s MSA-P. Poškození reflexního oblouku v BCR u pacientů s MSA-P bylo závažnější než u pacientů s PD. Pacienti s MSA-P navíc vykazovali nižší amplitudy BCR než pacienti s PD. PSEP však neodhalily žádné rozdíly mezi pacienty s MSA-P, PD a kontrolními osobami. Údaje PSEP nelze v naší studii použít k rozlišení mezi pacienty s MSA-P a PD. Dráha PSEPs se zdála být kompletní jak u pacientů s MSA-P, tak u pacientů s PD. Jelikož BCR a PSEPs sdílejí stejnou aferentní dráhu, léze se pravděpodobně nacházejí na eferentní dráze, kterou tvoří míšní segmenty S2-S4, včetně Onufova jádra, nebo na pudendálním nervu. Tato zjištění podporují výsledky několika předchozích studií. Konno et al. (16) zjistili deprivační ztrátu somatických motorických neuronů v Onufově jádře. Kromě toho se v předchozích studiích ref. (17) zjistily, že elektromyografie zevního análního svěrače (EAS-EMG) má stejnou dráhu jako BCR. Jejich výsledky navíc také ukazují degeneraci buněk předního rohu Onufova jádra. Podle těchto studií je léze v BCR pravděpodobně umístěna v Onufově jádře. Je také důležité poznamenat, že ve srovnání s EAS-EMG jsou metody použité v naší studii neinvazivní.
Parkinsonova choroba se vyznačuje motorickými příznaky, jako je klidový třes, rigidita a zpomalení pohybu, které lze vysvětlit degenerací neuronů v centrálním nervovém systému. V poslední době se však stále více pozornosti věnuje nemotorickým příznakům u pacientů s PD, jako je zácpa, problémy s močovým měchýřem a ortostatická hypotenze. V této studii jsme zjistili, že amplitudy BCR byly nižší než u kontrolní skupiny, ale vyšší než u skupiny MSA-P. V této studii jsme zjistili, že amplitudy BCR byly nižší než u kontrolní skupiny. To naznačuje, že určité léze s největší pravděpodobností zahrnují BCR u pacientů s PD, ale tento stav je závažnější u pacientů s MSA-P. U pacientů s MSA-P je závažněji postižen autonomní nervový systém.
Společné nemotorické příznaky u pacientů s PD a MSA-P znesnadňují diferenciální diagnostiku pacientů s MSA-P a PD, zejména v časném stadiu. Ve snaze vyřešit tento problém bylo v posledních desetiletích použito více testů. Již dříve byly použity zobrazovací metody, jako je pozitronová emisní tomografie, difuzně vážený obraz a difuzní tenzorový obraz (18-20). Použití magnetické rezonance skutečně zvyšuje klinickou přesnost (6, 21). Navíc je 3T susceptibilitou vážené zobrazení citlivější na putaminální změny a asymetrii lézí (21). Použití mozkové volumetrie pomocí MRI je někdy neefektivní (22). U mírně symptomatických pacientů s PD a MSA-P se pomocí metody jednofotonové emisní počítačové tomografie mění perfuze mozku (23). Při této technice však mohou výsledky narušit některé ovlivňující faktory a proces analýzy dat je složitý a časově náročný. Kromě toho je třeba vzít v úvahu i náklady na radiologické vyšetření, zejména v rozvojových zemích. Jiné metody, například měření hladiny mozkomíšního moku, nejsou dostatečně přesné (24, 25). Vyšetření funkce autonomních nervů se v posledních letech dostalo do popředí zájmu výzkumu (7, 26, 27). Tato metoda se skládá z baterie kardiovaskulárních autonomních testů, včetně ortostatické hypotenze, systolického a diastolického krevního tlaku a dalších testů. Pomocí této metody Pilleri et al (28) zjistili, že pacienti s MSA vykazují zvýšenou noční srdeční frekvenci a snížený noční pokles srdeční frekvence ve srovnání s pacienty s PD. Výše uvedené metody mají svá pro i proti; žádný test nemůže mít příznivou senzitivitu i specificitu. Objektivní vyšetření poskytuje větší možnost přesné diferenciální diagnostiky.
Naše studie má určitá omezení. Například výběrový soubor naší studie byl omezen na dostupné pacienty. Kromě toho byli všichni pacienti s MSA-P a PD diagnostikováni spíše klinicky než patologicky.
V závěru jsme pozorovali rozdíl mezi pacienty s MSA-P a PD v BCR. Test BCR navíc považujeme za neinvazivní, přesvědčivý, objektivní a ekonomický přístup k rozlišení pacientů s MSA-P a PD. Doplňující studie s větším počtem případů potvrdí naše zjištění. Další aplikace včetně sledování změn BCR s progresí MSA-P nebo souvislosti mezi parametry BCR a prognózou nám může pomoci lépe monitorovat tato devastující neurologická onemocnění.
Etické prohlášení
Všichni účastníci poskytli písemný informovaný souhlas v souladu s Helsinskou deklarací a souhlasili s účastí ve studii. Tato studie byla provedena na základě schválení Výboru pro etické rozhodování Správy pro výzkum při První přidružené nemocnici Lékařské univerzity ve Wen-čou (CR2009041).
Příspěvky autorů
H-jH a X-yZ analyzovali data, napsali a revidovali článek. Z-yW se podílel na sepsání a revizi článku. XW a W-lZ prováděli klinické testy a shromažďovali údaje. B-cC a C-fL vymysleli a navrhli studii a získali etické schválení.
Prohlášení o střetu zájmů
Autoři prohlašují, že výzkum byl prováděn bez jakýchkoli komerčních nebo finančních vztahů, které by mohly být chápány jako potenciální střet zájmů.
Poděkování
Děkujeme Feng-ming Zhangovi ze School of the First Clinical Medical Sciences, Wenzhou Medical University, za pomoc při experimentu a získání finančních prostředků.
Financování
Tato práce byla financována z projektu Inovace vysokoškolského studia WMU (č. wyx2016101006).
2. Hughes AJ, Daniel SE, Kilford L, Lees AJ. Přesnost klinické diagnózy idiopatické Parkinsonovy nemoci: klinicko-patologická studie 100 případů. J Neurol Neurosurg Psychiatry (1992) 55(3):181-4. doi:10.1136/jnnp.55.3.181
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Terao Y, Fukuda H, Tokushige S, Inomata-Terada S, Yugeta A, Hamada M, et al. Je atrofie více systémů s mozečkovou ataxií (MSA-C) podobná spinocerebelární ataxii a atrofie více systémů s parkinsonismem (MSA-P) podobná Parkinsonově nemoci? Sakrální studie o patofyziologii. Clin Neurophysiol (2016) 127(2):1491-502. doi:10.1016/j.clinph.2015.07.035
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Skinner SA, Vodusek DB. Intraoperační záznam bulbokavernózního reflexu. J Clin Neurophysiol (2014) 31(4):313-22. doi:10.1097/WNP.0000000000000054
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Srov. např. Ashraf VV, Taly AB, Nair KP, Rao S, Sridhar. Úloha klinických neurofyziologických testů při hodnocení erektilní dysfunkce u osob s poruchami míchy. Neurol India (2005) 53(1):32-5; diskuse 35-6. doi:10.4103/0028-3886.15048
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Niu X, Shao B, Ni P, Wang X, Chen X, Zhu B, et al. Bulbocavernosus reflex and pudendal nerve somatosensory-evoked potentials responses in female patients with nerve system diseases. J Clin Neurophysiol (2010) 27(3):207-11. doi:10.1097/WNP.0b013e3181dd4fca
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Konno H, Yamamoto T, Iwasaki Y, Iizuka H. Shy-Dragerův syndrom a amyotrofická laterální skleróza. Cytoarchitektonické a morfometrické studie sakrálních autonomních neuronů. J Neurol Sci (1986) 73(2):193-204. doi:10.1016/0022-510x(86)90130-9
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Han W, Cui LY, Hua D, Li BH. Vztah mezi autonomní dysfunkcí při atrofii mnohočetného systému a elektromyografickým vyšetřením zevního análního svěrače. Chin J Neurol (2006) 2:109-12. doi:10.3760/j.issn:1006-7876.2006.02.010
CrossRef Full Text | Google Scholar
19. Cnyrim CD, Kupsch A, Ebersbach G, Hoffmann KT. Difuzní tenzorové zobrazování u idiopatické Parkinsonovy nemoci a multisystémové atrofie (parkinsonského typu). Neurodegener Dis (2014) 13(1):1-8. doi:10.1159/000348512
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Hwang I, Sohn CH, Kang KM, Jeon BS, Kim HJ, Choi SH, et al. Odlišení parkinsonismem podmíněné atrofie více systémů od idiopatické Parkinsonovy choroby pomocí 3T susceptibility-weighted MR zobrazení se zaměřením na putaminální změny a asymetrii lézí. AJNR Am J Neuroradiol (2015) 36(12):2227-34. doi:10.3174/ajnr.A4442
PubMed Abstract | CrossRef Full Text | Google Scholar
22. září 2015. Huppertz HJ, Moller L, Sudmeyer M, Hilker R, Hattingen E, Egger K, et al. Differentiation of neurodegenerative parkinsonian syndromes by volumetric magnetic resonance imaging analysis and support vector machine classification. Mov Disord (2016) 31(10):1506-17. doi:10.1002/mds.26715
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Song IU, Yoo I, Chung YA, Jeong J. Hodnota mozkové perfuze SPECT pro rozlišení mezi mírně symptomatickou idiopatickou Parkinsonovou nemocí a parkinsonskou variantou atrofie více systémů. Nucl Med Commun (2015) 36(10):1049-54. doi:10.1097/MNM.0000000000000354
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Vydáno v roce 2015. Ghaemi M, Hilker R, Rudolf J, Sobesky J, Heiss WD. Odlišení atrofie mnohočetného systému od Parkinsonovy nemoci: přínos volumetrie striata a středního mozku MRI a zobrazení PET s více stopami. J Neurol Neurosurg Psychiatry (2002) 73(5):517-23. doi:10.1136/jnnp.73.5.517
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Baschieri F, Calandra-Buonaura G, Doria A, Mastrolilli F, Palareti A, Barletta G, et al. Cardiovascular autonomic testing performed with a new integrated instrumental approach is useful in differentiating MSA-P from PD at an early stage. Parkinsonism Relat Disord (2015) 21(5):477-82. doi:10.1016/j.parkreldis.2015.02.011
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Roy S, Srivastava AK, Jaryal AK, Deepak KK. Kardiovaskulární reakce během chladového tlakového testu se liší u Parkinsonovy nemoci a atrofie mnohočetného systému s parkinsonismem. Clin Auton Res (2015) 25(4):219-24. doi:10.1007/s10286-015-0294-x
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Pilleri M, Levedianos G, Weis L, Gasparoli E, Facchini S, Biundo R, et al. Heart rate circadian profile in the differential diagnosis between Parkinson disease and multiple system atrophy. Parkinsonism Relat Disord (2014) 20(2):217-21. doi:10.1016/j.parkreldis.2013.11.006
PubMed Abstract | CrossRef Full Text | Google Scholar
.