- Introduktion
- Material och metoder
- Subjekt
- Elektrofysiologi
- Bulbocavernosusreflex
- Pudendalsnervens somatosensoriskt framkallade potentialresponser
- Statistisk analys
- Resultat
- Allmän patientkarakteristik
- BCR-mätningar
- PSEP-mätningar
- Diskussion
- Etiska uttalanden
- Författarbidrag
- Intressekonfliktförklaring
- Acknowledgments
- Finansiering
Introduktion
Differentieringen mellan Parkinsons sjukdom (PD) och andra parkinsonsjukdomar är en svår fråga vid klinisk diagnostik (1). Symtomen vid multipel systematrofi med dominerande parkinsonism (MSA-P) och PD är överlagrade och likartade. Tio procent av sannolika PD-patienter får så småningom diagnosen MSA (2). PD påverkar främst det motoriska systemet och påverkar ibland det autonoma nervsystemet; MSA-P påverkar dock främst det autonoma nervsystemet. När det autonoma nervsystemet förändras uppstår ofta förstoppning, blåsproblem och ortostatisk hypotoni (3, 4). Parkinsonismen parat med en störning i det autonoma nervsystemet gör det svårt att skilja mellan MSA-P- och PD-patienter (5). Olika metoder har använts för att hjälpa till att göra denna distinktion och av dessa har avbildningsmetoder varit de mest populära (6). Andra metoder baserade på störningar i det autonoma nervsystemet har också studerats (7). Trots dessa tidigare försök behövs fortfarande en objektiv undersökning som inkluderar det autonoma nervsystemet och som ger större möjlighet till differentialdiagnostik.
Bulbocavernosusreflexen (BCR) orsakar sammandragning av bulbocavernosusmuskeln genom att stimulera pudendusnerven, och denna sammandragning kan registreras med hjälp av elektromyogramteknik. BCR testar de afferenta och efferenta signalerna från pudendalsnerven samt sakralmärgen (8). En skada på reflexbågen påverkar BCR:s latenser och amplituder. Under de senaste 20 åren har BCR använts för att diagnostisera olika neurogena sjukdomar, inklusive neurogen impotens, spinal chock och cauda equine syndrom (9-11). De pudendalsnervens somatosensoriskt framkallade potentiella reaktioner (PSEP) delar samma väg med BCR innan de kommer in i ryggmärgen. Därför kan PSEP tillsammans med BCR användas för att lokalisera en skada i banan. Tidigare forskning från vår grupp tyder på att det finns en abnormitet i BCR hos MSA-patienter (12). Med tanke på att MSA och PD har samma symtom på störningar i det autonoma nervsystemet kan abnormiteten också finnas hos PD-patienter. I den här studien avser vi att skilja mellan MSA-P- och PD-patienter med hjälp av BCR-mätning. I vår studie jämförde vi särskilt latenser och amplituder för BCR och PSEP hos 38 sannolika MSA-P-patienter, 32 PD-patienter och 30 normala, friska försökspersoner. Statistiska analyser utfördes för att skilja mellan MSA-P och PD.
Material och metoder
Subjekt
I den här studien valdes 38 sannolika MSA-P-patienter och 32 PD-patienter ut för att delta i de elektrofysiologiska undersökningarna mellan december 2012 och oktober 2014. Samtliga patienter hänvisades till First Affiliated Hospital of Wenzhou Medical University. Alla MSA-P-patienter uppfyllde de inklusionskriterier som publicerades 2008 (13). Troliga MSA-P-patienter diagnostiserades med hjälp av två inklusionskriterier: Autonomt misslyckande med urininkontinens (oförmåga att kontrollera urinutsöndringen från blåsan, med erektil dysfunktion hos män) eller en ortostatisk blodtryckssänkning och svagt levodopa-responsiv parkinsonism (bradykinesi med stelhet, tremor eller postural instabilitet). Likaså uppfyllde alla PD-patienter Movement Disorder Society’s kliniska diagnostiska kriterier (14). PD-patienterna kännetecknades av tremor i vila, rigiditet, akinesi och postural instabilitet. Dessutom utvärderades alla patienter under magnetisk resonanstomografi (MRT) och ett uppföljningsbesök. Vi rekryterade också 30 friska personer utan anamnes på neurologiska eller psykiatriska sjukdomar som kontrollgrupp. Alla friska kontroller genomgick grundliga kliniska och neurologiska undersökningar. Försökspersoner med en historia av parkinsonism, ataxi, autonom dysfunktion eller neurologiska sjukdomar (t.ex. epilepsi eller stroke) uteslöts. Dessutom uteslöts manliga försökspersoner med prostatasjukdomar. MRT användes för att utesluta de försökspersoner som hade cerebrovaskulära eller rumsbelagda lesioner.
Alla deltagare gav sitt skriftliga informerade samtycke i enlighet med Helsingforsdeklarationen och gick med på att delta i studien. Studien genomfördes med godkännande av den etiska beslutskommittén för forskningsadministrationen vid Wenzhou Medical Universitys First Affiliated Hospital (CR2009041).
Elektrofysiologi
Systemet Keypoint EMG/EP (Dantec, Bristol, Storbritannien) användes för att utföra BCR- och PSEP-testerna. En jordelektrod placerades mot låret på patienterna i lithotomiläge. Temperaturen på hudytan hölls över 32 °C.
Bulbocavernosusreflex
Hos män placerades ringformade stimuleringselektroder på kroppen eller vid penisroten. Den positiva polen var placerad vid corona glandis. Hos kvinnor placerades kläm-stimulerande elektroder nära pubis symphysis. Den positiva och negativa polen sattes på klitoris respektive labia vulvae. BCR registrerades med hjälp av koncentriska nålelektroder som fördes in i pungen vid perianalregionen nära mittlinjen. Stimulansintensiteten var sju gånger individens sensoriska tröskel och elektrodimpedansen var <5 kΩ. Stimuleringen av fyrkantsvågen var 1,9 pulser/s, och vi registrerade medelvärdet av 20 reflektionsvågor. Skanningstiden var 5 ms/division, bandbreddsområdet var 10 Hz till 2 kHz och persistenstiden var 100 ms. Latencyerna beräknades baserat på stimulusets början och reflexresponsens början.
Pudendalsnervens somatosensoriskt framkallade potentialresponser
Elektroderna som användes för att framkalla pudendalsnervens potentialer var identiska med dem som användes för att framkalla BCR, och de applicerades på samma ställen. Stimulans intensitet var dock tre gånger högre än individens sensoriska tröskelvärde. På samma sätt bibehölls elektrodimpedansen på 5 kΩ. Kvadratvågens frekvens var 5 pulser/s och medelvärdet för 200 vågor. Skanningstiden var inställd på 0,2 ms/division och den relevanta persistenstiden var 100 ms, med en bandbredd som varierade från 10 Hz till 5 kHz. Inspelningselektroden var placerad 2 cm bakom Cz, och referenselektroden var placerad på pannan vid Fpz. PSEP P41-vågen upptäcktes efter stimulustillförseln.
Statistisk analys
Data analyserades med hjälp av Statistical Package for the Social Sciences 22.0 (IBM, CA, USA) och Stata SE 12 (StataCorp, LP, USA). Normalfördelning och varianshomogenitet identifierades med hjälp av Kolmogorov-Smirnov-testet och Shapiro-Wilk-testet. Ett chi-två-test användes för att jämföra BCR-utlösningsfrekvensen mellan MSA-P-, PD- och kontrollgrupperna. En envägs variansanalys (ANOVA) användes för att analysera skillnaderna i BCR-parametrarna mellan de tre grupperna (MSA-P, PD och kontroll) hos hanar. PSEP-parametrarna analyserades också med en ANOVA. Ett Bonferroni-test för multipel jämförelse tillämpades när signifikanta skillnader identifierades. Detta test avslöjade ytterligare kontraster mellan grupperna. Ett Kruskal-Wallis rangtest användes för att jämföra BCR- och PSEP-parametrarna mellan de tre grupperna (MSA-P, PD och kontroll) hos honor. Ett Nemenyi-test användes för att ytterligare utvärdera skillnaderna mellan varje grupp. En ROC-analys (receiver operating characteristic) användes för att utvärdera BCR-parametrarnas specificitet och känslighet. Ett värde på p ≤ 0,05 ansågs vara statistiskt signifikant.
Resultat
Allmän patientkarakteristik
Trettioåtta sannolika MSA-P-patienter och 32 PD-patienter deltog i studien. Åldern hos de sannolika MSA-P-patienterna varierade från 36 till 74 år och medelåldern var 54,21 ± 7,92 år. 39 % av patienterna (15 fall) hade erektil dysfunktion, 45 % av patienterna (17 fall) hade urininkontinens och 76 % av patienterna (22 fall) hade ortostatisk hypotension. Dessutom varierade åldern på de diagnostiserade PD-patienterna från 35 till 77 år, och medelåldern var 55,23 ± 8,75 år. 22 % av patienterna (7 fall) hade erektil dysfunktion, 3 % av patienterna (1 fall) hade urininkontinens och 16 % av patienterna (5 fall) hade ortostatisk hypotension. Både MSA-P- och PD-grupperna led av autonoma fel (se tabell 1).
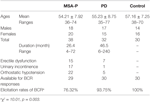
Tabell 1. Allmänna egenskaper och utlösningsfrekvens för bulbocavernosusreflexens (BCR) latens mellan multipel systematrofi med dominerande parkinsonism (MSA-P), Parkinsons sjukdom (PD) och kontrollgrupper.
BCR-mätningar

Tabell 2. Jämförelse av medel- eller medianlatenserna för bulbocavernosusreflexer mellan multipel systematrofi med dominerande parkinsonism (MSA-P), Parkinsons sjukdom (PD) och kontrollgrupper.

Figur 1

Figur 1. Bulbocavernosusreflexens (BCR) latenser och amplituder mellan multipel systematrofi med dominerande parkinsonism (MSA-P), Parkinsons sjukdom (PD) och kontrollgrupper hos män (A) och kvinnor (B). BCR-latenserna var inte signifikant annorlunda mellan kontroll- och PD-patienter, men MSA-patienterna hade längre latenstider jämfört med de andra grupperna hos män (C) och kvinnor (D). BCR-amplituderna var signifikant lägre hos MSA-P-patienter än hos kontrollgruppen, och amplituderna hos PD-patienterna låg mellan kontroll- och MSA-P-amplituderna.

Tabell 3. Jämförelse av medel- eller medianamplituder för bulbocavernosusreflexer mellan multipel systematrofi med dominerande parkinsonism (MSA-P), Parkinsons sjukdom (PD) och kontrollgrupper.
PSEP-mätningar
Ingen signifikanta skillnader fanns mellan MSA-P-, PD- och kontrollgrupperna hos varken män eller kvinnor (se tabell 4).

Tabell 4. Jämförelse av de genomsnittliga pudendalsnervens somatosensoriskt framkallade potentiella svaren P41 latenser och amplituder mellan multipel systematrofi med dominerande parkinsonism (MSA-P), Parkinsons sjukdom (PD) och kontrollgrupper.
Diskussion
I den här studien upptäckte vi att en skillnad som hittades i BCR-parametrar skulle kunna hjälpa till att skilja MSA-P och PD från varandra. MSA-P-patienter uppvisade en lägre BCR-utlösningsgrad än PD-patienter (76,3 vs 90,9 %). BCR-parametrarna visade skillnader mellan MSA-P-, PD- och kontrollgrupperna. MSA-P-patienterna uppvisade längre latenser och lägre amplituder än PD-gruppen. Dessutom kunde båda dessa parametrar signifikant särskilja MSA-P med hjälp av en ROC-kurva.
Den afferenta somatiska känselbanan i BCR inkluderar pudendalsnerven. Den efferenta somatiska motoriska banan består av ryggmärgssegmenten S2-S4, inklusive Onufs kärna och pudendalsnerven. En impuls drar ihop bulbocavernosusmuskeln (8, 15). Den afferenta somatiska sensoriska banan i PSEP består av två segment, och det främre segmentet delar samma afferenta bana med BCR. En impuls överförs sedan till hjärnbarken genom ryggmärgen. Kombinationen av BCR och PSEPs kan användas för att lokalisera en lesion vid vissa neuropatier, t.ex. diabetisk neurogen urinblåsa och cauda equine-syndrom.
I den här studien hade MSA-P- och PD-patienter en onormal BCR och normala PSEPs. Eliciteringsfrekvensen hos MSA-P-patienter var lägre än hos PD-patienter. Dessutom misslyckades vi med att framkalla BCR hos 23,68 % av MSA-P-patienterna. Skadan på reflexbågen i BCR hos MSA-P-patienterna var allvarligare än hos PD-patienterna. Dessutom uppvisade MSA-P-patienterna lägre BCR-amplituder än PD-patienterna. PSEP:erna visade dock inga skillnader mellan MSA-P-, PD- och kontrollpersonerna. PSEP-data kan inte användas för att skilja mellan MSA-P- och PD-patienter i vår studie. PSEPs väg tycktes vara fullständig hos både MSA-P- och PD-patienterna. Eftersom BCR och PSEP har samma afferenta väg, är det troligt att skadorna är belägna på den efferenta vägen, som består av ryggmärgssegmenten S2-S4, inklusive Onufs kärna, eller på pudendusnerven. Dessa resultat stöder resultaten från flera tidigare studier. Konno et al. (16) fann deprivationsförlust av somatiska motoriska neuroner i Onuf’s nucleus. Dessutom har de tidigare studierna av Ref. (17) konstaterat att elektromyografin i den yttre analsfinktern (EAS-EMG) delar samma väg med BCR. Dessutom visar deras resultat också på degeneration av Onuf’s nucleus främre horncell. Enligt dessa studier är skadan i BCR sannolikt placerad i Onufs kärna. Det är också viktigt att notera att jämfört med EAS-EMG är de metoder som används i vår studie icke-invasiva.
Parkinsons sjukdom kännetecknas av motoriska symtom, som t.ex. vilande tremor, rigiditet och långsamma rörelser, som alla kan förklaras av degeneration av neuroner i det centrala nervsystemet. De icke-motoriskt relaterade symtomen hos PD-patienter, såsom förstoppning, blåsproblem och ortostatisk hypotension har dock nyligen fått ökad uppmärksamhet. I den här studien fann vi att BCR-amplituderna var lägre än i kontrollgruppen, men högre än i MSA-P-gruppen. Detta tyder på att vissa lesioner med största sannolikhet involverar BCR hos PD-patienter, men att detta tillstånd är allvarligare hos MSA-P-patienter. Det autonoma nervsystemet är mer allvarligt påverkat hos MSA-P-patienter.
Gemensamma icke-motoriska symtom hos PD- och MSA-P-patienter gör det svårt att differentiellt diagnostisera MSA-P- och PD-patienter, särskilt i ett tidigt skede. Flera tester har använts under de senaste decennierna i ett försök att lösa detta problem. Tidigare har avbildningsmetoder som positronemissionstomografi, diffusionsviktad bild och diffusionstensorbild använts (18-20). Tillämpningen av MRT förbättrar den kliniska noggrannheten (6, 21). Dessutom är 3T susceptibilitetsviktad avbildning mer mottaglig för putaminala förändringar och asymmetri i lesionen (21). Att använda hjärnvolymmetri med MRT är ibland ineffektivt (22). Hos milt symtomatiska PD- och MSA-P-patienter förändras hjärnperfusionen med hjälp av metoden med single-photon emission computed tomography (23). Med denna teknik kan dock någon påverkande faktor störa resultaten, och processen för dataanalys är komplex och tidskrävande. Dessutom bör kostnaden för radiologisk undersökning också beaktas, särskilt i utvecklingsländer. Andra metoder, t.ex. mätning av cerebrospinalvätskenivåer, saknar precision (24, 25). Undersökning av den autonoma nervfunktionen har blivit ett forskningsfokus på senare år (7, 26, 27). Denna metod består av ett batteri av kardiovaskulära autonoma tester, inklusive ortostatisk hypotension, systoliskt och diastoliskt blodtryck och andra tester. Med hjälp av denna metod fann Pilleri et al. (28) att MSA-patienter uppvisade ökad nattlig hjärtfrekvens och minskad nattlig minskning av hjärtfrekvensen jämfört med PD-patienter. Det finns för- och nackdelar med metoderna ovan; inget enskilt test kan ha både gynnsam känslighet och specificitet. En objektiv undersökning ger större möjlighet till en korrekt differentialdiagnos.
Vår studie har vissa begränsningar. Till exempel var urvalspopulationen i vår studie begränsad till tillgängliga patienter. Dessutom fick alla patienter med MSA-P och PD en klinisk diagnos snarare än en patologisk diagnos.
Slutsatsen är att vi observerade en skillnad mellan MSA-P- och PD-patienter i BCR. Dessutom anser vi att BCR-testet är ett icke-invasivt, övertygande, objektivt och ekonomiskt tillvägagångssätt för att skilja mellan MSA-P- och PD-patienter. En kompletterande studie med fler fall kommer att validera våra resultat. Ytterligare tillämpning inklusive spår av BCR-förändring med progressionen av MSA-P eller sambandet mellan BCR-parametrar och prognos kan hjälpa oss att bättre övervaka dessa förödande neurologiska sjukdomar.
Etiska uttalanden
Alla deltagare gav sitt skriftliga informerade samtycke i enlighet med Helsingforsdeklarationen och gick med på att delta i studien. Den här studien genomfördes under godkännande av den etiska beslutskommittén för forskningsförvaltningen vid First Affiliated Hospital of Wenzhou Medical University (CR2009041).
Författarbidrag
H-jH och X-yZ analyserade data, skrev och reviderade artikeln. Z-yW deltog i skrivandet och reviderade artikeln. XW och W-lZ utförde de kliniska testerna och samlade in data. B-cC och C-fL utformade och designade studien och erhöll etiskt godkännande.
Intressekonfliktförklaring
Författarna förklarar att forskningen utfördes i avsaknad av kommersiella eller ekonomiska relationer som skulle kunna tolkas som en potentiell intressekonflikt.
Acknowledgments
Vi är tacksamma mot Feng-ming Zhang från School of the First Clinical Medical Sciences, Wenzhou Medical University, för hjälp med experimentet och anskaffande av finansiering.
Finansiering
Detta arbete finansierades av Undergraduate Innovation Project of WMU (No. wyx2016101006).
2. Hughes AJ, Daniel SE, Kilford L, Lees AJ. Noggrannhet i den kliniska diagnosen av idiopatisk Parkinsons sjukdom: en klinisk-patologisk studie av 100 fall. J Neurol Neurosurg Psychiatry (1992) 55(3):181-4. doi:10.1136/jnnp.55.3.181
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Terao Y, Fukuda H, Tokushige S, Inomata-Terada S, Yugeta A, Hamada M, et al. Är multipel systematrofi med cerebellär ataxi (MSA-C) som spinocerebellär ataxi och multipel systematrofi med parkinsonism (MSA-P) som Parkinsons sjukdom? En saccadestudie om patofysiologi. Clin Neurophysiol (2016) 127(2):1491-502. doi:10.1016/j.clinph.2015.07.035
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Skinner SA, Vodusek DB. Intraoperativ registrering av bulbocavernosusreflexen. J Clin Neurophysiol (2014) 31(4):313-22. doi:10.1097/WNP.00000000000000000054
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Ashraf VV, Taly AB, Nair KP, Rao S, Sridhar. Rollen av kliniska neurofysiologiska tester vid utvärdering av erektil dysfunktion hos personer med ryggmärgssjukdomar. Neurol India (2005) 53(1):32-5; diskussion 35-6. doi:10.4103/0028-3886.15048
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Niu X, Shao B, Ni P, Wang X, Chen X, Zhu B, et al. Bulbocavernosusreflex och pudendalsnervens somatosensoriskt framkallade potentialer hos kvinnliga patienter med sjukdomar i nervsystemet. J Clin Neurophysiol (2010) 27(3):207-11. doi:10.1097/WNP.0b013e3181dd4fca
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Konno H, Yamamoto T, Iwasaki Y, Iizuka H. Shy-Dragers syndrom och amyotrofisk lateralskleros. Cytoarkitektoniska och morfometriska studier av sakrala autonoma neuroner. J Neurol Sci (1986) 73(2):193-204. doi:10.1016/0022-510x(86)90130-9
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Han W, Cui LY, Hua D, Li BH. Samband mellan den autonoma dysfunktionen vid multipel systematrofi och yttre analsfinkterns elektromyografi. Chin J Neurol (2006) 2:109-12. doi:10.3760/j.issn:1006-7876.2006.02.010
CrossRef Full Text | Google Scholar
19. Cnyrim CD, Kupsch A, Ebersbach G, Hoffmann KT. Diffusionstensoravbildning vid idiopatisk Parkinsons sjukdom och multisystematrofi (parkinsontyp). Neurodegener Dis (2014) 13(1):1-8. doi:10.1159/000348512
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Hwang I, Sohn CH, Kang KM, Jeon BS, Kim HJ, Choi SH, et al. Differentiering av parkinsonism-predominant multipel systematrofi från idiopatisk Parkinsons sjukdom med hjälp av 3T susceptibilitetsviktad MR-avbildning, med fokus på putaminal förändring och lesionsasymmetri. AJNR Am J Neuroradiol (2015) 36(12):2227-34. doi:10.3174/ajnr.A4442
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Huppertz HJ, Moller L, Sudmeyer M, Hilker R, Hattingen E, Egger K, et al. Differentiering av neurodegenerativa parkinsonsyndrom med hjälp av analys av volymetrisk magnetresonanstomografi och klassificering med stödvektormaskiner. Mov Disord (2016) 31(10):1506-17. doi:10.1002/mds.26715
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Song IU, Yoo I, Chung YA, Jeong J. The value of brain perfusion SPECT for differentiation between mildly symptomatic idiopathic Parkinson’s disease and the Parkinson variant of multiple system atrophy. Nucl Med Commun (2015) 36(10):1049-54. doi:10.1097/MNM.0000000000000354
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Ghaemi M, Hilker R, Rudolf J, Sobesky J, Heiss WD. Differentiering av multipel systematrofi från Parkinsons sjukdom: bidrag från striatal och midbrain MRI volymetri och multi-tracer PET-avbildning. J Neurol Neurosurg Psychiatry (2002) 73(5):517-23. doi:10.1136/jnnp.73.5.517
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Baschieri F, Calandra-Buonaura G, Doria A, Mastrolilli F, Palareti A, Barletta G, et al. Kardiovaskulära autonoma tester utförda med ett nytt integrerat instrumentellt tillvägagångssätt är användbara för att skilja MSA-P från PD i ett tidigt skede. Parkinsonism Relat Disord (2015) 21(5):477-82. doi:10.1016/j.parkreldis.2015.02.011
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Roy S, Srivastava AK, Jaryal AK, Deepak KK. Kardiovaskulära reaktioner under kallt pressortest skiljer sig åt mellan Parkinsons sjukdom och multipel systematrofi med parkinsonism. Clin Auton Res (2015) 25(4):219-24. doi:10.1007/s10286-015-0294-x
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Pilleri M, Levedianos G, Weis L, Gasparoli E, Facchini S, Biundo R, et al. Heart rate circadian profile in the differential diagnosis between Parkinson disease and multiple system atrophy. Parkinsonism Relat Disord (2014) 20(2):217-21. doi:10.1016/j.parkreldis.2013.11.006
PubMed Abstract | CrossRef Full Text | Google Scholar