- Introducere
- Materiale și metode
- Subiecți
- Electrofiziologie
- Reflexul bulbocavernosus
- Răspunsurile potențiale evocate de nervul pudendal somatosenzorial
- Analiză statistică
- Rezultate
- Caracteristici generale ale pacienților
- Măsurătorile BCR
- Măsurătorile PSEP
- Discuție
- Declarație etică
- Contribuții ale autorilor
- Declarație privind conflictul de interese
- Recunoștințe
- Finanțare
Introducere
Diferențierea între boala Parkinson (PD) și alte boli parkinsoniene este o problemă dificilă în diagnosticul clinic (1). Simptomele atrofiei multisistemice cu parkinsonism predominant (MSA-P) și ale PD sunt suprapuse și similare. Zece la sută dintre pacienții cu PD probabilă sunt în cele din urmă diagnosticați cu MSA (2). PD afectează predominant sistemul motor și uneori influențează sistemul nervos autonom; cu toate acestea, MSA-P afectează în principal sistemul nervos autonom. Atunci când sistemul nervos autonom este alterat, apar adesea constipație, probleme ale vezicii urinare și hipotensiune ortostatică (3, 4). Parkinsonismul asociat cu o tulburare a sistemului nervos autonom face dificilă diferențierea între MSA-P și pacienții cu PD (5). Au fost utilizate diferite metode pentru a ajuta la realizarea acestei discriminări și, dintre acestea, metodele imagistice au fost cele mai populare (6). Au fost studiate și alte metode bazate pe tulburările sistemului nervos autonom (7). În ciuda acestor încercări anterioare, este încă necesară o examinare obiectivă care să includă sistemul nervos autonom și care să ofere o posibilitate mai mare de diagnostic diferențial.
Relaxul bulbocavernos (BCR) determină contracția mușchiului bulbocavernos prin stimularea nervului pudendal, iar această contracție poate fi înregistrată cu ajutorul tehnicii electromiogramei. BCR testează semnalele aferente și eferente ale nervului pudendal, precum și ale cordonului sacral (8). O leziune a arcului reflex influențează latențele și amplitudinile BCR. În ultimii 20 de ani, BCR a fost utilizat în diagnosticarea diferitelor boli neurogene, inclusiv impotența neurogenă, șocul spinal și sindromul cauda equine (9-11). Răspunsurile potențiale evocate de potențialul somatosenzorial al nervului pudendal (PSEP) împărtășesc aceeași cale cu BCR înainte de a intra în măduva spinării. Prin urmare, PSEP împreună cu BCR ar putea fi utilizate pentru a localiza o leziune în această cale. Cercetările anterioare ale grupului nostru sugerează că există o anomalie a BCR la pacienții cu MSA (12). Având în vedere că MSA și PD împărtășesc aceleași simptome de tulburări ale sistemului nervos autonom, este posibil ca această anomalie să existe și la pacienții cu PD. În acest studiu, intenționăm să facem distincția între pacienții cu MSA-P și cei cu PD folosind măsurarea BCR. În mod specific, studiul nostru a comparat latențele și amplitudinile BCR și PSEP la 38 de pacienți MSA-P probabili, 32 de pacienți cu PD și 30 de subiecți normali, sănătoși. Au fost efectuate analize statistice pentru a diferenția între MSA-P și PD.
Materiale și metode
Subiecți
În acest studiu, 38 de pacienți MSA-P probabili și 32 de pacienți PD au fost selectați pentru a participa la investigațiile electrofiziologice între decembrie 2012 și octombrie 2014. Toți pacienții au fost trimiși la Primul spital afiliat al Universității de Medicină din Wenzhou. Toți pacienții cu MSA-P au îndeplinit criteriile de includere publicate în 2008 (13). Pacienții MSA-P probabili au fost diagnosticați prin două criterii de includere: insuficiență autonomă care implică incontinență urinară (incapacitatea de a controla eliberarea de urină din vezica urinară, cu disfuncție erectilă la bărbați) sau o scădere ortostatică a tensiunii arteriale și parkinsonism cu răspuns slab la levodopa (bradikinezie cu rigiditate, tremor sau instabilitate posturală). De asemenea, toți pacienții cu PD au îndeplinit criteriile de diagnostic clinic ale Societății pentru tulburări de mișcare (14). Pacienții cu PD au fost caracterizați prin tremor în repaus, rigiditate, acinezie și instabilitate posturală. În plus, toți pacienții au fost evaluați prin imagistică prin rezonanță magnetică (IRM) și la o vizită de monitorizare. De asemenea, am recrutat 30 de subiecți sănătoși, fără antecedente de boli neurologice sau psihiatrice, ca grup de control. Toți martorii sănătoși au fost supuși unor examinări clinice și neurologice amănunțite. Subiecții cu antecedente de parkinsonism, ataxie, disfuncție autonomă sau boli neurologice (de exemplu, epilepsie sau accident vascular cerebral) au fost excluși. În plus, au fost excluși subiecții de sex masculin cu boli de prostată. RMN-ul a fost utilizat pentru a exclude acei subiecți cu leziuni cerebrovasculare sau care ocupă spațiu.
Toți participanții și-au dat consimțământul informat în scris în conformitate cu Declarația de la Helsinki și au fost de acord să participe la studiu. Acest studiu a fost efectuat cu aprobarea Comitetului de Decizie Etică al Administrației de Cercetare de la Primul Spital Afiliat al Universității de Medicină din Wenzhou (CR2009041).
Electrofiziologie
Sistemul Keypoint EMG/EP (Dantec, Bristol, Marea Britanie) a fost utilizat pentru a efectua testele BCR și PSEP. Un electrod de masă a fost plasat pe coapsa pacienților în poziția de litotomie. Temperatura suprafeței pielii a fost menținută peste 32°C.
Reflexul bulbocavernosus
La bărbați, electrozi de stimulare în formă de inel au fost plasați pe corp sau la rădăcina penisului. Polul pozitiv a fost localizat la nivelul corona glandis. La femei, electrozii de stimulare cu clemă au fost plasați lângă simfiza pubiană. Polul pozitiv și cel negativ au fost plasați pe clitoris și, respectiv, pe labiile vulvei. BCR a fost înregistrat cu ajutorul unor electrozi cu ac concentrici introduși în scrot la nivelul regiunii perianale, aproape de linia mediană. Intensitatea stimulului a fost de șapte ori mai mare decât pragul senzorial al individului, iar impedanța electrodului a fost <5 kΩ. Stimularea undei pătrate a fost de 1,9 impulsuri/s, iar noi am înregistrat valoarea medie a 20 de unde de reflexie. Timpul de scanare a fost de 5 ms/diviziune, intervalul de lățime de bandă a fost de 10 Hz până la 2 kHz, iar timpul de persistență a fost de 100 ms. Latențele au fost calculate pe baza începerii stimulului și a începerii răspunsului reflex.
Răspunsurile potențiale evocate de nervul pudendal somatosenzorial
Electrozii utilizați pentru a evoca potențiale ale nervului pudendal au fost identici cu cei utilizați pentru a evoca BCR și au fost aplicați în aceleași locuri. Cu toate acestea, intensitatea stimulului a fost de trei ori mai mare decât pragul senzorial al individului. În mod similar, impedanța electrodului a fost menținută la 5 kΩ. Frecvența undei pătrate a fost de 5 impulsuri/s și a fost calculată ca medie pe 200 de unde. Timpul de scanare a fost setat la 0,2 ms/diviziune, iar timpul de persistență relevant a fost de 100 ms, cu o lățime de bandă cuprinsă între 10 Hz și 5 kHz. Electrodul de înregistrare a fost amplasat la 2 cm în spatele lui Cz, iar electrodul de referință a fost plasat pe frunte la Fpz. Unda PSEP P41 a fost detectată după livrarea stimulului.
Analiză statistică
Datele au fost analizate folosind Statistical Package for the Social Sciences 22.0 (IBM, CA, SUA) și Stata SE 12 (StataCorp, LP, SUA). Distribuția normală și omogenitatea varianței au fost identificate cu ajutorul testului Kolmogorov-Smirnov și al testului Shapiro-Wilk. A fost utilizat un test chi-pătrat pentru a compara ratele de elicitare a BCR-urilor între grupurile MSA-P, PD și de control. O analiză a varianței (ANOVA) cu o singură direcție a fost utilizată pentru a analiza diferențele dintre parametrii BCR între cele trei grupuri (MSA-P, PD și control) la masculi. Parametrii PSEP au fost, de asemenea, analizați cu o ANOVA. S-a aplicat un test de comparație multiplă Bonferroni atunci când au fost identificate diferențe semnificative. Acest test a evidențiat contraste suplimentare între grupuri. Un test de rang Kruskal-Wallis a fost utilizat pentru a compara parametrii BCR și PSEP între cele trei (MSA-P, PD și control) la femele. S-a aplicat un test Nemenyi pentru a evalua în continuare diferențele dintre fiecare grup. O analiză a caracteristicilor de funcționare a receptorului (ROC) a fost utilizată pentru a evalua specificitatea și sensibilitatea parametrilor BCR. O valoare de p ≤ 0,05 a fost considerată semnificativă din punct de vedere statistic.
Rezultate
Caracteristici generale ale pacienților
Treizeci și opt de pacienți cu MSA-P probabile și 32 de pacienți cu PD au participat la studiu. Vârsta pacienților cu MSA-P probabilă a variat între 36 și 74 de ani, iar vârsta medie a fost de 54,21 ± 7,92 ani. 39% dintre pacienți (15 cazuri) au avut disfuncție erectilă, 45% dintre pacienți (17 cazuri) au avut incontinență urinară și 76% dintre pacienți (22 de cazuri) au avut hipotensiune ortostatică. În plus, vârsta pacienților diagnosticați cu PD a variat între 35 și 77 de ani, iar vârsta medie a fost de 55,23 ± 8,75 ani. 22% dintre pacienți (7 cazuri) aveau disfuncție erectilă, 3% dintre pacienți (1 caz) aveau incontinență urinară, iar 16% dintre pacienți (5 cazuri) aveau hipotensiune ortostatică. Atât grupul MSA-P, cât și grupul PD au suferit de insuficiență autonomă (a se vedea tabelul 1).
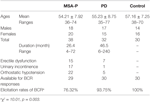
Tabel 1. Caracteristicile generale și ratele de elicitare a latențelor reflexului bulbocavernosus (BCR) între atrofia multiplă a sistemului cu parkinsonism predominant (MSA-P), boala Parkinson (PD) și grupurile de control.
Măsurătorile BCR

Tabelul 2. Compararea latențelor medii sau mediane ale latențelor reflexului bulbocavernosus între atrofia multiplă a sistemului cu parkinsonism predominant (MSA-P), boala Parkinson (PD) și grupurile de control.

Figura 1. Latențele și amplitudinile reflexului bulbocavernosus (BCR) între atrofia multiplă a sistemului cu parkinsonism predominant (MSA-P), boala Parkinson (PD) și grupurile de control la bărbați (A) și femei (B). Latențele BCR nu au fost semnificativ diferite între pacienții de control și cei cu PD, dar pacienții cu MSA au avut latențe prelungite în comparație cu celelalte grupuri la bărbați (C) și femei (D). Amplitudinile BCR au fost semnificativ mai mici la pacienții cu MSA-P decât la cei din grupul de control, iar amplitudinile pacienților cu PD s-au situat între cele ale pacienților de control și cele ale pacienților cu MSA-P.

Tabela 3. Comparația amplitudinilor medii sau mediane ale reflexului bulbocavernosus între atrofia multiplă a sistemului cu parkinsonism predominant (MSA-P), boala Parkinson (PD) și grupurile de control.
Măsurătorile PSEP
Nu au existat diferențe semnificative între MSA-P, PD și grupurile de control, nici la bărbați, nici la femei (vezi tabelul 4).

Tabelul 4. Comparația mediei răspunsurilor potențiale evocate somatosenzorial ale nervului pudendal P41 latențe și amplitudini între atrofia multiplă a sistemului cu parkinsonism predominant (MSA-P), boala Parkinson (PD) și grupurile de control.
Discuție
În acest studiu, am descoperit că o diferență găsită în parametrii BCR ar putea ajuta la distingerea între MSA-P și PD. Pacienții cu MSA-P au prezentat o rată de elicitare a BCR mai mică decât pacienții cu PD (76,3 vs 90,9%). Parametrii BCR au evidențiat diferențe între MSA-P, PD și grupurile de control. Pacienții MSA-P au prezentat latențe mai lungi și amplitudini mai mici decât cei din grupul PD. În plus, ambii parametri au putut distinge semnificativ MSA-P folosind o curbă ROC.
Calea senzorială somatică aferentă a BCR include nervul pudendal. Calea motorie somatică eferentă este compusă din segmentele spinale S2-S4, inclusiv nucleul lui Onuf și nervul pudendal. Un impuls contractă mușchiul bulbocavernosus (8, 15). Calea senzorială somatică aferentă a PSEP cuprinde două segmente, iar segmentul anterior împarte aceeași cale aferentă cu BCR. Un impuls este apoi transmis către cortexul cerebral prin măduva spinării. Combinația dintre BCR și PSEP ar putea fi utilizată pentru a localiza o leziune în unele neuropatii, cum ar fi vezica neurogenă diabetică și sindromul cauda equine.
În acest studiu, pacienții cu MSA-P și PD au avut o BCR anormală și PSEP normale. Ratele de elicitare ale pacienților cu MSA-P au fost mai mici decât cele ale pacienților cu PD. În plus, nu am reușit să elicităm BCR la 23,68% dintre pacienții cu MSA-P. Leziunea arcului reflex în BCR a pacienților cu MSA-P a fost mai gravă decât la pacienții cu PD. În plus, pacienții MSA-P au prezentat amplitudini BCR mai mici decât pacienții PD. Cu toate acestea, PSEP nu au evidențiat diferențe între subiecții MSA-P, PD și subiecții de control. Datele PSEP nu pot fi utilizate pentru a distinge între pacienții MSA-P și PD în studiul nostru. Calea PSEP părea să fie completă atât la pacienții MSA-P, cât și la cei cu PD. Deoarece BCR și PSEP împărtășesc aceeași cale aferentă, este probabil ca leziunile să fie localizate pe calea eferentă, care constă din segmentele spinale S2-S4, inclusiv nucleul lui Onuf, sau pe nervul pudendal. Aceste constatări susțin rezultatele mai multor studii anterioare. Konno și colab. (16) au constatat pierderea prin deprivare a neuronilor motori somatici în nucleul lui Onuf. Mai mult, studiile anterioare ale lui Ref. (17) au constatat că electromiografia sfincterului anal extern (EAS-EMG) împărtășește aceeași cale cu BCR. În plus, rezultatele lor arată, de asemenea, degenerarea celulei cornului anterior al nucleului lui Onuf. Conform acestor studii, leziunea din BCR este probabil poziționată în nucleul lui Onuf. De asemenea, este important de remarcat faptul că, în comparație cu EAS-EMG, metodele utilizate în studiul nostru sunt neinvazive.
Boala Parkinson se caracterizează prin simptome motorii, cum ar fi tremorul de repaus, rigiditatea și lentoarea mișcărilor, care pot fi toate explicate prin degenerarea neuronilor din sistemul nervos central. Cu toate acestea, simptomele nemotorii la pacienții cu PD, cum ar fi constipația, problemele vezicii urinare și hipotensiunea ortostatică, au primit recent o atenție tot mai mare. În acest studiu, am constatat că amplitudinile BCR au fost mai mici decât cele din grupul de control, dar mai mari decât cele din grupul MSA-P. Acest lucru sugerează că anumite leziuni implică cel mai probabil BCR la pacienții cu PD, dar această afecțiune este mai gravă la pacienții cu MSA-P. Sistemul nervos autonom este mai grav afectat la pacienții cu MSA-P.
Simptomele non-motorii comune la pacienții cu PD și MSA-P fac dificilă diagnosticarea diferențiată a pacienților cu MSA-P și PD, în special într-un stadiu incipient. În ultimele câteva decenii au fost utilizate mai multe teste în încercarea de a rezolva această problemă. Metodele imagistice, cum ar fi tomografia cu emisie de pozitroni, imaginea ponderată de difuzie și imaginea tensorului de difuzie, au fost utilizate anterior (18-20). Aplicarea IRM îmbunătățește într-adevăr acuratețea clinică (6, 21). Mai mult, imagistica ponderată cu susceptibilitate 3T este mai sensibilă la modificările putaminale și la asimetria leziunilor (21). Utilizarea volumetriei cerebrale cu RMN este uneori ineficientă (22). La pacienții cu PD și MSA-P ușor simptomatici, perfuzia cerebrală este alterată prin metoda tomografiei computerizate cu emisie monofotonică (23). Cu toate acestea, cu această tehnică, un anumit factor de influență ar putea perturba rezultatele, iar procesul de analiză a datelor este complex și consumator de timp. În plus, trebuie luat în considerare și costul examinării radiologice, în special în țările în curs de dezvoltare. Alte metode, cum ar fi măsurarea nivelului de lichid cefalorahidian, nu sunt precise (24, 25). Examinarea funcției nervilor autonomi a devenit un obiectiv de cercetare în ultimii ani (7, 26, 27). Această metodă constă într-o baterie de teste autonome cardiovasculare, inclusiv hipotensiunea ortostatică, tensiunea arterială sistolică și diastolică și alte teste. Folosind această metodă, Pilleri și colab. (28) au constatat că pacienții cu MSA au prezentat o frecvență cardiacă nocturnă crescută și o scădere nocturnă redusă a frecvenței cardiace în comparație cu pacienții cu PD. Există argumente pro și contra în metodele de mai sus; niciun test unic nu poate avea atât sensibilitate, cât și specificitate favorabile. O examinare obiectivă redă o posibilitate mai mare pentru un diagnostic diferențial precis.
Studiul nostru are unele limitări. De exemplu, eșantionul de populație al studiului nostru a fost restrâns la pacienții disponibili. În plus, toți pacienții cu MSA-P și PD au fost diagnosticați clinic mai degrabă decât patologic.
În concluzie, am observat o diferență între pacienții cu MSA-P și PD în BCR. Mai mult, considerăm că testul BCR este o abordare neinvazivă, convingătoare, obiectivă și economică pentru a discrimina între pacienții cu MSA-P și PD. Un studiu suplimentar cu mai multe cazuri va valida constatările noastre. Aplicațiile ulterioare, inclusiv urmărirea modificării BCR cu progresia MSA-P sau asocierea dintre parametrii BCR și prognostic, ne pot ajuta să monitorizăm mai bine aceste boli neurologice devastatoare.
Declarație etică
Toți participanții și-au dat consimțământul informat în scris în conformitate cu Declarația de la Helsinki și au fost de acord să participe la studiu. Acest studiu a fost realizat cu aprobarea Comitetului de Decizie Etică al Administrației de Cercetare de la Primul Spital Afiliat al Universității de Medicină din Wenzhou (CR2009041).
Contribuții ale autorilor
H-jH și X-yZ au analizat datele, au scris și revizuit articolul. Z-yW au participat la scrierea și au revizuit articolul. XW și W-lZ au efectuat testele clinice și au colectat datele. B-cC și C-fL au conceput și proiectat studiul și au obținut aprobarea etică.
Declarație privind conflictul de interese
Autorii declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
Recunoștințe
Recunoaștem cu recunoștință pe Feng-ming Zhang de la Școala de Primele Științe Medicale Clinice, Universitatea de Medicină din Wenzhou, pentru asistență în realizarea experimentului și obținerea de fonduri.
Finanțare
Această lucrare a fost finanțată de Undergraduate Innovation Project of WMU (nr. wyx2016101006).
2. Hughes AJ, Daniel SE, Kilford L, Lees AJ. Precizia diagnosticului clinic al bolii Parkinson idiopatice: un studiu clinico-patologic al 100 de cazuri. J Neurol Neurosurg Psychiatry (1992) 55(3):181-4. doi:10.1136/jnnp.55.3.181
PubMed Abstract | Publicitate integrală | Google Scholar
5. Terao Y, Fukuda H, Tokushige S, Inomata-Terada S, Yugeta A, Hamada M, et al. Este atrofia multiplă de sistem cu ataxie cerebeloasă (MSA-C) ca ataxia spinocerebeloasă și atrofia multiplă de sistem cu parkinsonism (MSA-P) ca boala Parkinson? Un studiu sacadat asupra fiziopatologiei. Clin Neurophysiol (2016) 127(2):1491-502. doi:10.1016/j.clinph.2015.07.035
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Skinner SA, Vodusek DB. Înregistrarea intraoperatorie a reflexului bulbocavernosus. J Clin Neurophysiol (2014) 31(4):313-22. doi:10.1097/WNP.0000000000000054
PubMed Abstract | Reflectul integral | Google Scholar
9. Ashraf VV, Taly AB, Nair KP, Rao S, Sridhar. Rolul testelor neurofiziologice clinice în evaluarea disfuncției erectile la persoanele cu afecțiuni ale măduvei spinării. Neurol India (2005) 53(1):32-5; discuție 35-6. doi:10.4103/0028-3886.15048
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Niu X, Shao B, Ni P, Wang X, Chen X, Zhu B, et al. Răspunsurile reflexului bulbocavernosus și ale potențialelor somatosenzoriale evocate de nervul pudendal la pacienții de sex feminin cu boli ale sistemului nervos. J Clin Neurophysiol (2010) 27(3):207-11. doi:10.1097/WNP.0b013e3181dd4fca
PubMed Abstract | PublicMed Full Text | Google Scholar
16. Konno H, Yamamoto T, Iwasaki Y, Iizuka H. Sindromul Shy-Drager și scleroza laterală amiotrofică. Studii citoarhitectonice și morfometrice ale neuronilor autonomi sacrali. J Neurol Sci (1986) 73(2):193-204. doi:10.1016/0022-510x(86)90130-9
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Han W, Cui LY, Hua D, Li BH. Relația dintre disfuncția autonomă a atrofiei multiple a sistemului și electromiografia sfincterului anal extern. Chin J Neurol (2006) 2:109-12. doi:10.3760/j.issn:1006-7876.2006.02.010
CrossRef Full Text | Google Scholar
19. Cnyrim CD, Kupsch A, Ebersbach G, Hoffmann KT. Imagistica tensorului de difuzie în boala Parkinson idiopatică și atrofia multisistemică (tip parkinsonian). Neurodegener Dis (2014) 13(1):1-8. doi:10.1159/000348512
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Hwang I, Sohn CH, Sohn CH, Kang KM, Jeon BS, Kim HJ, Choi SH, et al. Diferențierea atrofiei multiple a sistemului parkinsonian cu predominare parkinsonistă de boala Parkinson idiopatică folosind imagistica prin rezonanță magnetică ponderată cu susceptibilitate 3T, concentrându-se pe schimbarea putaminală și asimetria leziunii. AJNR Am J Neuroradiol (2015) 36(12):2227-34. doi:10.3174/ajnr.A4442
PubMed Abstract | Publicitate integrală | Google Scholar
22. Huppertz HJ, Moller L, Sudmeyer M, Hilker R, Hattingen E, Egger K, et al. Differentiation of neurodegenerative parkinsonian syndromes by volumetric magnetic resonance imaging analysis and support vector machine classification. Mov Disord (2016) 31(10):1506-17. doi:10.1002/mds.26715
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Song IU, Yoo I, Yoo I, Chung YA, Jeong J. Valoarea SPECT de perfuzie cerebrală pentru diferențierea între boala Parkinson idiopatică idiopatică ușor simptomatică și varianta Parkinson a atrofiei multiple a sistemului. Nucl Med Commun (2015) 36(10):1049-54. doi:10.1097/MNM.0000000000000354
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Ghaemi M, Hilker R, Rudolf J, Sobesky J, Heiss WD. Diferențierea atrofiei multiple a sistemului de la boala Parkinson: contribuția volumetriei RMN striatale și a creierului mijlociu și a imagisticii PET multi-tracer. J Neurol Neurosurg Psychiatry (2002) 73(5):517-23. doi:10.1136/jnnp.73.5.5.517
PubMed Abstract | Publicitate integrală | Google Scholar
26. Baschieri F, Calandra-Buonaura G, Doria A, Mastrolilli F, Palareti A, Barletta G, et al. Testarea autonomiei cardiovasculare realizată cu o nouă abordare instrumentală integrată este utilă în diferențierea MSA-P de PD într-un stadiu incipient. Parkinsonism Relat Disord (2015) 21(5):477-82. doi:10.1016/j.parkreldis.2015.02.011
PubMed Abstract | Publicitate integrală | Google Scholar
27. Roy S, Srivastava AK, Jaryal AK, Deepak KK. Răspunsurile cardiovasculare în timpul testului de presare la rece sunt diferite în boala Parkinson și în atrofia multiplă a sistemului cu parkinsonism. Clin Auton Res (2015) 25(4):219-24. doi:10.1007/s10286-015-0294-x
PubMed Abstract | Refef Full Text | Google Scholar
28. Pilleri M, Levedianos G, Weis L, Gasparoli E, Facchini S, Biundo R, et al. Profilul circadian al ritmului cardiac în diagnosticul diferențial între boala Parkinson și atrofia multiplă a sistemului. Parkinsonism Relat Disord (2014) 20(2):217-21. doi:10.1016/j.parkreldis.2013.11.006
PubMed Abstract | CrossRef Full Text | Google Scholar
.