- Introduzione
- Materiali e metodi
- Soggetto
- Elettrofisiologia
- Riflesso del bulboocavernoso
- Risposte potenziali evocate dal somatosensore del nervo pudendo
- Analisi statistica
- Risultati
- Caratteristiche generali dei pazienti
- Misurazioni BCR
- Misurazioni PSEP
- Discussione
- Dichiarazione etica
- Contributi degli autori
- Dichiarazione di conflitto di interessi
- Riconoscimenti
- Finanziamento
Introduzione
La differenziazione tra la malattia di Parkinson (PD) e altre malattie parkinsoniane è un problema difficile nella diagnosi clinica (1). I sintomi dell’atrofia del sistema multiplo con parkinsonismo predominante (MSA-P) e della PD sono sovrapposti e simili. Il dieci per cento dei probabili pazienti con PD sono alla fine diagnosticati con MSA (2). La PD colpisce prevalentemente il sistema motorio e a volte influenza il sistema nervoso autonomo; tuttavia, la MSA-P colpisce principalmente il sistema nervoso autonomo. Quando il sistema nervoso autonomo è alterato, spesso si verificano costipazione, problemi alla vescica e ipotensione ortostatica (3, 4). Il parkinsonismo abbinato a un disturbo del sistema nervoso autonomo rende difficile differenziare i pazienti con MSA-P da quelli con PD (5). Sono stati utilizzati diversi metodi per aiutare a fare questa discriminazione e, tra questi, i metodi di imaging sono stati i più popolari (6). Sono stati studiati anche altri metodi basati sui disturbi del sistema nervoso autonomo (7). Nonostante questi tentativi precedenti, è ancora necessario un esame obiettivo che includa il sistema nervoso autonomo e che renda una maggiore possibilità di diagnosi differenziale.
Il riflesso bulbocavernoso (BCR) causa la contrazione del muscolo bulbocavernoso stimolando il nervo pudendo, e questa contrazione può essere registrata utilizzando la tecnica dell’elettromiogramma. Il BCR verifica i segnali afferenti ed efferenti del nervo pudendo e del midollo sacrale (8). Una lesione dell’arco riflesso influenza le latenze e le ampiezze del BCR. Negli ultimi 20 anni, il BCR è stato utilizzato nella diagnosi di varie malattie neurogeniche, tra cui l’impotenza neurogenica, lo shock spinale e la sindrome della cauda equina (9-11). Le risposte potenziali somatosensoriali del nervo pudendo (PSEP) condividono lo stesso percorso con il BCR prima di entrare nel midollo spinale. Pertanto, PSEP insieme al BCR potrebbe essere usato per localizzare una lesione nel percorso. Una ricerca precedente del nostro gruppo suggerisce che un’anomalia del BCR esiste nei pazienti MSA (12). Dato che MSA e PD condividono gli stessi sintomi di disturbi del sistema nervoso autonomo, l’anomalia potrebbe esistere anche nei pazienti PD. In questo studio, abbiamo intenzione di distinguere tra i pazienti MSA-P e PD utilizzando la misura BCR. In particolare, il nostro studio ha confrontato le latenze e le ampiezze del BCR e del PSEP in 38 probabili pazienti MSA-P, 32 pazienti PD e 30 soggetti normali e sani. Sono state eseguite analisi statistiche per differenziare tra MSA-P e PD.
Materiali e metodi
Soggetto
In questo studio, 38 probabili pazienti MSA-P e 32 pazienti PD sono stati selezionati per partecipare alle indagini elettrofisiologiche tra dicembre 2012 e ottobre 2014. Tutti i pazienti sono stati inviati al First Affiliated Hospital of Wenzhou Medical University. Tutti i pazienti con MSA-P hanno soddisfatto i criteri di inclusione pubblicati nel 2008 (13). I probabili pazienti con MSA-P sono stati diagnosticati in base a due criteri di inclusione: insufficienza autonomica con incontinenza urinaria (incapacità di controllare il rilascio di urina dalla vescica, con disfunzione erettile nei maschi) o diminuzione ortostatica della pressione sanguigna e parkinsonismo scarsamente levodopa-responsivo (bradicinesia con rigidità, tremore o instabilità posturale). Allo stesso modo, tutti i pazienti PD soddisfacevano i criteri diagnostici clinici della Movement Disorder Society (14). I pazienti con PD erano caratterizzati da tremore a riposo, rigidità, acinesia e instabilità posturale. Inoltre, tutti i pazienti sono stati valutati sotto risonanza magnetica (MRI) e una visita di follow-up. Abbiamo anche reclutato 30 soggetti sani senza storia di malattie neurologiche o psichiatriche come gruppo di controllo. Tutti i controlli sani sono stati sottoposti ad accurati esami clinici e neurologici. I soggetti con una storia di parkinsonismo, atassia, disfunzione autonoma o malattie neurologiche (ad esempio, epilessia o ictus) sono stati esclusi. Inoltre, sono stati esclusi i soggetti maschi con malattie prostatiche. La risonanza magnetica è stata utilizzata per escludere i soggetti con lesioni cerebrovascolari o occupanti spazio.
Tutti i partecipanti hanno dato il loro consenso informato scritto in conformità con la Dichiarazione di Helsinki e hanno accettato di partecipare allo studio. Questo studio è stato condotto sotto l’approvazione del Comitato per le decisioni etiche dell’amministrazione della ricerca presso il Primo Ospedale Affiliato dell’Università Medica di Wenzhou (CR2009041).
Elettrofisiologia
Il sistema Keypoint EMG/EP (Dantec, Bristol, UK) è stato utilizzato per condurre i test BCR e PSEP. Un elettrodo di terra è stato posizionato contro la coscia dei pazienti in posizione litotomica. La temperatura della superficie cutanea è stata mantenuta sopra i 32°C.
Riflesso del bulboocavernoso
Nei maschi, gli elettrodi stimolanti a forma di anello sono stati posti sul corpo o alla radice del pene. Il polo positivo era situato in corrispondenza della corona ghiandolare. Nelle femmine, gli elettrodi stimolanti a pinza sono stati posizionati vicino alla sinfisi pubica. I poli positivo e negativo sono stati messi rispettivamente sul clitoride e sulle labbra vulvari. Il BCR è stato registrato da elettrodi ad ago concentrici inseriti nello scroto nella regione perianale vicino alla linea mediana. L’intensità dello stimolo era sette volte la soglia sensoriale dell’individuo e l’impedenza dell’elettrodo era <5 kΩ. La stimolazione dell’onda quadra era di 1,9 impulsi/s, e abbiamo registrato il valore medio di 20 onde di riflessione. Il tempo di scansione era 5 ms/divisione, la gamma di larghezza di banda era 10 Hz a 2 kHz, e il tempo di persistenza era 100 ms. Le latenze sono state calcolate in base all’inizio dello stimolo e l’inizio della risposta riflessa.
Risposte potenziali evocate dal somatosensore del nervo pudendo
Gli elettrodi utilizzati per evocare i potenziali del nervo pudendo erano identici a quelli utilizzati per evocare il BCR, e sono stati applicati agli stessi luoghi. Tuttavia, l’intensità dello stimolo era tre volte la soglia sensoriale dell’individuo. Allo stesso modo, l’impedenza degli elettrodi è stata mantenuta a 5 kΩ. La frequenza dell’onda quadra era di 5 impulsi/s e la media era di 200 onde. Il tempo di scansione era impostato su 0,2 ms/divisione, e il tempo di persistenza rilevante era di 100 ms, con una larghezza di banda che andava da 10 Hz a 5 kHz. L’elettrodo di registrazione era situato 2 cm dietro Cz, e l’elettrodo di riferimento era posto sulla fronte a Fpz. L’onda PSEP P41 è stata rilevata dopo la consegna dello stimolo.
Analisi statistica
I dati sono stati analizzati utilizzando il pacchetto statistico per le scienze sociali 22.0 (IBM, CA, USA) e Stata SE 12 (StataCorp, LP, USA). La distribuzione normale e l’omogeneità della varianza sono state identificate usando il test di Kolmogorov-Smirnov e il test di Shapiro-Wilk. Un test chi-quadrato è stato utilizzato per confrontare i tassi di elicitazione di BCRs tra il MSA-P, PD, e gruppi di controllo. Un’analisi della varianza a una via (ANOVA) è stata utilizzata per analizzare le differenze nei parametri BCR tra i tre gruppi (MSA-P, PD e controllo) nei maschi. Anche i parametri PSEP sono stati analizzati con un’ANOVA. Un test di confronto multiplo di Bonferroni è stato applicato quando sono state identificate differenze significative. Questo test ha rivelato ulteriori contrasti tra i gruppi. Un test di rango Kruskal-Wallis è stato utilizzato per confrontare i parametri BCR e PSEP tra i tre (MSA-P, PD e controllo) nelle femmine. Un test Nemenyi è stato applicato per valutare ulteriormente le differenze tra ogni gruppo. Un’analisi delle caratteristiche operative del ricevitore (ROC) è stata utilizzata per valutare la specificità e la sensibilità dei parametri BCR. Un valore di p ≤ 0,05 è stato considerato statisticamente significativo.
Risultati
Caratteristiche generali dei pazienti
Trentotto probabili pazienti MSA-P e 32 pazienti PD hanno partecipato allo studio. L’età dei pazienti con probabile MSA-P variava da 36 a 74 anni, e l’età media era di 54,21 ± 7,92 anni. Il 39% dei pazienti (15 casi) aveva disfunzioni erettili, il 45% dei pazienti (17 casi) aveva incontinenza urinaria e il 76% dei pazienti (22 casi) aveva ipotensione ortostatica. Inoltre, l’età dei pazienti con diagnosi di PD variava da 35 a 77 anni, e l’età media era di 55,23 ± 8,75 anni. Il 22% dei pazienti (7 casi) aveva disfunzioni erettili, il 3% dei pazienti (1 caso) aveva incontinenza urinaria, e il 16% dei pazienti (5 casi) aveva ipotensione ortostatica. Entrambi i gruppi MSA-P e PD soffrivano di insufficienza autonomica (vedi tabella 1).
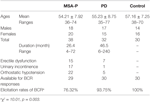
Tabella 1. Caratteristiche generali e tassi di elicitazione delle latenze del riflesso bulbocavernoso (BCR) tra atrofia del sistema multiplo con parkinsonismo predominante (MSA-P), malattia di Parkinson (PD), e gruppi di controllo.
Misurazioni BCR

Tabella 2. Confronto delle latenze medie o mediane del riflesso bulbocavernoso tra atrofia del sistema multiplo con parkinsonismo predominante (MSA-P), malattia di Parkinson (PD), e gruppi di controllo.

Figura 1. Bulbocavernosus reflex (BCR) latenze e ampiezze tra atrofia del sistema multiplo con parkinsonismo predominante (MSA-P), malattia di Parkinson (PD), e gruppi di controllo nei maschi (A) e femmine (B). Le latenze BCR non erano significativamente diverse tra il controllo e i pazienti PD, ma i pazienti MSA avevano latenze prolungate rispetto agli altri gruppi nei maschi (C) e nelle femmine (D). Le ampiezze BCR erano significativamente più basse nei pazienti MSA-P rispetto a quelle del gruppo di controllo, e le ampiezze dei pazienti PD cadevano tra il controllo e le ampiezze MSA-P.

Tabella 3. Confronto delle ampiezze medie o mediane del riflesso bulbocavernoso tra atrofia del sistema multiplo con parkinsonismo predominante (MSA-P), malattia di Parkinson (PD) e gruppi di controllo.
Misurazioni PSEP
Non esistevano differenze significative tra i gruppi MSA-P, PD e controllo né nei maschi né nelle femmine (vedi Tabella 4).

Tabella 4. Confronto della media delle risposte di potenziale somatosensoriale evocate dal nervo pudendo P41 latenze e ampiezze tra atrofia del sistema multiplo con parkinsonismo predominante (MSA-P), malattia di Parkinson (PD), e gruppi di controllo.
Discussione
In questo studio, abbiamo scoperto che una differenza trovata nei parametri BCR potrebbe aiutare a distinguere tra MSA-P e PD. I pazienti MSA-P hanno mostrato un tasso di elicitazione BCR più basso rispetto ai pazienti PD (76,3 vs 90,9%). I parametri BCR hanno rivelato differenze tra i gruppi MSA-P, PD e controllo. I pazienti con MSA-P hanno mostrato latenze più lunghe e ampiezze inferiori rispetto al gruppo PD. Inoltre, entrambi questi parametri potevano distinguere significativamente la MSA-P usando una curva ROC.
La via sensoriale somatica afferente del BCR include il nervo pudendo. La via motoria somatica efferente è composta dai segmenti spinali S2-S4, compreso il nucleo di Onuf e il nervo pudendo. Un impulso contrae il muscolo bulbocavernoso (8, 15). La via sensoriale somatica afferente delle PSEP comprende due segmenti, e il segmento anteriore condivide la stessa via afferente con il BCR. Un impulso viene poi trasmesso alla corteccia cerebrale attraverso il midollo spinale. La combinazione del BCR e dei PSEP potrebbe essere usata per localizzare una lesione in alcune neuropatie, come la vescica neurogena diabetica e la sindrome della cauda equina.
In questo studio, i pazienti MSA-P e PD avevano un BCR anormale e PSEP normali. I tassi di elicitazione dei pazienti con MSA-P erano inferiori a quelli dei pazienti con PD. Inoltre, non siamo riusciti a elicitare il BCR nel 23,68% dei pazienti MSA-P. La lesione dell’arco riflesso nel BCR dei pazienti con MSA-P era più grave che nei pazienti con PD. Inoltre, i pazienti MSA-P hanno esibito ampiezze BCR più basse rispetto ai pazienti PD. Tuttavia, i PSEP non hanno rivelato differenze tra i soggetti con MSA-P, PD e controllo. I dati PSEP non possono essere utilizzati per distinguere tra i pazienti MSA-P e PD nel nostro studio. Il percorso dei PSEPs sembrava essere completo sia nei pazienti con MSA-P che in quelli con PD. Poiché i BCR e i PSEP condividono la stessa via afferente, è probabile che le lesioni siano localizzate sulla via efferente, che consiste nei segmenti spinali S2-S4, compreso il nucleo di Onuf, o sul nervo pudendo. Questi risultati supportano i risultati di diversi studi precedenti. Konno et al. (16) hanno trovato la perdita di deprivazione dei motoneuroni somatici nel nucleo di Onuf. Inoltre, gli studi precedenti di Ref. (17) hanno trovato che l’elettromiografia dello sfintere anale esterno (EAS-EMG) condivide lo stesso percorso con BCR. Inoltre, i loro risultati mostrano anche la degenerazione della cellula del corno anteriore del nucleo di Onuf. Secondo questi studi, la lesione nel BCR è probabilmente posizionata nel nucleo di Onuf. È anche importante notare che rispetto all’EAS-EMG, i metodi utilizzati nel nostro studio non sono invasivi.
La malattia di Parkinson è caratterizzata da sintomi motori, come il tremore a riposo, rigidità e lentezza del movimento, che possono essere tutti spiegati dalla degenerazione dei neuroni nel sistema nervoso centrale. Tuttavia, i sintomi non motori nei pazienti con PD, come la stitichezza, i problemi alla vescica e l’ipotensione ortostatica hanno recentemente guadagnato una crescente attenzione. In questo studio, abbiamo trovato che le ampiezze BCR erano inferiori a quelle del gruppo di controllo, ma superiori a quelle del gruppo MSA-P. Questo suggerisce che alcune lesioni coinvolgono molto probabilmente il BCR nei pazienti PD, ma questa condizione è più grave nei pazienti MSA-P. Il sistema nervoso autonomo è più gravemente colpito nei pazienti MSA-P.
I sintomi non motori condivisi nei pazienti PD e MSA-P rendono difficile la diagnosi differenziata dei pazienti MSA-P e PD, soprattutto in una fase iniziale. Molteplici test sono stati utilizzati negli ultimi decenni nel tentativo di risolvere questo problema. I metodi di imaging, come la tomografia a emissione di positroni, l’immagine ponderata di diffusione e l’immagine tensore di diffusione, sono stati utilizzati in precedenza (18-20). L’applicazione della risonanza magnetica migliora l’accuratezza clinica (6, 21). Inoltre, l’imaging ponderato con suscettibilità a 3T è più suscettibile ai cambiamenti putaminali e all’asimmetria delle lesioni (21). L’uso della volumetria cerebrale con la RM è talvolta inefficiente (22). Nei pazienti con PD e MSA-P lievemente sintomatici, la perfusione cerebrale è alterata attraverso il metodo della tomografia computerizzata a emissione di fotoni singoli (23). Tuttavia, con questa tecnica, qualche fattore di influenza potrebbe disturbare i risultati, e il processo di analisi dei dati è complesso e richiede tempo. Inoltre, anche il costo dell’esame radiologico dovrebbe essere considerato, specialmente nei paesi in via di sviluppo. Altri metodi, come la misurazione dei livelli di liquido cerebrospinale, mancano di precisione (24, 25). L’esame della funzione dei nervi autonomi è diventato un obiettivo di ricerca negli ultimi anni (7, 26, 27). Questo metodo consiste in una batteria di test autonomici cardiovascolari, tra cui ipotensione ortostatica, pressione sanguigna sistolica e diastolica e altri test. Usando questo metodo, Pilleri et al. (28) hanno scoperto che i pazienti con MSA mostravano una maggiore frequenza cardiaca notturna e un ridotto declino notturno della frequenza cardiaca rispetto ai pazienti con PD. Pro e contro esistono nei metodi di cui sopra; nessun singolo test può avere sia sensibilità che specificità favorevoli. Un esame obiettivo rende una maggiore possibilità di diagnosi differenziale accurata.
Il nostro studio ha alcune limitazioni. Per esempio, la popolazione campione del nostro studio era limitata ai pazienti disponibili. Inoltre, tutti i pazienti con MSA-P e PD sono stati diagnosticati clinicamente piuttosto che patologicamente.
In conclusione, abbiamo osservato una differenza tra i pazienti MSA-P e PD nel BCR. Inoltre, riteniamo che il test BCR sia un approccio non invasivo, convincente, obiettivo ed economico per discriminare tra i pazienti MSA-P e PD. Uno studio supplementare con più casi convaliderà i nostri risultati. Ulteriori applicazioni che includono la traccia dell’alterazione del BCR con la progressione della MSA-P o l’associazione tra i parametri BCR e la prognosi possono aiutarci a monitorare meglio queste devastanti malattie neurologiche.
Dichiarazione etica
Tutti i partecipanti hanno dato il loro consenso informato scritto in conformità alla Dichiarazione di Helsinki e hanno accettato di partecipare allo studio. Questo studio è stato condotto sotto l’approvazione del Comitato per le decisioni etiche dell’amministrazione della ricerca presso il Primo Ospedale Affiliato dell’Università Medica di Wenzhou (CR2009041).
Contributi degli autori
H-jH e X-yZ hanno analizzato i dati, scritto e rivisto l’articolo. Z-yW ha partecipato alla scrittura e ha rivisto l’articolo. XW e W-lZ hanno eseguito i test clinici e raccolto i dati. B-cC e C-fL hanno concepito e progettato lo studio e ottenuto l’approvazione etica.
Dichiarazione di conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Riconoscimenti
Riconosciamo con gratitudine Feng-ming Zhang della Scuola delle Prime Scienze Mediche Cliniche, Wenzhou Medical University, per l’assistenza all’esperimento e l’acquisizione di finanziamenti.
Finanziamento
Questo lavoro è stato finanziato dall’Undergraduate Innovation Project della WMU (No. wyx2016101006).
2. Hughes AJ, Daniel SE, Kilford L, Lees AJ. Accuratezza della diagnosi clinica della malattia di Parkinson idiopatica: uno studio clinico-patologico di 100 casi. J Neurol Neurosurg Psychiatry (1992) 55(3):181-4. doi:10.1136/jnnp.55.3.181
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Terao Y, Fukuda H, Tokushige S, Inomata-Terada S, Yugeta A, Hamada M, et al. è atrofia del sistema multiplo con atassia cerebellare (MSA-C) come atassia spinocerebellare e atrofia del sistema multiplo con parkinsonismo (MSA-P) come la malattia di Parkinson? Uno studio saccade sulla fisiopatologia. Clin Neurophysiol (2016) 127(2):1491-502. doi:10.1016/j.clinph.2015.07.035
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Skinner SA, Vodusek DB. Registrazione intraoperatoria del riflesso bulbocavernoso. J Clin Neurophysiol (2014) 31(4):313-22. doi:10.1097/WNP.0000000000000054
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Ashraf VV, Taly AB, Nair KP, Rao S, Sridhar. Ruolo dei test neurofisiologici clinici nella valutazione della disfunzione erettile in persone con disturbi del midollo spinale. Neurol India (2005) 53(1):32-5; discussione 35-6. doi:10.4103/0028-3886.15048
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Niu X, Shao B, Ni P, Wang X, Chen X, Zhu B, et al. Il riflesso bulbocavernoso e le risposte dei potenziali somato-sensoriali del nervo pudendo in pazienti donne con malattie del sistema nervoso. J Clin Neurophysiol (2010) 27(3):207-11. doi:10.1097/WNP.0b013e3181dd4fca
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Konno H, Yamamoto T, Iwasaki Y, Iizuka H. Sindrome di Shy-Drager e sclerosi laterale amiotrofica. Studi citoarchitettonici e morfometrici dei neuroni autonomi sacrali. J Neurol Sci (1986) 73(2):193-204. doi:10.1016/0022-510x(86)90130-9
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Han W, Cui LY, Hua D, Li BH. Relazione tra la disfunzione autonoma dell’atrofia del sistema multiplo e l’elettromiografia dello sfintere anale esterno. Chin J Neurol (2006) 2:109-12. doi:10.3760/j.issn:1006-7876.2006.02.010
CrossRef Full Text | Google Scholar
19. Cnyrim CD, Kupsch A, Ebersbach G, Hoffmann KT. Diffusion tensor imaging nella malattia di Parkinson idiopatica e atrofia multisistemica (tipo parkinsoniano). Neurodegener Dis (2014) 13(1):1-8. doi:10.1159/000348512
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Hwang I, Sohn CH, Kang KM, Jeon BS, Kim HJ, Choi SH, et al. Differenziazione di atrofia del sistema multiplo parkinsonismo-predominante dalla malattia di Parkinson idiopatica utilizzando 3T susceptibility-weighted MR imaging, concentrandosi sul cambiamento putaminal e asimmetria delle lesioni. AJNR Am J Neuroradiol (2015) 36(12):2227-34. doi:10.3174/ajnr.A4442
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Huppertz HJ, Moller L, Sudmeyer M, Hilker R, Hattingen E, Egger K, et al. Differenziazione di sindromi parkinsoniane neurodegenerative da analisi di risonanza magnetica volumetrica e supporto vettoriale macchina classificazione. Mov Disord (2016) 31(10):1506-17. doi:10.1002/mds.26715
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Song IU, Yoo I, Chung YA, Jeong J. Il valore della perfusione cerebrale SPECT per la differenziazione tra malattia di Parkinson idiopatica leggermente sintomatica e la variante Parkinson dell’atrofia del sistema multiplo. Nucl Med Commun (2015) 36(10):1049-54. doi:10.1097/MNM.0000000000000354
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Ghaemi M, Hilker R, Rudolf J, Sobesky J, Heiss WD. Differenziare l’atrofia del sistema multiplo dal morbo di Parkinson: contributo della volumetria striatale e del mesencefalo MRI e imaging PET multi-tracciante. J Neurol Neurosurg Psychiatry (2002) 73(5):517-23. doi:10.1136/jnnp.73.5.517
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Baschieri F, Calandra-Buonaura G, Doria A, Mastrolilli F, Palareti A, Barletta G, et al. Test autonomico cardiovascolare eseguito con un nuovo approccio strumentale integrato è utile nel differenziare MSA-P da PD in fase iniziale. Parkinsonism Relat Disord (2015) 21(5):477-82. doi:10.1016/j.parkreldis.2015.02.011
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Roy S, Srivastava AK, Jaryal AK, Deepak KK. Le risposte cardiovascolari durante il test pressorio a freddo sono diverse nella malattia di Parkinson e nell’atrofia del sistema multiplo con parkinsonismo. Clin Auton Res (2015) 25(4):219-24. doi:10.1007/s10286-015-0294-x
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Pilleri M, Levedianos G, Weis L, Gasparoli E, Facchini S, Biundo R, et al. Profilo circadiano della frequenza cardiaca nella diagnosi differenziale tra malattia di Parkinson e atrofia del sistema multiplo. Parkinsonism Relat Disord (2014) 20(2):217-21. doi:10.1016/j.parkreldis.2013.11.006
PubMed Abstract | CrossRef Full Text | Google Scholar