- Introdução
- Materiais e Métodos
- Subjunto
- Electrofisiologia
- Bulbocavernosus Reflex
- Potencial Evocado do Nervo Somatosensorial do Nervo Pudendal
- Análise estatística
- Resultados
- Características Gerais do Paciente
- BCR Medidas
- PASP Medidas
- Discussão
- Declaração de Ética
- Contribuições dos autores
- Conflict of Interest Statement
- Confirmações
- Funding
Introdução
A diferenciação entre a doença de Parkinson (DP) e outras doenças parkinsonianas é uma questão difícil no diagnóstico clínico (1). Os sintomas de atrofia de múltiplos sistemas com predominância de Parkinson (MSA-P) e DP são sobrepostos e similares. Dez por cento dos prováveis pacientes com DP são eventualmente diagnosticados com MSA (2). A DP afeta predominantemente o sistema motor e às vezes influencia o sistema nervoso autônomo; entretanto, a AEM-P afeta principalmente o sistema nervoso autônomo. Quando o sistema nervoso autônomo é alterado, a constipação intestinal, problemas de bexiga e hipotensão ortostática freqüentemente ocorrem (3, 4). O parkinsonismo associado a um distúrbio do sistema nervoso autônomo torna difícil diferenciar entre pacientes com AEM-P e DP (5). Diferentes métodos têm sido usados para ajudar a fazer esta discriminação e, destes, os métodos de imagem têm sido os mais populares (6). Outros métodos baseados nas desordens do sistema nervoso autônomo também têm sido estudados (7). Apesar dessas tentativas anteriores, ainda é necessário um exame objetivo que inclua o sistema nervoso autônomo e que torne maior possibilidade de diagnóstico diferencial.
O reflexo do bulbocavernoso (BCR) causa a contração do músculo bulbocavernoso pela estimulação do nervo pudendo, e essa contração pode ser registrada através da técnica do eletromiograma. O BCR testa os sinais aferentes e eferentes do nervo pudendo, bem como do cordão sacral (8). Uma lesão do arco reflexo influencia as latências e amplitudes do BCR. Nos últimos 20 anos, o BCR tem sido utilizado no diagnóstico de várias doenças neurogênicas, incluindo impotência neurogênica, choque espinhal e síndrome equina cauda (9-11). O nervo pudendo somato-evoked potential responses (PSEP) compartilha o mesmo caminho com o BCR antes de entrar na medula espinhal. Portanto, a PSEP juntamente com a BCR poderia ser usada para localizar uma lesão no caminho. Pesquisas anteriores do nosso grupo sugerem que existe uma anormalidade de BCR em pacientes com AEM (12). Dado que a AEM e a DP compartilham os mesmos sintomas de distúrbios do sistema nervoso autônomo, a anormalidade também pode existir em pacientes com DP. Neste estudo, pretendemos distinguir entre pacientes com AEM-P e DP usando a medida de BCR. Especificamente, nosso estudo comparou as latências e amplitudes da BCR e PSEP em 38 prováveis pacientes com AEM-P, 32 pacientes com DP e 30 sujeitos normais e saudáveis. Foram realizadas análises estatísticas para diferenciar entre a AEM-P e a DP.
Materiais e Métodos
Subjunto
Neste estudo, 38 prováveis pacientes com AEM-P e 32 pacientes com DP foram selecionados para participar das investigações eletrofisiológicas entre dezembro de 2012 e outubro de 2014. Todos os pacientes foram encaminhados para o Primeiro Hospital Filiado da Universidade Médica de Wenzhou. Todos os pacientes de MSA-P preencheram os critérios de inclusão publicados em 2008 (13). Prováveis pacientes com MSA-P foram diagnosticados por dois critérios de inclusão: falha autonômica envolvendo incontinência urinária (incapacidade de controlar a liberação de urina da bexiga, com disfunção erétil em homens) ou uma diminuição ortostática da pressão arterial e um parkinson pouco levodopa-resposta (bradicinesia com rigidez, tremor ou instabilidade postural). Da mesma forma, todos os pacientes com DP atenderam aos critérios diagnósticos clínicos da Movement Disorder Society (14). Os pacientes com DP foram caracterizados por tremor em repouso, rigidez, acinesia, e instabilidade postural. Além disso, todos os pacientes foram avaliados sob ressonância magnética (RM) e uma visita de acompanhamento. Também recrutamos 30 sujeitos saudáveis sem histórico de doenças neurológicas ou psiquiátricas como grupo controle. Todos os controles saudáveis foram submetidos a exames clínicos e neurológicos completos. Foram excluídos os sujeitos com histórico de parkinson, ataxia, disfunção autonômica ou doenças neurológicas (por exemplo, epilepsia ou acidente vascular cerebral). Além disso, foram excluídos os sujeitos do sexo masculino com doenças prostáticas. A RM foi usada para excluir os sujeitos com lesões cerebrovasculares ou de ocupação espacial.
Todos os participantes deram seu consentimento livre e esclarecido por escrito de acordo com a Declaração de Helsinque e concordaram em participar do estudo. Este estudo foi conduzido sob a aprovação do Comitê de Decisão Ética da Administração de Pesquisa do Primeiro Hospital Filiado da Universidade Médica de Wenzhou (CR2009041).
Electrofisiologia
O sistema EMG/EP Keypoint (Dantec, Bristol, Reino Unido) foi usado para conduzir os testes BCR e PSEP. Um eletrodo de terra foi colocado contra a coxa dos pacientes na posição de litotomia. A temperatura da superfície da pele foi mantida acima de 32°C.
Bulbocavernosus Reflex
Em homens, eletrodos estimulantes em forma de anel foram colocados no corpo ou na raiz do pênis. O pólo positivo foi localizado na corona glandis. Nas fêmeas, os eletrodos estimulantes em forma de pinça foram colocados perto da sínfise púbica. Os pólos positivo e negativo foram colocados no clítoris e nas vulvas dos lábios, respectivamente. O BCR foi registrado por eletrodos de agulha concêntrica inseridos no escroto, na região perianal próxima à linha média. A intensidade do estímulo foi sete vezes o limiar sensorial do indivíduo, e a impedância do eletrodo foi <5 kΩ. A estimulação da onda quadrada foi de 1,9 pulsos/s, e registramos o valor médio de 20 ondas de reflexão. O tempo de varredura foi de 5 ms/divisão, o intervalo de banda foi de 10 Hz a 2 kHz e o tempo de persistência foi de 100 ms. As latências foram calculadas com base no início do estímulo e no início da resposta reflexa.
Potencial Evocado do Nervo Somatosensorial do Nervo Pudendal
Os eletrodos usados para evocar os potenciais do nervo pudendo eram idênticos aos usados para evocar o BCR, e foram aplicados nos mesmos locais. Entretanto, a intensidade do estímulo foi três vezes o limiar sensorial do indivíduo. Da mesma forma, a impedância do eletrodo foi mantida em 5 kΩ. A frequência da onda quadrada foi de 5 pulsos/s e foi calculada como média em 200 ondas. O tempo de varredura foi ajustado para 0,2 ms/divisão, e o tempo de persistência relevante foi de 100 ms, com largura de banda variando de 10 Hz a 5 kHz. O eletrodo de gravação foi localizado 2 cm atrás de Cz, e o eletrodo de referência foi colocado na testa em Fpz. A onda PSEP P41 foi detectada após a entrega do estímulo.
Análise estatística
Os dados foram analisados usando o Statistical Package for the Social Sciences 22.0 (IBM, CA, EUA) e Stata SE 12 (StataCorp, LP, EUA). A distribuição normal e a homogeneidade da variância foram identificadas usando o teste de Kolmogorov-Smirnov e o teste de Shapiro-Wilk. Um teste qui-quadrado foi utilizado para comparar as taxas de elicitação de BCR entre os grupos MSA-P, PD e controle. Uma análise de variância unidirecional (ANOVA) foi utilizada para analisar as diferenças nos parâmetros de BCR entre os três grupos (MSA-P, PD e controle) em homens. Os parâmetros PSEP também foram analisados com uma ANOVA. Um teste de comparação múltipla de Bonferroni foi aplicado quando diferenças significativas foram identificadas. Este teste revelou contrastes adicionais entre os grupos. Um teste de Kruskal-Wallis rank foi usado para comparar os parâmetros BCR e PSEP entre os três (MSA-P, PD e controle) nas fêmeas. Um teste de Nemenyi foi aplicado para avaliar melhor as diferenças entre cada grupo. Uma análise da característica operacional do receptor (ROC) foi utilizada para avaliar a especificidade e sensibilidade dos parâmetros BCR. Um valor de p ≤ 0,05 foi considerado estatisticamente significativo.
Resultados
Características Gerais do Paciente
Trinta e oito prováveis pacientes com MSA-P e 32 pacientes com DP participaram do estudo. A idade dos prováveis pacientes com AEM-P variou de 36 a 74 anos, sendo a média de idade de 54,21 ± 7,92 anos. 39% dos pacientes (15 casos) apresentavam disfunção erétil, 45% dos pacientes (17 casos) tinham incontinência urinária e 76% dos pacientes (22 casos) tinham hipotensão ortostática. Além disso, a idade dos pacientes com DP diagnosticada variou de 35 a 77 anos e a média de idade foi de 55,23 ± 8,75 anos. 22% dos pacientes (7 casos) apresentavam disfunção erétil, 3% dos pacientes (1 caso) tinham incontinência urinária e 16% dos pacientes (5 casos) tinham hipotensão ortostática. Ambos os grupos de AEM-P e DP sofreram falência autonômica (ver Tabela 1).
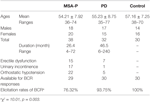
Tábua 1. Características gerais e taxas de elicitação das latências do reflexo bulbocavernoso (BCR) entre atrofia de múltiplos sistemas com predominância de Parkinson (MSA-P), doença de Parkinson (PD) e grupos de controle.
BCR Medidas

Tabela 2. Comparação da média ou da mediana das latências reflexo bulbocavernoso entre a atrofia de múltiplos sistemas com predominância de Parkinson (MSA-P), doença de Parkinson (DP), e grupos controle.

Figura 1. Latências e amplitudes do reflexo Bulbocavernoso (BCR) entre atrofia de múltiplos sistemas com predominância de Parkinson (MSA-P), doença de Parkinson (PD) e grupos de controle em homens (A) e mulheres (B). As latências de BCR não foram significativamente diferentes entre pacientes controle e DP, mas os pacientes com AEM tiveram latências prolongadas em comparação com os outros grupos em homens (C) e mulheres (D). As amplitudes de BCR foram significativamente menores nos pacientes com AEM-P do que nos pacientes do grupo controle, e as amplitudes dos pacientes com DP caíram entre as amplitudes controle e AEM-P.

Tábua 3. Comparação das amplitudes médias ou medianas do reflexo bulbocavernoso entre a atrofia de múltiplos sistemas com predominância de Parkinson (MSA-P), doença de Parkinson (DP) e grupos de controle.
PASP Medidas
Não houve diferenças significativas entre os grupos AEM-P, DP e controle, tanto nos grupos masculino como feminino (ver Tabela 4).

Tábua 4. Comparação da média das potenciais respostas somato-evocadas do nervo pudendo P41 latências e amplitudes entre atrofia de múltiplos sistemas com predominância de Parkinson (MSA-P), doença de Parkinson (DP) e grupos controle.
Discussão
Neste estudo, descobrimos que uma diferença encontrada nos parâmetros BCR poderia ajudar a distinguir entre MSA-P e DP. Os pacientes com AEM-P apresentaram uma taxa de elicitação BCR menor do que os pacientes com DP (76,3 vs 90,9%). Os parâmetros de BCR revelaram diferenças entre os grupos AEM-P, DP e controle. Os pacientes com AEM-P exibiram latências mais longas e amplitudes menores do que os pacientes com DP. Além disso, ambos os parâmetros poderiam distinguir significativamente a MSA-P usando uma curva ROC.
A via sensorial somática aferente do BCR inclui o nervo pudendo. A via motor somática eferente é composta pelos segmentos espinhais S2-S4, incluindo o núcleo de Onuf e o nervo pudendo. Um impulso contrai o músculo bulbocavernoso (8, 15). A via sensorial somática aferente dos PSEPs compreende dois segmentos, e o segmento anterior partilha a mesma via aferente com o BCR. Um impulso é então transmitido para o córtex cerebral através da medula espinhal. A combinação do BCR e PSEP poderia ser usada para localizar uma lesão em algumas neuropatias, como a bexiga diabética neurogênica e a síndrome cauda equina.
Neste estudo, pacientes com AME-P e PD apresentaram um BCR anormal e PSEP normal. As taxas de elicitação dos pacientes com AEM-P foram menores do que as dos pacientes com DP. Além disso, não conseguimos eliciar o BCR em 23,68% dos pacientes com AEM-P. A lesão do arco reflexo no BCR dos pacientes com AEM-P foi mais grave do que nos pacientes com DP. Além disso, os pacientes com AEM-P exibiram amplitudes BCR menores do que os pacientes com DP. Entretanto, os PSEPs não revelaram diferenças entre os pacientes com AEM-P, DP e sujeitos de controle. Os dados do PSEP não podem ser usados para distinguir entre pacientes com AEM-P e DP em nosso estudo. O caminho dos PSEPs parecia estar completo tanto nos pacientes com AEM-P quanto nos pacientes com DP. Como o BCR e o PSEP partilham a mesma via aferente, é provável que as lesões estejam localizadas na via eferente, que consiste nos segmentos vertebrais S2-S4, incluindo o núcleo de Onuf, ou no nervo pudendo. Estes achados corroboram os resultados de vários estudos anteriores. Konno et al. (16) encontraram perda de privação de neurônios motores somáticos no núcleo de Onuf. Além disso, os estudos prévios do Ref. (17) encontraram que a eletromiografia do esfíncter anal externo (EAS-EMG) compartilha o mesmo caminho com o BCR. Além disso, seus resultados também mostram a degeneração da célula do núcleo anterior do chifre de Onuf. De acordo com esses estudos, a lesão no BCR provavelmente está posicionada no núcleo de Onuf. Também é importante notar que, comparado ao EAS-EMG, os métodos utilizados em nosso estudo são não invasivos.
A doença de Parkinson é caracterizada por sintomas motores, como tremor em repouso, rigidez e lentidão de movimento, que podem ser explicados pela degeneração dos neurônios no sistema nervoso central. Entretanto, os sintomas não-motores em pacientes com DP, tais como constipação, problemas de bexiga e hipotensão ortostática, têm ganhado atenção crescente recentemente. Neste estudo, constatamos que as amplitudes do BCR foram menores que as do grupo controle, mas maiores que as do grupo MSA-P. Isto sugere que certas lesões muito provavelmente envolvem a BCR em pacientes com DP, mas esta condição é mais grave em pacientes com AEM-P. O sistema nervoso autônomo é mais seriamente afetado em pacientes com AEM-P.
Sintomas não motores compartilhados em pacientes com DP e AEM-P dificultam o diagnóstico diferencial de pacientes com AEM-P e DP, especialmente em um estágio inicial. Vários testes têm sido usados nas últimas décadas na tentativa de resolver este problema. Métodos de imagem, como a tomografia por emissão de pósitrons, imagem ponderada por difusão e imagem tensora de difusão, têm sido usados anteriormente (18-20). A aplicação da ressonância magnética melhora a precisão clínica (6, 21). Além disso, as imagens ponderadas pela suscetibilidade 3T são mais suscetíveis a alterações putaminais e assimetrias de lesão (21). O uso da volumetria cerebral com a RM é ineficiente às vezes (22). Em pacientes com DP e MSA-P levemente sintomáticos, a perfusão cerebral é alterada através do método de tomografia computadorizada com emissão monofotônica (23). Entretanto, com esta técnica, algum fator de influência pode perturbar os resultados, e o processo de análise de dados é complexo e demorado. Além disso, o custo do exame radiológico também deve ser considerado, especialmente em países em desenvolvimento. Outros métodos, como a medição dos níveis de líquido cefalorraquidiano, carecem de precisão (24, 25). O exame da função do nervo autonômico tornou-se um foco de pesquisa nos últimos anos (7, 26, 27). Esse método consiste em uma bateria de testes autonômicos cardiovasculares, incluindo hipotensão ortostática, pressão arterial sistólica e diastólica, e outros testes. Usando este método, Pilleri et al. (28) descobriram que pacientes com AEM apresentaram aumento da frequência cardíaca noturna e redução da frequência cardíaca noturna em comparação com pacientes com DP. Os prós e contras existem nos métodos acima; nenhum teste pode ter sensibilidade e especificidade favoráveis. Um exame objetivo torna uma maior possibilidade de diagnóstico diferencial preciso.
Nosso estudo tem algumas limitações. Por exemplo, a população da amostra do nosso estudo foi restrita aos pacientes disponíveis. Além disso, todos os pacientes com AEM-P e DP foram diagnosticados clinicamente e não patologicamente.
Em conclusão, observamos uma diferença entre os pacientes com AEM-P e DP no BCR. Além disso, consideramos o teste BCR como uma abordagem não invasiva, convincente, objetiva e econômica para discriminar entre os pacientes com AEM-P e DP. Um estudo suplementar com mais casos validará os nossos resultados. Outras aplicações, incluindo o vestígio de alteração de BCR com a progressão da MSA-P ou a associação entre parâmetros de BCR e prognóstico, podem nos ajudar a monitorar melhor essas doenças neurológicas devastadoras.
Declaração de Ética
Todos os participantes deram seu consentimento livre e esclarecido por escrito de acordo com a Declaração de Helsinque e concordaram em participar do estudo. Este estudo foi conduzido sob a aprovação do Comitê de Decisão Ética da Administração de Pesquisa do Primeiro Hospital Filiado da Universidade Médica de Wenzhou (CR2009041).
Contribuições dos autores
H-jH e X-yZ analisaram os dados, escreveram e revisaram o artigo. Z-yW participou da redação e revisou o artigo. XW e W-lZ realizaram os testes clínicos e coletaram os dados. B-cC e C-fL conceberam e desenharam o estudo e obtiveram aprovação ética.
Conflict of Interest Statement
Os autores declaram que a pesquisa foi conduzida na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
Confirmações
Apreciamos a Feng-ming Zhang da Faculdade de Ciências Médicas da Primeira Clínica, Universidade Médica de Wenzhou, pela assistência na experiência e aquisição de financiamento.
Funding
Este trabalho foi financiado pelo Projeto de Inovação de Graduação da WMU (No. wyx2016101006).
2. Hughes AJ, Daniel SE, Kilford L, Lees AJ. Precisão do diagnóstico clínico da doença de Parkinson idiopática: um estudo clínico-patológico de 100 casos. J Neurol Neurosurg Psychiatry (1992) 55(3):181-4. doi:10.1136/jnnp.55.3.181
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Terao Y, Fukuda H, Tokushige S, Inomata-Terada S, Yugeta A, Hamada M, et al. A atrofia do sistema múltiplo com ataxia cerebelar (MSA-C) é como a ataxia espinocerebelar e a atrofia do sistema múltiplo com Parkinson (MSA-P) como a doença de Parkinson? Um estudo de sacanagem em fisiopatologia. Clin Neurophysiol (2016) 127(2):1491-502. doi:10.1016/j.clinph.2015.07.035
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Skinner SA, Vodusek DB. Registo intra-operatório do reflexo do bulbocavernosus. J Clin Neurophysiol (2014) 31(4):313-22. doi:10.1097/WNP.0000000000000054
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Ashraf VV, Taly AB, Nair KP, Rao S, Sridhar. Papel dos testes clínicos neurofisiológicos na avaliação da disfunção erétil em pessoas com distúrbios da medula espinhal. Neurol India (2005) 53(1):32-5; discussão 35-6. doi:10.4103/0028-3886.15048
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Niu X, Shao B, Ni P, Wang X, Chen X, Zhu B, et al. Reflexo Bulbocavernosus e o nervo pudendo somatossensorial – respostas potenciais em pacientes do sexo feminino com doenças do sistema nervoso. J Clin Neurophysiol (2010) 27(3):207-11. doi:10.1097/WNP.0b013e3181dd4fca
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Konno H, Yamamoto T, Iwasaki Y, síndrome de Iizuka H. Shy-Drager e esclerose lateral amiotrófica. Estudos cito-arquitectónicos e morfométricos de neurónios autonómicos sacrais. J Neurol Sci (1986) 73(2):193-204. doi:10.1016/0022-510x(86)90130-9
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Han W, Cui LY, Hua D, Li BH. Relação entre a disfunção autonômica da atrofia do sistema múltiplo e o esfíncter eletromiográfico anal externo. Chin J Neurol (2006) 2:109-12. doi:10.3760/j.issn:1006-7876.2006.02.010
CrossRef Full Text | Google Scholar
19. Cnyrim CD, Kupsch A, Ebersbach G, Hoffmann KT. Difusão de imagens tensoriais na doença de Parkinson idiopática e atrofia multissistêmica (tipo parkinsoniano). Neurodegener Dis (2014) 13(1):1-8. doi:10.1159/000348512
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Hwang I, Sohn CH, Kang KM, Jeon BS, Kim HJ, Choi SH, et al. Differentiation of parkinsonism-predominant multiple system atrophy from idiopathic Parkinson disease using 3T susceptibility-weighted MR imaging, focusing on putaminal change and lesion asymmetry. AJNR Am J Neuroradiol (2015) 36(12):2227-34. doi:10.3174/ajnr.A4442
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Huppertz HJ, Moller L, Sudmeyer M, Hilker R, Hattingen E, Egger K, et al. Diferenciação de síndromes neurodegenerativas parkinsonianas por análise de ressonância magnética volumétrica e classificação de máquina vetorial de suporte. Mov Disord (2016) 31(10):1506-17. doi:10.1002/mds.26715
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Song IU, Yoo I, Chung YA, Jeong J. O valor da perfusão cerebral SPECT para diferenciação entre a doença de Parkinson idiopática levemente sintomática e a variante de Parkinson da atrofia de múltiplos sistemas. Nucl Med Commun (2015) 36(10):1049-54. doi:10.1097/MNM.00000000000000000354
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Ghaemi M, Hilker R, Rudolf J, Sobesky J, Heiss WD. Diferenciando a atrofia de múltiplos sistemas da doença de Parkinson: contribuição da volumetria da RM do striatal e midbrain e imagens PET multi-tracer. J Neurol Neurosurg Psychiatry (2002) 73(5):517-23. doi:10.1136/jnnp.73.5.517
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Baschieri F, Calandra-Buonaura G, Doria A, Mastrolilli F, Palareti A, Barletta G, et al. Os testes autônomos cardiovasculares realizados com uma nova abordagem instrumental integrada são úteis para diferenciar o MSA-P da DP em uma fase inicial. Parkinsonism Relat Disord (2015) 21(5):477-82. doi:10.1016/j.parkreldis.2015.02.011
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Roy S, Srivastava AK, Jaryal AK, Deepak KK. As respostas cardiovasculares durante o teste de pressão fria são diferentes na doença de Parkinson e na atrofia de múltiplos sistemas com parkinsonismo. Clin Auton Res (2015) 25(4):219-24. doi:10.1007/s10286-015-0294-x
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Pilleri M, Levedianos G, Weis L, Gasparoli E, Facchini S, Biundo R, et al. Perfil circadiano da frequência cardíaca no diagnóstico diferencial entre a doença de Parkinson e a atrofia do sistema múltiplo. Parkinsonism Relat Disord (2014) 20(2):217-21. doi:10.1016/j.parkreldis.2013.11.006
PubMed Abstract | CrossRef Full Text | Google Scholar