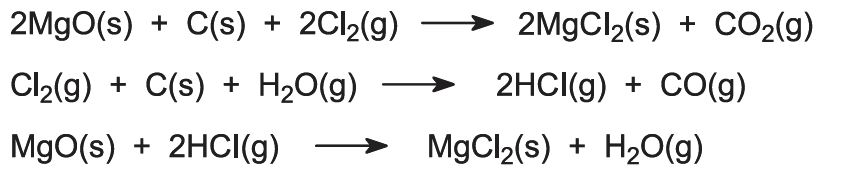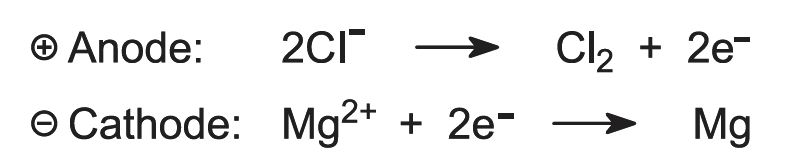Verwendungen von Magnesium
Magnesium ist das am dritthäufigsten verwendete Metall im Bauwesen (nach Eisen und Aluminium).
Nahezu 70 % der Weltproduktion von Magnesium wird zur Herstellung von Legierungen verwendet, die eine sehr geringe Dichte, eine vergleichsweise hohe Festigkeit und eine ausgezeichnete Bearbeitbarkeit aufweisen. Diese Legierungen enthalten eines oder mehrere der Elemente Aluminium, Zink, Mangan oder Silizium in unterschiedlichen Mengen, je nachdem, wie die Legierung verarbeitet werden soll.
Die Hälfte dieser Legierungen wird zur Herstellung von Druckgussstücken mit etwa 90 % Magnesium verwendet. Autoteile wie Lenkradkerne, Getriebegehäuse, Armaturenbrettstrukturen und Kühlerträger werden häufig aus druckgegossenen Magnesiumlegierungen hergestellt.
Zirkonium und Seltene Erden werden in einigen Legierungen hinzugefügt, um die Legierung stärker zu machen. Diese Gruppe von Legierungen wird normalerweise im Sandgussverfahren zu Teilen wie Hubschraubergetrieben und Hilfsgetrieben für Strahltriebwerke verarbeitet. Einige Hochleistungsautos bestehen aus einer Magnesiumlegierung, ebenso wie Gehäuse für Kameras.
Eine weitere Hälfte des in Legierungen verwendeten Magnesiums wird in der Aluminiumindustrie als Legierungszusatz verwendet. Die Legierungen werden in Verpackungen verwendet, insbesondere in Getränkedosen und in Folien zum Schutz von Lebensmitteln.
Die meisten Getränkedosen aus Metall, die in den Vereinigten Staaten hergestellt werden, bestehen aus Aluminium, das mit etwa 5 % Magnesium und einer kleinen Menge anderer Elemente legiert ist. In Europa und Asien besteht die Metalldose zu etwa 50 % aus Stahl und zu 50 % aus einer Aluminiumlegierung, wobei der obere Teil aus einer Aluminiumlegierung besteht.
Magnesiumlegierungen werden auch als Opferanoden verwendet. Wenn es mit einem weniger reaktiven Metall verbunden wird, wird das Magnesium zur Anode einer elektrischen Zelle und korrodiert vor dem anderen Metall. Auf diese Weise werden die Rümpfe von Stahlschiffen und die Unterwasserstruktur von Ölplattformen und Pipelines vor Korrosion geschützt.
Eine weitere sehr wichtige Verwendung von Magnesium ist die Herstellung von Titan. Etwa 10 % der Weltproduktion von Magnesium wird auf diese Weise verwendet.
Weitere 10 % werden bei der Herstellung von hochwertigem Stahl für Konstruktionen wie große Gebäude und Brücken verwendet. Es wird in geschmolzenem Zustand dem geschmolzenen Eisen zugesetzt, um den Schwefel durch chemische Reaktion zu entfernen, wobei die Schlacke aus Magnesiumsulfid abgeschöpft wird.
Eine der vielleicht bekanntesten, aber kleinsten Verwendungen von Magnesium ist die Verwendung in Leuchtraketen, Feuerwerkskörpern und anderen Brandvorrichtungen. Sie enthalten sehr kleine Magnesiumstücke, die entzündet werden können.
Jahresproduktion von Magnesium
Diese Zahlen beziehen sich auf die Primärproduktion aus dem Erz und schließen die Sekundärproduktion aus wiederverwerteten Materialien nicht ein.
| Welt | 910 000 Tonnen1 |
| China | 800 000 Tonnen1 |
| U.S. | 70 000 Tonnen2 |
| Russland | 30 000 Tonnen1 |
| Israel | 25 000 t1 |
| Kasachstan | 20 000 t1 |
Daten aus:
1 U.S. Geological Survey, Mineral Commodity Summaries, 2016.
2 Die letzte verfügbare Zahl stammt aus dem Jahr 2012 (Minor Metals Trade Association, 2012)
Im Jahr 1993 war die Menge des in China produzierten Magnesiums vernachlässigbar (ca. 5%), zwanzig Jahre später produziert China nun fast 90% des weltweiten Magnesiums. Obwohl das Land über reiche Vorkommen an geeigneten Magnesiumerzen verfügt, war es das rasche Wirtschaftswachstum, das im Land zu einer erhöhten Nachfrage nach Produkten aus Magnesiumlegierungen führte. Dies wiederum führte zur Schließung von Werken in vielen Ländern. Die Herstellungsverfahren verbrauchen sehr viel Energie, so dass die Produktion in vielen Ländern unwirtschaftlich ist. Magnesium wird heute in Westeuropa nicht mehr hergestellt.
Herstellung von Magnesium
Magnesium kommt in Lösung im Meerwasser (etwa 1,3 kg m-3 Magnesium) und in natürlichen Solen vor. Es kommt auch in großem Umfang in den Erzen Magnesit (MgCO3) und Dolomit (MgCO3.CaCO3) vor.
Magnesium wird hauptsächlich durch zwei Methoden hergestellt:
a) thermische Reduktion von Magnesiumoxid
b) Elektrolyse von Magnesiumchlorid
Vor der Ausweitung der Produktion in China war die Elektrolyse in Ländern, in denen elektrische Energie relativ billig erzeugt wird, die üblichere Produktionsmethode. Die meisten chinesischen Anlagen verwenden jedoch eine aktualisierte Version des thermischen Reduktionsverfahrens, das ursprünglich in den 1940er Jahren in Kanada entwickelt wurde, um die Produktion während des Zweiten Weltkriegs anzukurbeln (das „Pidgeon-Verfahren“).
(a) Thermisches Reduktionsverfahren
Dolomiterz wird zerkleinert und in einem Ofen erhitzt, um ein Gemisch aus Magnesium- und Calciumoxiden zu erzeugen, ein Verfahren, das als Kalzinierung bekannt ist:
Der nächste Schritt ist die Reduktion des Magnesiumoxids. Das Reduktionsmittel ist Ferrosilizium (eine Legierung aus Eisen und Silizium), das durch Erhitzen von Sand mit Koks und Eisenschrott hergestellt wird und in der Regel etwa 80 % Silizium enthält.
Die Oxide werden mit zerkleinertem Ferrosilizium gemischt und zu Briketts verarbeitet, die in den Reaktor gefüllt werden. Es kann auch Aluminiumoxid zugesetzt werden, um den Schmelzpunkt der Schlacke zu senken. Die Reaktion wird bei 1500 – 1800 K unter sehr niedrigem Druck, nahe dem Vakuum, durchgeführt. Unter diesen Bedingungen entsteht das Magnesium als Dampf, der durch Abkühlung auf etwa 1100 K in stahlausgekleideten Kondensatoren kondensiert und dann abgezogen und zu Barren gegossen wird:
Die Vorwärtsreaktion ist endotherm und die Gleichgewichtslage ist zugunsten von Magnesiumoxid. Durch Entfernen des entstehenden Magnesiumdampfes wird die Reaktion jedoch abgeschlossen. Die Kieselsäure verbindet sich mit Kalziumoxid und bildet die geschmolzene Schlacke, das Kalziumsilikat:
Das Verfahren liefert Magnesium mit einer Reinheit von bis zu 99,99 %, die etwas höher ist als bei den elektrolytischen Verfahren.
(b) Das elektrolytische Verfahren
Außerhalb Chinas ist das elektrolytische Verfahren in der Regel die bevorzugte Wahl.
Das Verfahren umfasst zwei Stufen:
i) Herstellung von reinem Magnesiumchlorid aus Meerwasser oder Sole
ii) Elektrolyse von geschmolzenem Magnesiumchlorid
(i) Herstellung von reinem Magnesiumchlorid aus Meerwasser oder Sole
Wenn Meerwasser das Rohmaterial ist, wird es mit Dolomit behandelt, der durch Erhitzen auf hohe Temperatur in Mischoxide umgewandelt wurde. Dabei fällt Magnesiumhydroxid aus, während Calciumhydroxid in Lösung bleibt. Das Magnesiumhydroxid wird abfiltriert und bildet beim Erhitzen leicht das reine Oxid.
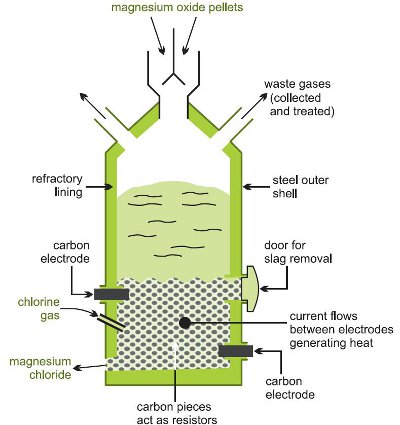
Die Umwandlung in Magnesiumchlorid erfolgt durch Erhitzen des mit Kohlenstoff vermischten Oxids in einem Chlorstrom bei hoher Temperatur in einem Elektroofen (Abbildung 1).
Abbildung 1: Darstellung der Herstellung von Magnesiumchlorid aus Magnesiumoxid.
Es laufen mehrere Reaktionen ab:
Wenn magnesiumchloridreiche Solen die Magnesiumquelle sind, wird die Lösung zur Entfernung verschiedener Verunreinigungen behandelt und die verbleibende Magnesiumchloridlösung durch Eindampfen in mehreren Stufen konzentriert.
Die letzte Stufe der Entwässerung muss in Gegenwart von Chlorwasserstoffgas durchgeführt werden, um eine Hydrolyse des Magnesiumchlorids zu vermeiden:
Ein neues Verfahren wird derzeit unter Verwendung von Magnesit entwickelt. Kleine Stücke des Erzes werden durch Erhitzen mit Chlor in einem Elektroofen in Gegenwart von Kohlenmonoxid direkt in geschmolzenes Magnesiumchlorid umgewandelt.
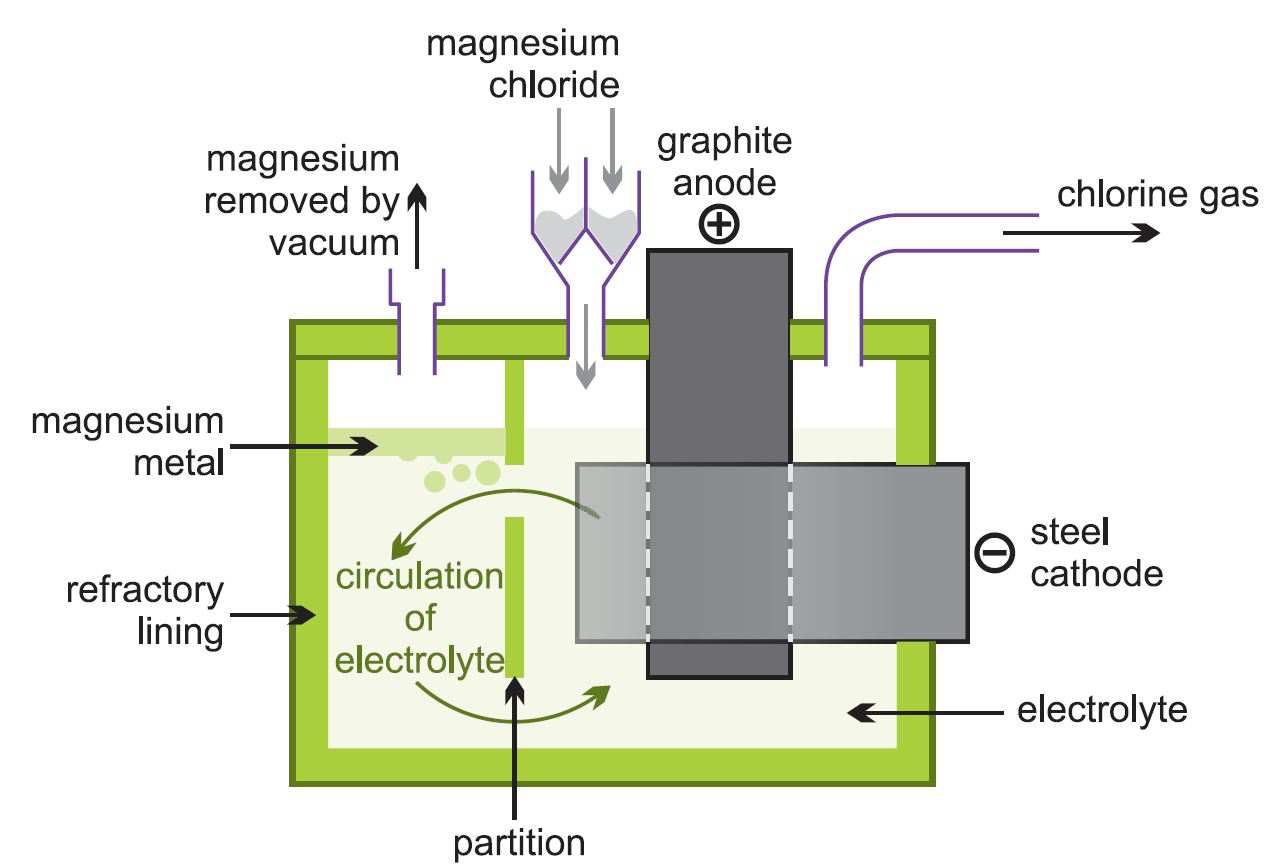
(ii) Die Elektrolyse von geschmolzenem Magnesiumchlorid
Das resultierende wasserfreie Magnesiumchlorid wird kontinuierlich in Elektrolysezellen (Abbildung 2) geleitet, die heiß genug sind, um es zu schmelzen.
Bei der Elektrolyse entstehen Magnesium und Chlor:
Abbildung 2, die die Elektrolyse von Magnesiumchlorid veranschaulicht.
Das geschmolzene Metall wird abgezogen und in Barren gegossen. Das Chlorgas wird in den Chlorierungsofen zurückgeführt.
Sekundärproduktion
Nur etwa 3 % des gesamten jährlich verbrauchten Magnesiums stammen aus dem Recycling, schätzungsweise 23 000 Tonnen.