Usos de magnésio
Magnésio é o terceiro metal mais utilizado na construção (depois do ferro e do alumínio).
Nearly 70% da produção mundial de magnésio é usada para fazer ligas, que têm uma densidade muito baixa, resistência comparativamente alta e excelente usinabilidade. Estas ligas contêm um ou mais dos elementos alumínio, zinco, manganês ou silício em várias quantidades, dependendo de como a liga será processada.
Metade destas ligas são utilizadas para fazer fundição sob pressão com cerca de 90% de magnésio. Componentes de automóveis como núcleos de volante, carcaças de caixas de velocidades, estruturas de painel de instrumentos e suportes de radiadores são frequentemente feitos de ligas de magnésio fundido sob alta pressão.
Zircónio e elementos de terras raras são adicionados em algumas ligas para tornar a liga mais forte. Este grupo de ligas é normalmente fundido em areia em peças tais como caixas de velocidades de helicópteros e caixas de velocidades auxiliares de motores a jacto. Alguns carros de alto desempenho são feitos de uma liga de magnésio, assim como as carcaças para câmeras.
Outra metade do magnésio usado em ligas é como aditivo de liga, na indústria do alumínio. As ligas são usadas em embalagens, particularmente em latas de bebidas (bebidas) e em folhas para proteger alimentos.
A maioria das latas metálicas para bebidas fabricadas nos Estados Unidos são feitas de ligas de alumínio com cerca de 5% de magnésio e uma pequena quantidade de outros elementos. Na Europa e Ásia, as latas metálicas contêm cerca de 50% de aço e 50% de liga de alumínio, sendo a parte superior de liga de alumínio.
As ligas de magnésio também são usadas como ânodos sacrificiais. Quando ligado a um metal menos reativo, o magnésio torna-se o ânodo de uma célula elétrica, e corrói em preferência ao outro metal. Isto é usado para proteger os cascos dos navios de aço e a estrutura subaquática das plataformas e oleodutos contra a corrosão.
Um outro uso muito importante do magnésio é na fabricação do titânio. Cerca de 10% da produção mundial de magnésio é utilizada desta forma.
Outros 10% são utilizados na fabricação de aço de alta qualidade para construções, tais como grandes edifícios e pontes. Ele é adicionado no estado fundido ao ferro fundido, para remover enxofre por reação química, a escória de sulfeto de magnésio sendo desnatada.
Talvez um dos mais conhecidos mas menores usos do magnésio esteja em chamas de socorro, fogos de artifício e outros dispositivos incendiários. Eles contêm pedaços muito pequenos de magnésio que podem ser inflamados.
Produção anual de magnésio
Estes números são para a produção primária a partir do minério e não incluem a produção secundária a partir de materiais reciclados.
| Mundo | 910 000 toneladas1 |
| China | 800 000 toneladas1 |
| U.S. | 70 000 toneladas2 |
| Rússia | 30 000 toneladas1 |
| Israel | 25 000 toneladas1 |
| Kazakhstan | 20 000 toneladas1 |
Dados de:
1 U.S. Geological Survey, Mineral Commodity Summaries, 2016.
2 A última figura disponível é 2012 (Minor Metals Trade Association, 2012)
Em 1993, a quantidade de magnésio produzida na China era insignificante (cerca de 5%), vinte anos depois, a China fabrica agora quase 90% do magnésio do mundo. Embora o país tenha ricos depósitos de minérios de magnésio apropriados, foi o rápido crescimento econômico que levou ao aumento da demanda no país por produtos que utilizam ligas de magnésio. Isto, por sua vez, resultou no encerramento de fábricas em muitos países. Os processos de fabricação utilizam quantidades muito grandes de energia e, por esta razão, a produção em muitos países não é econômica. O magnésio não é agora produzido na Europa Ocidental.
Fabricação de magnésio
Magnésio é encontrado em solução na água do mar (cerca de 1,3 kg m-3 de magnésio) e em salmouras naturais. Também é encontrado extensivamente nos minérios magnesite (MgCO3) e dolomite (MgCO3.CaCO3).
>
Magnésio é principalmente produzido por dois métodos:
a) redução térmica do óxido de magnésio
b) eletrólise do cloreto de magnésio
Antes da expansão da produção na China, a eletrólise era o método mais comum de produção em países onde a energia elétrica é produzida a um custo relativamente baixo. A maioria das plantas chinesas, entretanto, utiliza uma versão atualizada do processo de redução térmica originalmente desenvolvido no Canadá nos anos 40 para impulsionar a produção durante a Segunda Guerra Mundial (o ‘Processo Pidgeon’).
(a) Processo de redução térmica
O minério de dolomita é triturado e aquecido em um forno para produzir uma mistura de óxidos de magnésio e cálcio, um processo conhecido como calcinação:

O próximo passo é a redução do óxido de magnésio. O agente redutor é o ferrosilício (uma liga de ferro e silício) que é feito pelo aquecimento de areia com coque e sucata de ferro, e normalmente contém cerca de 80% de silício.
Os óxidos são misturados com ferrosilício triturado, e feitos em briquetes para carregamento no reator. A alumina também pode ser adicionada para reduzir o ponto de fusão da escória. A reação é realizada a 1500 – 1800 K sob muito baixa pressão, próximo ao vácuo. Nestas condições o magnésio é produzido como um vapor que é condensado por resfriamento até cerca de 1100 K em condensadores revestidos de aço, e depois removido e fundido em lingotes:

A reação dianteira é endotérmica e a posição de equilíbrio é a favor do óxido de magnésio. No entanto, ao remover o vapor de magnésio à medida que este é produzido, a reacção vai até à sua conclusão. A sílica combina com óxido de cálcio para formar a escória fundida, silicato de cálcio:
O processo dá magnésio com até 99,99% de pureza, ligeiramente superior ao dos processos eletrolíticos.
(b) O processo eletrolítico
Fora da China, o processo eletrolítico é geralmente a escolha preferida.
O processo envolve duas etapas:
i) produção de cloreto de magnésio puro a partir da água do mar ou salmoura
ii) eletrólise de cloreto de magnésio fundido
(i) produção de cloreto de magnésio puro a partir da água do mar ou salmoura
Onde a água do mar é a matéria-prima, ela é tratada com dolomita que foi convertida em óxidos mistos através do aquecimento a uma temperatura elevada. O hidróxido de magnésio precipita-se, enquanto o hidróxido de cálcio permanece em solução. O hidróxido de magnésio é filtrado e no aquecimento forma rapidamente o óxido puro.
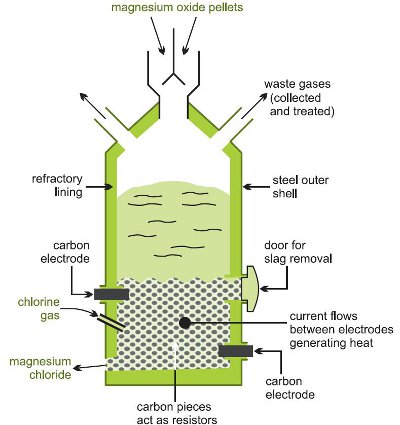
Conversão para cloreto de magnésio é obtida aquecendo o óxido, misturado com carbono, num fluxo de cloro a uma temperatura elevada num forno eléctrico (Figura 1).
Figure 1 Ilustrando a produção de cloreto de magnésio a partir do óxido de magnésio.
>
Reacções laterais ocorrem:
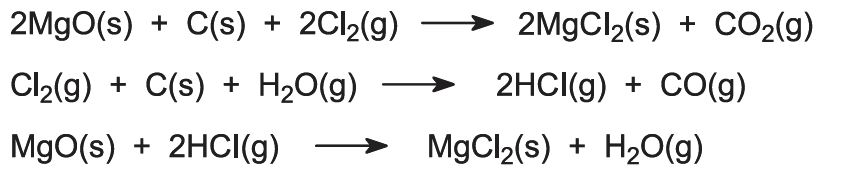
Quando as salmouras ricas em cloreto de magnésio são a fonte de magnésio, a solução é tratada para remoção de várias impurezas e a solução restante de cloreto de magnésio concentrada por evaporação em várias etapas.
O último estágio de desidratação deve ser realizado na presença de gás cloreto de hidrogênio para evitar a hidrólise do cloreto de magnésio:

Um novo processo está em desenvolvimento utilizando magnesita. Pequenos pedaços do minério são convertidos diretamente em cloreto de magnésio fundido por aquecimento com cloro em um forno elétrico na presença de monóxido de carbono.
>
(ii) A eletrólise do cloreto de magnésio fundido
O cloreto de magnésio anidro resultante é alimentado continuamente em células eletrolíticas (Figura 2) que estão quentes o suficiente para derretê-lo.
Na eletrólise, magnésio e cloro são produzidos:
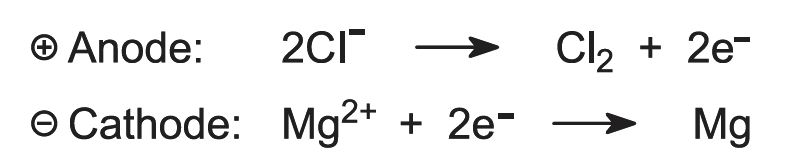
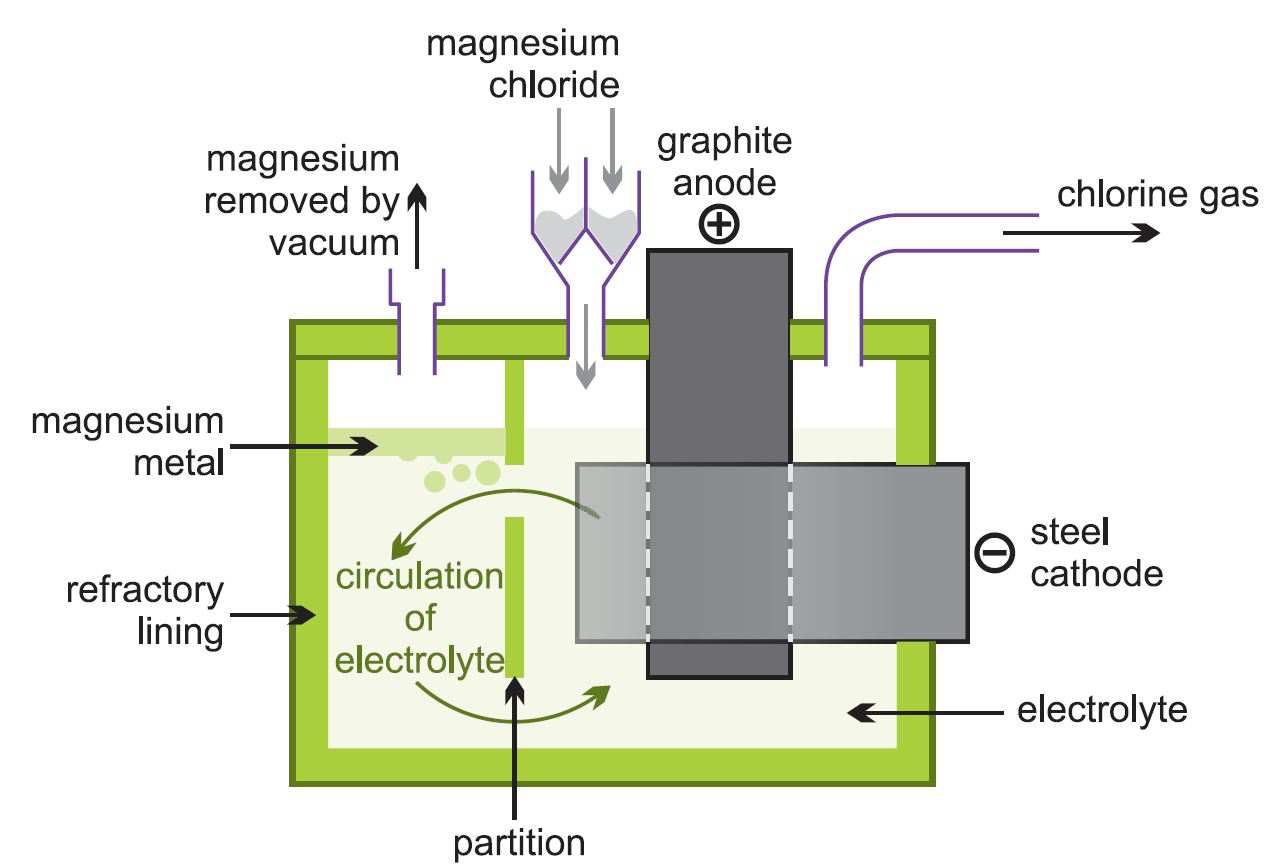
Figure 2 Ilustrando a eletrólise do cloreto de magnésio.
O metal fundido é removido e fundido em lingotes. O gás cloro é reciclado para o forno de cloração.
Produção secundária
Só cerca de 3% do total de magnésio utilizado anualmente é proveniente de reciclagem, uma estimativa de 23 000 toneladas.