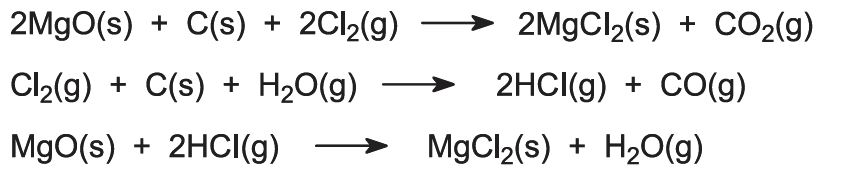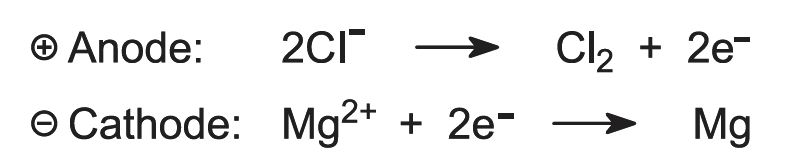Användningsområden för magnesium
Magnesium är den tredje mest använda metallen inom konstruktion (efter järn och aluminium).
Nästan 70 % av världsproduktionen av magnesium används för att tillverka legeringar, som har mycket låg densitet, jämförelsevis hög hållfasthet och utmärkt bearbetbarhet. Dessa legeringar innehåller ett eller flera av grundämnena aluminium, zink, mangan eller kisel i olika mängder, beroende på hur legeringen ska bearbetas.
Hälften av dessa legeringar används för att göra pressgjutgods med ca 90 % magnesium. Bilkomponenter som rattkärnor, växellådshöljen, instrumentbrädsstrukturer och kylarstöd tillverkas ofta av högtrycksgjutna magnesiumlegeringar.
Zirkonium och sällsynta jordartsmetaller tillsätts i vissa legeringar för att göra legeringen starkare. Denna grupp av legeringar sandgjuts normalt till delar som helikopterväxellådor och hjälpväxellådor för jetmotorer. Vissa högpresterande bilar tillverkas av en magnesiumlegering, liksom höljen till kameror.
En annan hälft av det magnesium som används i legeringar är som legeringstillsats inom aluminiumindustrin. Legeringarna används i förpackningar, särskilt i dryckesburkar och i folie för att skydda livsmedel.
De flesta dryckesburkar av metall som tillverkas i USA är tillverkade av aluminium legerat med cirka 5 % magnesium och en liten mängd andra grundämnen. I Europa och Asien innehåller metallburken cirka 50 % stål och 50 % aluminiumlegering med aluminiumlegering i toppen.
Magnesiumlegeringar används också som offeranoder. När magnesiumet kopplas samman med en mindre reaktiv metall blir det en anod i en elektrisk cell och korroderar i stället för den andra metallen. Detta används för att skydda stålfartygs skrov och undervattenskonstruktioner på oljeplattformar och rörledningar från korrosion.
En annan mycket viktig användning av magnesium är vid tillverkning av titan. Ungefär 10 % av världsproduktionen av magnesium används på detta sätt.
Ytterligare 10 % används vid tillverkning av högkvalitativt stål för konstruktioner, t.ex. stora byggnader och broar. Det tillsätts i smält tillstånd till smält järn för att avlägsna svavel genom kemisk reaktion, slaggen av magnesiumsulfid skummas bort.
En av de kanske mest kända men minsta användningarna av magnesium är i nödraketer, fyrverkerier och andra brandfarliga anordningar. De innehåller mycket små bitar magnesium som kan antändas.
Årlig produktion av magnesium
Dessa siffror gäller primärproduktion från malmen och omfattar inte sekundärproduktion från återvunnet material.
| Världen | 910 000 ton1 |
| Kina | 800 000 ton1 |
| USA. | 70 000 ton2 |
| Ryssland | 30 000 ton1 |
| Israel | 25 000 ton1 |
| Kazakstan | 20 000 ton1 |
Data från:
1 U.S. Geological Survey, Mineral Commodity Summaries, 2016.
2 Senaste tillgängliga siffra är 2012 (Minor Metals Trade Association, 2012)
1993 var mängden magnesium som producerades i Kina försumbar (ca 5 %), tjugo år senare tillverkar Kina nu nästan 90 % av världens magnesium. Även om landet har rika fyndigheter av lämpliga magnesiummalmer var det den snabba ekonomiska tillväxten som ledde till ökad efterfrågan i landet på produkter som använder magnesiumlegeringar. Detta ledde i sin tur till att fabriker stängdes i många länder. Tillverkningsprocesserna förbrukar mycket stora mängder energi och därför är produktionen i många länder oekonomisk. Magnesium produceras numera inte i Västeuropa.
Hantering av magnesium
Magnesium finns i lösning i havsvatten (ca 1,3 kg m-3 magnesium) och i naturliga saltlösningar. Det finns också i stor utsträckning i malmerna magnesit (MgCO3) och dolomit (MgCO3.CaCO3).
Magnesium framställs huvudsakligen genom två metoder:
a) termisk reduktion av magnesiumoxid
b) elektrolys av magnesiumklorid
Före utbyggnaden av produktionen i Kina var elektrolys den vanligaste produktionsmetoden i länder där elektrisk energi produceras relativt billigt. De flesta kinesiska anläggningar använder dock en uppdaterad version av den termiska reduktionsprocessen som ursprungligen utvecklades i Kanada på 1940-talet för att öka produktionen under andra världskriget (den s.k. Pidgeon-processen).
(a) Termisk reduktionsprocess
Dolomitmalm krossas och värms upp i en ugn för att producera en blandning av magnesium- och kalciumoxider, en process som kallas för kalcinering:
Nästföljande steg är reduktion av magnesiumoxiden. Reduktionsmedlet är ferrosilikon (en legering av järn och kisel) som tillverkas genom upphettning av sand med koks och järnskrot, och som vanligtvis innehåller cirka 80 % kisel.
Oxiderna blandas med krossat ferrosilikon och görs till briketter som lastas i reaktorn. Aluminiumoxid kan också tillsättas för att sänka slaggens smältpunkt. Reaktionen sker vid 1500 – 1800 K under mycket lågt tryck, nära vakuum. Under dessa förhållanden produceras magnesiumet som en ånga som kondenseras genom nedkylning till cirka 1100 K i stålklädda kondensatorer, och sedan avlägsnas och gjuts till göt:
Den framåtriktade reaktionen är endotermisk och jämviktsläget är till förmån för magnesiumoxid. Genom att avlägsna magnesiumångorna när de bildas fullbordas reaktionen. Kiseloxiden förenas med kalciumoxid och bildar den smälta slaggen, kalciumsilikat:
Processen ger magnesium med en renhet på upp till 99,99 %, vilket är något högre än från de elektrolytiska processerna.
(b) Den elektrolytiska processen
Utanför Kina är den elektrolytiska processen vanligen det bästa valet.
Processen omfattar två steg:
i) framställning av ren magnesiumklorid från havsvatten eller saltlake
ii) elektrolys av smält magnesiumklorid
(i) Framställning av ren magnesiumklorid från havsvatten eller saltlake
Om havsvatten är råmaterialet behandlas det med dolomit som genom upphettning till hög temperatur har omvandlats till blandoxider. Magnesiumhydroxid fälls ut, medan kalciumhydroxid förblir i lösning. Magnesiumhydroxid filtreras bort och bildar vid upphettning lätt den rena oxiden.
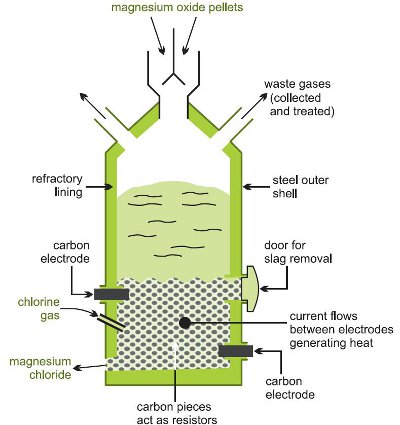
Omvandling till magnesiumklorid sker genom att oxiden, blandad med kol, upphettas i en ström av klor vid hög temperatur i en elektrisk ugn (figur 1).
Figur 1 som illustrerar framställningen av magnesiumklorid från magnesiumoxid.
Flera reaktioner sker:
Om magnesiumkloridrika saltvatten är källan till magnesium behandlas lösningen för att avlägsna olika föroreningar och den kvarvarande magnesiumkloridlösningen koncentreras genom avdunstning i flera steg.
Det sista steget av dehydrering måste utföras i närvaro av vätekloridgas för att undvika hydrolys av magnesiumkloriden:
En ny process håller på att utvecklas där magnesit används. Små bitar av malmen omvandlas direkt till smält magnesiumklorid genom upphettning med klor i en elektrisk ugn i närvaro av kolmonoxid.
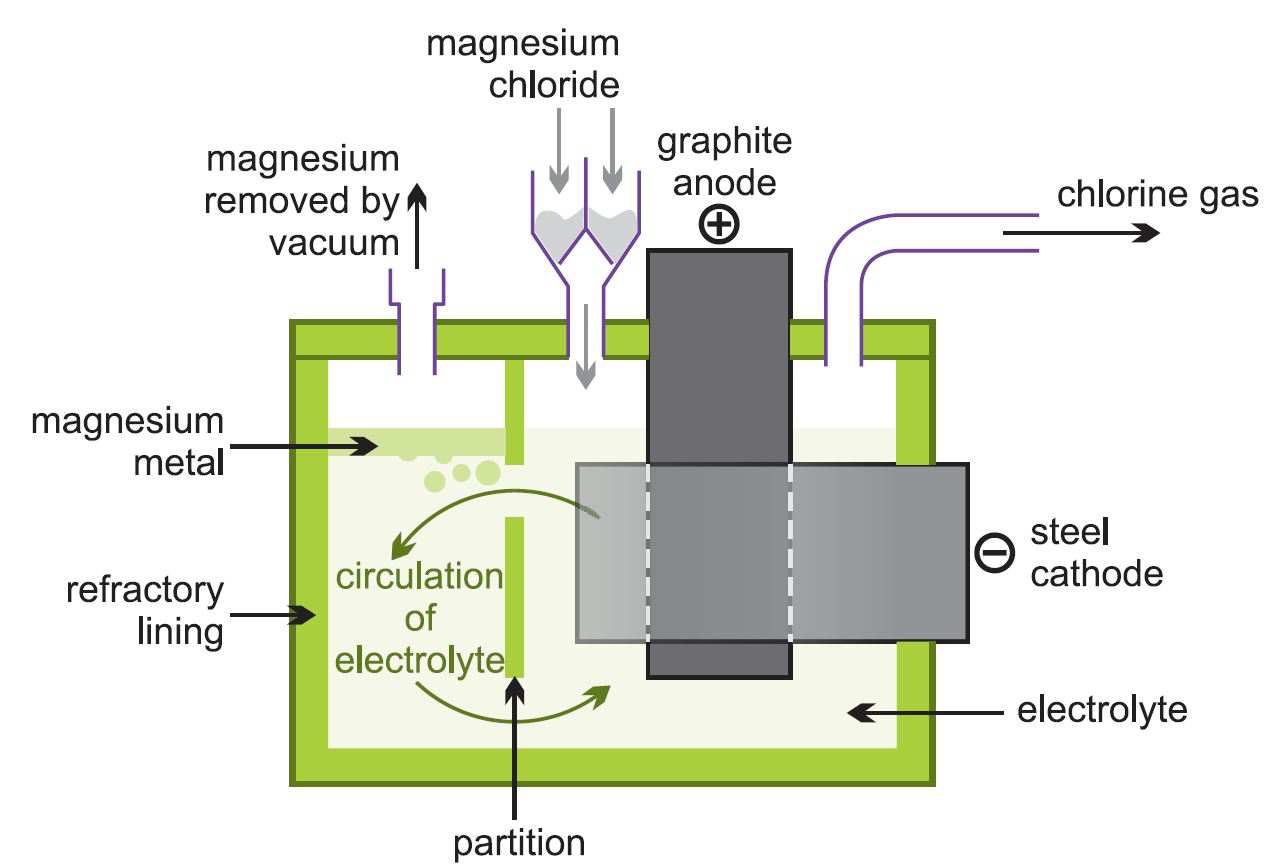
(ii) Elektrolys av smält magnesiumklorid
Den resulterande vattenfria magnesiumkloriden matas kontinuerligt in i elektrolytiska celler (figur 2) som är tillräckligt varma för att smälta den.
Vid elektrolys bildas magnesium och klor:
Figur 2 Illustration av elektrolys av magnesiumklorid.
Den smälta metallen avlägsnas och gjuts till göt. Klorgasen återvinns till klorineringsugnen.
Sekundär produktion
Bara 3 % av det totala magnesium som används årligen kommer från återvinning, uppskattningsvis 23 000 ton.