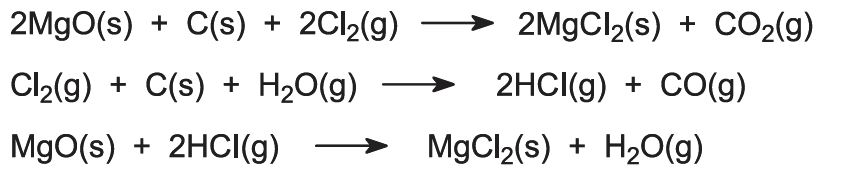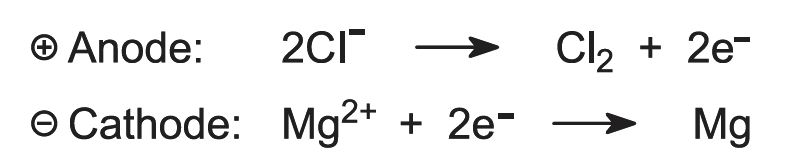Magnesiumin käyttötarkoitukset
Magnesium on kolmanneksi käytetyin metalli rakentamisessa (raudan ja alumiinin jälkeen).
Lähes 70 % magnesiumin maailman tuotannosta käytetään seosten valmistukseen, joiden tiheys on hyvin pieni, lujuus suhteellisen suuri ja työstettävyys erinomainen. Nämä seokset sisältävät yhtä tai useampaa alkuaineista alumiinia, sinkkiä, mangaania tai piitä eri määriä riippuen siitä, miten seosta on tarkoitus käsitellä.
Puolet näistä seoksista käytetään painevalujen valmistukseen, joissa on noin 90 % magnesiumia. Auton osat, kuten ohjauspyörän ytimet, vaihdelaatikon kotelot, kojelaudan rakenteet ja jäähdyttimen kannattimet, valmistetaan usein korkeapaineella painevaletuista magnesiumseoksista.
Zirkoniumia ja harvinaisten maametallien alkuaineita lisätään joihinkin seoksiin seoksen lujittamiseksi. Tätä seosryhmää valetaan tavallisesti hiekkavalamalla osiin, kuten helikopterien vaihdelaatikoihin ja suihkumoottoreiden lisävaihdelaatikoihin. Joitakin suorituskykyisiä autoja valmistetaan magnesiumseoksesta, samoin kameroiden koteloita.
Toinen puoli seoksissa käytetystä magnesiumista käytetään alumiiniteollisuudessa seosaineena. Seoksia käytetään pakkauksissa, erityisesti juomatölkeissä (juomatölkeissä) ja elintarvikkeiden suojaamiseen tarkoitetuissa folioissa.
Suuri osa Yhdysvalloissa valmistetuista metallisista juomatölkeistä valmistetaan alumiinista, johon on seostettu noin 5 % magnesiumia ja pieni määrä muita elementtejä. Euroopassa ja Aasiassa metallitölkki sisältää noin 50 % terästä ja 50 % alumiiniseosta, päällimmäisenä alumiiniseosta.
Magnesiumseoksia käytetään myös uhrausanodeina. Kun magnesium liitetään vähemmän reaktiiviseen metalliin, siitä tulee sähkökennon anodi, ja se syöpyy mieluummin kuin toinen metalli. Tätä käytetään suojaamaan teräslaivojen runkoja ja öljynporauslauttojen ja putkistojen vedenalaisia rakenteita korroosiolta.
Magnesiumin toinen erittäin tärkeä käyttötapa on titaanin valmistus. Noin 10 % maailman magnesiumin tuotannosta käytetään tähän tarkoitukseen.
Jälleen 10 % käytetään korkealaatuisen teräksen valmistukseen rakenteita, kuten suuria rakennuksia ja siltoja varten. Sitä lisätään sulassa tilassa sulaan rautaan rikin poistamiseksi kemiallisella reaktiolla, jolloin magnesiumsulfidista koostuva kuona kuoritaan pois.
Magnesiumin ehkä tunnetuimpia mutta vähäisimpiä käyttökohteita ovat hätäraketit, ilotulitteet ja muut sytytyslaitteet. Ne sisältävät hyvin pieniä magnesiumin palasia, jotka voidaan sytyttää.
Magnesiumin vuosituotanto
Nämä luvut koskevat primäärituotantoa malmista eivätkä sisällä sekundäärituotantoa kierrätysmateriaaleista.
| Maailma | 910 000 tonnia1 |
| Kiina | 800 000 tonnia1 |
| USA. | 70 000 tonnia2 |
| Venäjä | 30 000 tonnia1 |
| Israel | 25 000 tonnia1 |
| Kazakstan | 20 000 tonnia1 |
Data from:
1 U.S. Geological Survey, Mineral Commodity Summaries, 2016.
2 Viimeisin saatavilla oleva luku on vuodelta 2012 (Minor Metals Trade Association, 2012)
Vuonna 1993 Kiinassa tuotetun magnesiumin määrä oli mitätön (n. 5 %), kaksikymmentä vuotta myöhemmin Kiina valmistaa nyt lähes 90 % maailman magnesiumista. Vaikka maassa on runsaasti sopivia magnesiummalmiesiintymiä, nopea talouskasvu johti siihen, että maassa kasvoi magnesiumseoksia käyttävien tuotteiden kysyntä. Tämä puolestaan johti tehtaiden sulkemiseen monissa maissa. Valmistusprosessit kuluttavat hyvin paljon energiaa, ja tästä syystä tuotanto on monissa maissa epätaloudellista. Magnesiumia ei nykyään tuoteta Länsi-Euroopassa.
Magnesiumin valmistus
Magnesiumia on liuenneena merivedessä (noin 1,3 kg m-3 magnesiumia) ja luonnon suolavedessä. Sitä esiintyy myös runsaasti magnesiittimalmissa (MgCO3) ja dolomiitissa (MgCO3.CaCO3).
Magnesiumia valmistetaan pääasiassa kahdella menetelmällä:
a) magnesiumoksidin lämpöpelkistyksellä
b) magnesiumkloridin elektrolyysillä
Ennen tuotannon laajenemista Kiinassa elektrolyysi oli tavallisempi tuotantomenetelmä niissä maissa, joissa sähköenergiaa tuotetaan verrattain edullisesti. Useimmissa kiinalaisissa tehtaissa käytetään kuitenkin päivitettyä versiota lämpöreduktioprosessista, joka kehitettiin alun perin Kanadassa 1940-luvulla tuotannon lisäämiseksi toisen maailmansodan aikana (”Pidgeon-prosessi”).
(a) Lämpöreduktioprosessi
Dolomiittimalmi murskataan ja kuumennetaan uunissa magnesium- ja kalsiumoksidien seoksen tuottamiseksi, prosessia kutsutaan kalsinoinniksi:

Seuraavaksi pelkistetään magnesiittioksidi. Pelkistysaineena käytetään ferrosilikonia (raudan ja piin seos), jota valmistetaan kuumentamalla hiekkaa koksin ja rautaromun kanssa, ja se sisältää tyypillisesti noin 80 % piitä.
Oksidit sekoitetaan murskattuun ferrosilikonia, ja niistä valmistetaan brikettejä reaktoriin lastaamista varten. Myös alumiinioksidia voidaan lisätä kuonan sulamispisteen alentamiseksi. Reaktio suoritetaan 1500-1800 K:n lämpötilassa hyvin alhaisessa paineessa, lähellä tyhjiötä. Näissä olosuhteissa magnesium syntyy höyrynä, joka lauhdutetaan jäähdyttämällä noin 1100 K:n lämpötilaan teräsvuoratuissa lauhduttimissa, minkä jälkeen se poistetaan ja valetaan harkoiksi:
Eteenpäin suuntautuva reaktio on endoterminen, ja tasapainoasento on magnesiumoksidia suosiva. Poistamalla magnesiumhöyryä sitä mukaa kuin sitä syntyy, reaktio menee kuitenkin loppuun. Piidioksidi yhdistyy kalsiumoksidin kanssa muodostaen sulaa kuonaa, kalsiumsilikaattia:
Prosessista saadaan magnesiumia, jonka puhtaus on jopa 99,99 %, mikä on hieman korkeampi kuin elektrolyyttisissä prosesseissa.
b) Elektrolyyttinen prosessi
Kiinan ulkopuolella elektrolyyttistä prosessia suositaan yleensä.
Prosessissa on kaksi vaihetta:
i) puhtaan magnesiumkloridin valmistus merivedestä tai suolavedestä
ii) sulatetun magnesiumkloridin elektrolyysi
(i) Puhtaan magnesiumkloridin valmistus merivedestä tai suolavedestä
Mikäli raakaaineena on merivesi, se käsitellään dolomiitilla, joka on kuumennettaessa kuumentamalla korkeaan lämpötilaan muutettu sekoittuneiksi oksideiksi. Magnesiumhydroksidi saostuu, kun taas kalsiumhydroksidi jää liuokseen. Magnesiumhydroksidi suodatetaan pois, ja kuumentamalla se muodostaa helposti puhdasta oksidia.
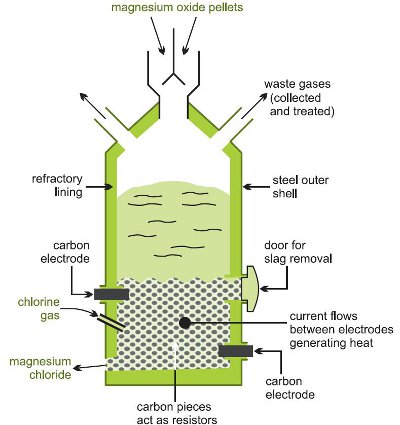
Muunnos magnesiumkloridiksi saadaan kuumentamalla hiilen kanssa sekoitettua oksidia kloorivirrassa korkeassa lämpötilassa sähköuunissa (kuva 1).
Kuva 1 Havainnollistaa magnesiumkloridin valmistusta magnesiumoksidista.
Tässä tapahtuu useita reaktioita:
Jos magnesiumkloridipitoinen suolavesi on magnesiumin lähde, liuos käsitellään erilaisten epäpuhtauksien poistamiseksi ja jäljelle jäävä magnesiumkloridiliuos väkevöidään haihduttamalla useassa vaiheessa.
Viimeinen vedenpoistovaihe on suoritettava vetykloridikaasun läsnä ollessa, jotta vältetään magnesiumkloridin hydrolyysi:
Uutta prosessia kehitetään parhaillaan magnesiitin avulla. Pienet palat malmia muutetaan suoraan sulaksi magnesiumkloridiksi kuumentamalla sitä kloorilla sähköuunissa hiilimonoksidin läsnäollessa.
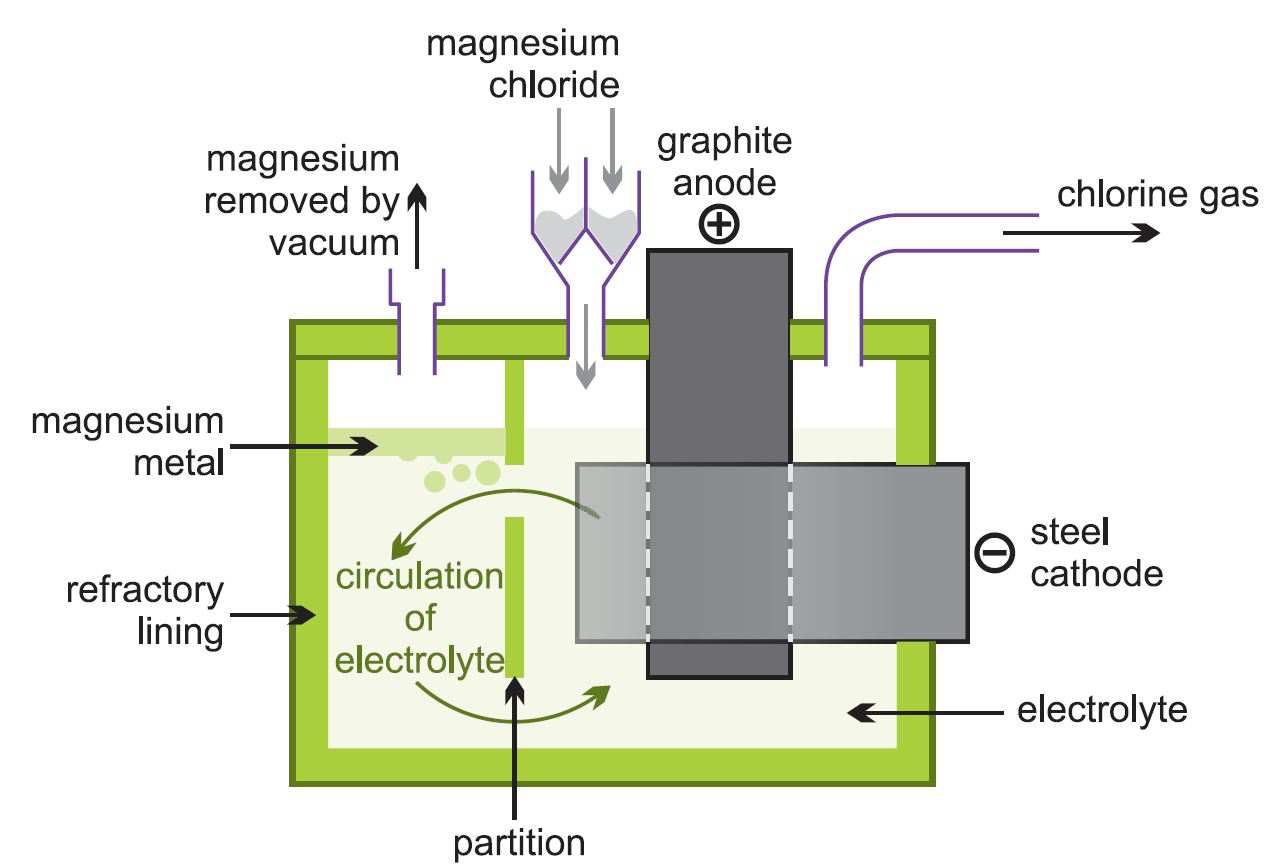
(ii) Sulatetun magnesiumkloridin elektrolyysi
Tuloksena syntyvä vedetön magnesiumkloridi johdetaan yhtäjaksoisesti sulatetun magnesiumkloridin sulattamiseen riittävän kuumiin elektrolyyttikennoihin (kuva 2).
Elektrolyysissä syntyy magnesiumia ja klooria:
Kuva 2 Havainnollistaa magnesiumkloridin elektrolyysiä.
Sula metalli poistetaan ja valetaan harkoiksi. Kloorikaasu kierrätetään kloorausuuniin.
Sekundäärituotanto
Vuosittain käytetystä magnesiumin kokonaismäärästä vain noin 3 %, arviolta 23 000 tonnia, on peräisin kierrätyksestä.