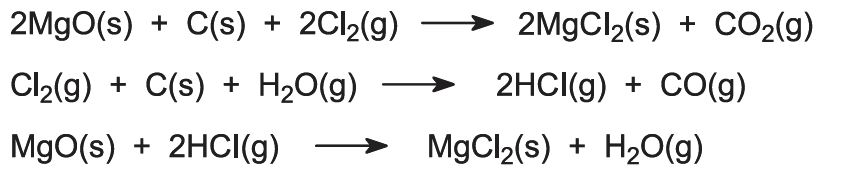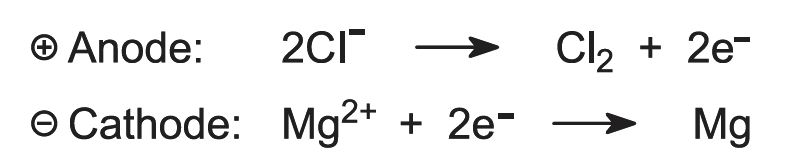Anvendelser af magnesium
Magnesium er det tredje mest anvendte metal inden for byggeri (efter jern og aluminium).
Næsten 70 % af verdensproduktionen af magnesium anvendes til at fremstille legeringer, som har en meget lav massefylde, forholdsvis høj styrke og fremragende bearbejdelighed. Disse legeringer indeholder et eller flere af grundstofferne aluminium, zink, mangan eller silicium i forskellige mængder, alt efter hvordan legeringen skal bearbejdes.
Halvdelen af disse legeringer anvendes til at fremstille trykstøbegods med ca. 90 % magnesium. Autokomponenter som f.eks. ratkerner, gearkassehuse, instrumentbrætstrukturer og radiatorstøtter fremstilles ofte af højtryksstøbte magnesiumlegeringer.
I nogle legeringer tilsættes zirconium og sjældne jordarter for at gøre legeringen stærkere. Denne gruppe af legeringer sandstøbes normalt til dele som helikoptergearkasser og hjælpegearkasser til jetmotorer. Nogle højtydende biler er fremstillet af en magnesiumlegering, og det samme gælder kamerahuse.
En anden halvdel af det magnesium, der anvendes i legeringer, er som legeringstilsætningsstof i aluminiumindustrien. Legeringerne anvendes i emballage, især i dåser til drikkevarer (drikkevarer) og i folie til beskyttelse af fødevarer.
De fleste metaldåser til drikkevarer, der fremstilles i USA, er fremstillet af aluminium legeret med ca. 5 % magnesium og en lille mængde af andre grundstoffer. I Europa og Asien indeholder metaldåsen ca. 50 % stål og 50 % aluminiumslegering, hvor den øverste del er aluminiumslegering.
Magnesiumlegeringer anvendes også som offeranoder. Når magnesium forbindes med et mindre reaktivt metal, bliver magnesiumet anoden i en elektrisk celle og korroderer i stedet for det andet metal. Dette bruges til at beskytte skrogene på stålskibe og undervandsstrukturen på olieplatforme og rørledninger mod korrosion.
En anden meget vigtig anvendelse af magnesium er ved fremstilling af titan. Omkring 10 % af verdensproduktionen af magnesium anvendes på denne måde.
Også 10 % anvendes til fremstilling af højkvalitetsstål til konstruktioner som f.eks. store bygninger og broer. Det tilsættes i smeltet tilstand til smeltet jern for at fjerne svovl ved kemisk reaktion, idet slaggen af magnesiumsulfid skummes af.
Men måske en af de mest kendte, men mindste anvendelser af magnesium er i nødblus, fyrværkeri og andre brandbomber. De indeholder meget små stykker magnesium, som kan antændes.
Årlig produktion af magnesium
Disse tal er for den primære produktion fra malmen og omfatter ikke sekundær produktion fra genbrugsmaterialer.
| Verden | 910 000 tons1 |
| Kina | 800 000 tons1 |
| U.S. | 70 000 tons2 |
| Rusland | 30 000 tons1 |
| Israel | 25 000 tons1 |
| Kasakhstan | 20 000 tons1 |
Data fra:
1 U.S. Geological Survey, Mineral Commodity Summaries, 2016.
2 Sidste tilgængelige tal er fra 2012 (Minor Metals Trade Association, 2012)
I 1993 var mængden af magnesium produceret i Kina ubetydelig (ca. 5 %), tyve år senere fremstiller Kina nu næsten 90 % af verdens magnesium. Selv om landet har rige forekomster af egnede magnesiummalme, var det den hurtige økonomiske vækst, der førte til en øget efterspørgsel i landet efter produkter, der anvender magnesiumlegeringer. Dette resulterede til gengæld i lukning af fabrikker i mange lande. Fremstillingsprocesserne bruger meget store mængder energi, og af denne grund er produktionen i mange lande ikke økonomisk rentabel. Magnesium produceres i dag ikke i Vesteuropa.
Fremstilling af magnesium
Magnesium findes i opløsning i havvand (ca. 1,3 kg m-3 magnesium) og i naturlige saltvandssalte. Det findes også i stort omfang i malmene magnesit (MgCO3) og dolomit (MgCO3.CaCO3).
Magnesium fremstilles hovedsageligt ved to metoder:
a) termisk reduktion af magnesiumoxid
b) elektrolyse af magnesiumchlorid
Forud for udvidelsen af produktionen i Kina var elektrolyse den mest almindelige produktionsmetode i lande, hvor elektrisk energi produceres relativt billigt. De fleste kinesiske anlæg anvender dog en opdateret version af den termiske reduktionsproces, der oprindeligt blev udviklet i Canada i 1940’erne for at øge produktionen under Anden Verdenskrig (den såkaldte Pidgeon-proces).
(a) Termisk reduktionsproces
Dolomitmalm knuses og opvarmes i en ovn for at fremstille en blanding af magnesium- og calciumoxider, en proces kendt som kalcinering:
Det næste trin er reduktion af magnesiumoxiden. Reduktionsmidlet er ferrosilicium (en legering af jern og silicium), som fremstilles ved opvarmning af sand med koks og jernskrot, og som typisk indeholder ca. 80 % silicium.
Oxiderne blandes med knust ferrosilicium og fremstilles til briketter til indlæsning i reaktoren. Der kan også tilsættes aluminiumoxid for at sænke slaggens smeltepunkt. Reaktionen foregår ved 1500 – 1800 K under meget lavt tryk, tæt på vakuum. Under disse betingelser dannes magnesiumet som en damp, der kondenseres ved afkøling til ca. 1100 K i stålforede kondensatorer og derefter fjernes og støbes til ingots:
Den fremadrettede reaktion er endotermisk, og ligevægtsstillingen er til fordel for magnesiumoxid. Men ved at fjerne magnesiumdampen, efterhånden som den dannes, fuldføres reaktionen. Silicaen kombineres med calciumoxid for at danne den smeltede slagge, calciumsilikat:
Processen giver magnesium med en renhed på op til 99,99 %, hvilket er lidt højere end fra de elektrolytiske processer.
(b) Den elektrolytiske proces
Uden for Kina er den elektrolytiske proces normalt det foretrukne valg.
Processen omfatter to trin:
i) fremstilling af rent magnesiumchlorid fra havvand eller saltvand
ii) elektrolyse af smeltet magnesiumchlorid
(i) Fremstilling af rent magnesiumchlorid fra havvand eller saltvand
Hvis havvand er råmaterialet, behandles det med dolomit, der er blevet omdannet til blandede oxider ved opvarmning til en høj temperatur. Magnesiumhydroxid udfælder sig, mens calciumhydroxid forbliver i opløsning. Magnesiumhydroxid filtreres fra og danner ved opvarmning let det rene oxid.
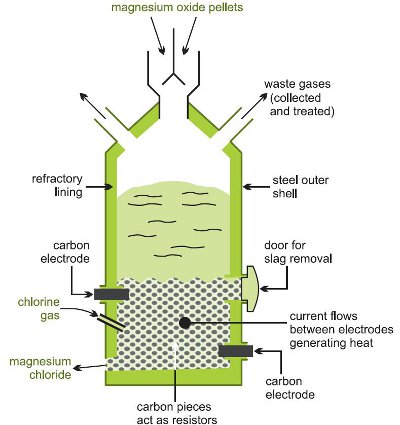
Overførsel til magnesiumchlorid sker ved at opvarme oxiden, blandet med kulstof, i en strøm af klor ved høj temperatur i en elektrisk ovn (figur 1).
Figur 1, der illustrerer fremstillingen af magnesiumchlorid fra magnesiumoxid.
Der sker flere reaktioner:
Hvis magnesiumkloridrige saltvand er kilden til magnesium, behandles opløsningen med henblik på fjernelse af forskellige urenheder, og den resterende magnesiumkloridopløsning koncentreres ved inddampning i flere trin.
Den sidste fase af dehydreringen skal udføres under tilstedeværelse af hydrogenchloridgas for at undgå hydrolyse af magnesiumchloridet:
En ny proces er under udvikling, hvor der anvendes magnesit. Små stykker af malmen omdannes direkte til smeltet magnesiumchlorid ved opvarmning med klor i en elektrisk ovn i nærværelse af kulilte.
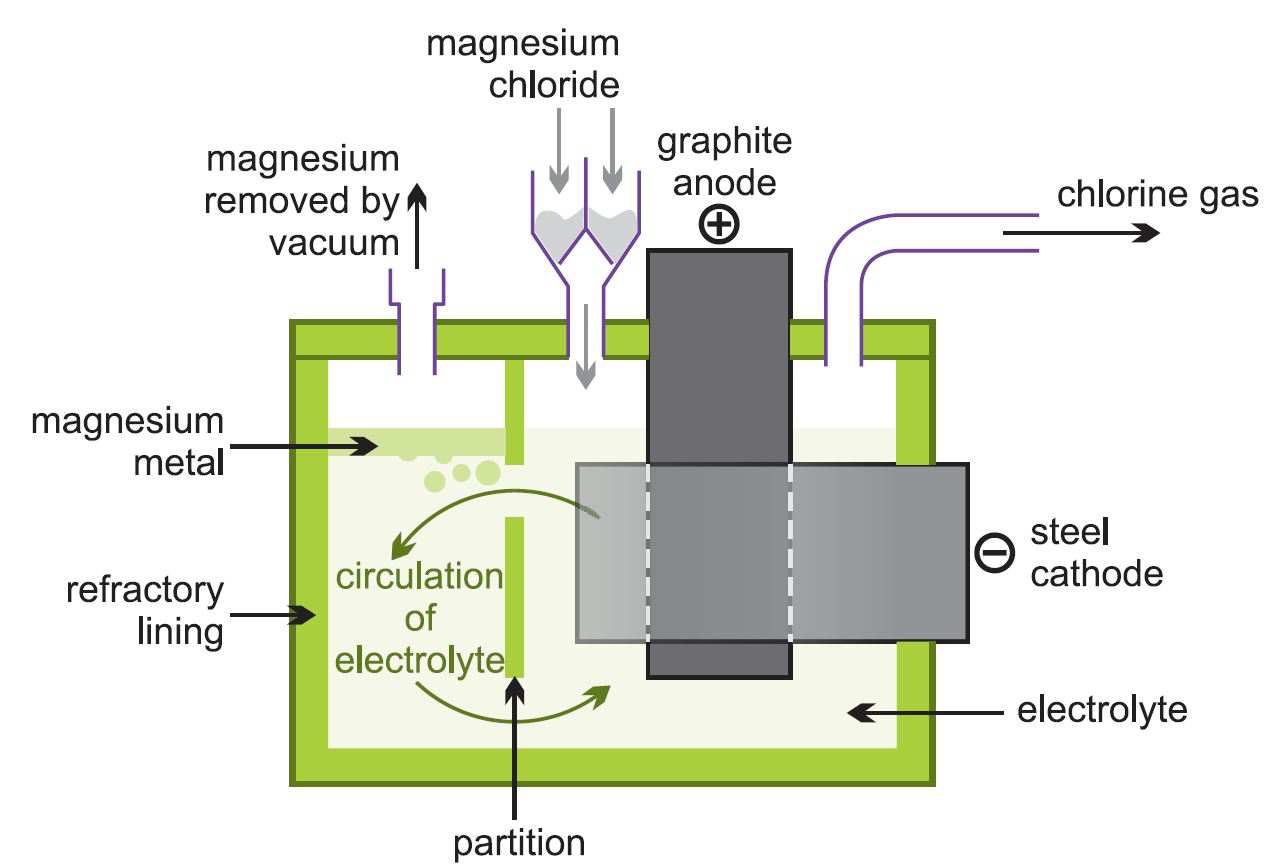
(ii) Elektrolyse af smeltet magnesiumchlorid
Det resulterende vandfri magnesiumchlorid føres kontinuerligt ind i elektrolyseceller (figur 2), som er varme nok til at smelte det.
Ved elektrolyse dannes der magnesium og klor:
Figur 2 Illustration af elektrolyse af magnesiumchlorid.
Det smeltede metal fjernes og støbes til barrer. Klorgassen genanvendes til kloriseringsovnen.
Sekundær produktion
Kun ca. 3 % af det samlede årlige forbrug af magnesium stammer fra genanvendelse, skønsmæssigt 23 000 tons.