Contexte
La langue est un organe vital hautement spécialisé de la cavité buccale. La résection d’une partie ou de la totalité de la langue présente un large éventail de défis qui exigent du chirurgien d’éviter, de limiter ou de restaurer les graves déficiences fonctionnelles de la gustation, de la mastication, de la déglutition et de la phonation.
Ce chapitre a pour but de passer en revue l’embryologie, l’anatomie et les malignités les plus courantes de la langue. Les auteurs abordent également l’évaluation clinique, les chirurgies et les reconstructions, l’évolution postopératoire et le pronostic des patients subissant une glossectomie.
Embryologie
La langue apparaît au cours de la quatrième semaine de développement avec l’apparition du tuberculum impar, une tuméfaction de mésenchyme dans le plancher du pharynx primitif cranial au foramen cecum. Les deux tiers antérieurs de la langue sont formés par les deux renflements latéraux (dérivés du premier arc pharyngien) qui se développent de part et d’autre du tuberculum impar. Ces bourgeons linguaux fusionnent entre eux et forment le sillon médian de la langue. Le tiers postérieur de la langue naît de l’excroissance de l’éminence hypobranchiale de la copule. La copule est formée par les parties ventromédiales du deuxième arc pharyngé et la partie crâniale du troisième arc pharyngé. L’éminence hypobranchiale est formée par les parties ventromédiales des troisième et quatrième arcs pharyngiens.
L’épithélium de la langue se développe à partir de l’endoderme de l’intestin antérieur. La plupart des muscles de la langue se développent à partir de myoblastes qui migrent à partir des myotomes occipitaux. Le tissu conjonctif, les vaisseaux lymphatiques et les vaisseaux sanguins de la langue proviennent du mésenchyme de l’arc pharyngé.
Histologie
La langue est tapissée d’un épithélium pavimenteux stratifié masticateur. L’ampleur des forces physiques durant la fonction dicte le degré de kératinisation épithéliale de la langue par rapport à d’autres zones de la cavité buccale.
Anatomie pertinente
Anatomie brute
D’antérieur à postérieur, la langue présente 3 surfaces : la pointe, le corps et la base. La pointe est la partie antérieure très mobile et pointue de la langue. En arrière de la pointe se trouve le corps de la langue, qui a des surfaces dorsales (supérieures) et ventrales (inférieures) (voir l’image ci-dessous).
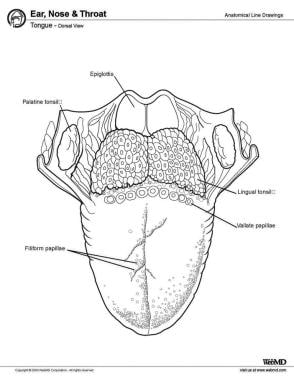 Langue, vue dorsale.
Langue, vue dorsale. Muscles
Les 8 muscles de la langue humaine sont classés comme intrinsèques ou extrinsèques. Les 4 muscles intrinsèques agissent pour modifier la forme de la langue et ne sont attachés à aucun os. Les 4 muscles extrinsèques agissent pour modifier la position de la langue et sont ancrés à un os. Ce sont le génioglosse, l’hyoglosse, le styloglosse, le palatoglosse.
Alimentation vasculaire
La langue reçoit son alimentation sanguine principalement de l’artère linguale, une branche de l’artère carotide externe. Le plancher de la bouche reçoit également son alimentation en sang de l’artère linguale. Le triangle formé par le tendon intermédiaire du muscle digastrique, le bord postérieur du muscle mylohyoïdien et le nerf hypoglosse est parfois appelé triangle de Pirogov-Belclard. L’apport sanguin secondaire de la langue provient de la branche amygdalienne de l’artère faciale et de l’artère pharyngée ascendante.
Apport nerveux
Le goût des deux tiers antérieurs de la langue est fourni par le nerf facial (chorda tympani, CN VII). La sensation générale des deux tiers antérieurs de la langue est fournie par le nerf lingual, qui est une branche du CN V3. Le nerf glossopharyngien (CN IX) assure la sensation générale du tiers postérieur de la langue. Tous les muscles intrinsèques et extrinsèques de la langue sont alimentés par le nerf hypoglosse (CN XII), sauf l’un des muscles extrinsèques, le palatoglosse, qui est innervé par le CN X du plexus pharyngien.
Pour plus d’informations sur l’anatomie concernée, voir Anatomie de la langue.
Physiologie de la déglutition
L’initiation de la déglutition commence par le confinement du bol alimentaire dans la cavité buccale. La langue librement mobile est alors capable d’entrer en contact avec le palais antérieur, de former le bolus et d’initier un mouvement postérieur de la base de la langue vers la paroi pharyngée, ce qui propulse le bolus alimentaire vers le fond de la gorge. L’élévation de l’hyoïde et du larynx permet l’ouverture du sphincter supérieur de l’œsophage et le bolus est passé.
Pathologie
Carcinome spinocellulaire (CSC)
Plus de 95% des cancers de la langue sont des carcinomes spinocellulaires (CSC). La prise en compte du traitement des autres tumeurs malignes moins fréquentes de la langue (adénocarcinome, carcinome adénoïde kystique) et des sarcomes (sarcome alvéolaire des parties molles) dépasse le cadre de ce chapitre. Les principes établis pour la glossectomie partielle et totale pour le CSC peuvent être généralement appliqués à d’autres malignités.
Le CSC de la langue se présente généralement dans la cinquième et la sixième décennie de la vie et est plus fréquent chez les hommes. Le tabagisme et l’abus d’éthanol sont fortement associés au développement du CCS de la langue, et les patients qui abusent à la fois du tabac et de l’éthanol ont un risque 6 fois à 15 fois plus élevé de développer un cancer.
Métastase des ganglions lymphatiques
La propagation lymphatique du CSC de la langue se produit généralement de manière ordonnée, impliquant d’abord les ganglions lymphatiques les plus élevés (niveaux I-II), puis moyens (niveaux II-III), et enfin les ganglions cervicaux inférieurs (niveau IV). Le drainage lymphatique de la langue comprend les bassins ganglionnaires jugulaire interne, sous-digastrique, omohyoïdien, sous-mandibulaire et sous-mental (niveaux I-III).
La voie antérieure draine la pointe de la langue orale et se draine principalement au niveau III. Le groupe latéral draine le tiers latéral du dos de la langue, de la pointe aux papilles circonvallées jusqu’aux bassins ganglionnaires sous-mandibulaire, et jugulaire interne et occasionnellement le bassin ganglionnaire sous-mental (niveaux I-III). La voie centrale draine les deux tiers centraux de la langue. Ces vaisseaux se drainent vers la région sous-mentale (niveau I) ou le bassin ganglionnaire de la chaîne cervicale supérieure via les ganglions sublinguaux (niveau III). Les lésions primaires de la langue qui s’approchent de la ligne médiane se drainent souvent vers des bassins ganglionnaires bilatéraux, car un croisement lymphatique important existe dans cette région.
Évaluation du patient
Les patients qui se présentent pour l’évaluation d’un cancer de la langue nécessitent une histoire détaillée et un examen physique approfondi. Le clinicien doit vérifier la présence et la durée des symptômes tels que la douleur, les saignements, l’otalgie, l’odynophagie, la dysphagie et la dysarthrie. L’anamnèse doit documenter les facteurs de risque tels que la consommation de tabac et d’alcool, les habitudes alimentaires récentes, la perte de poids, les comorbidités médicales et les antécédents familiaux de la maladie.
L’examen physique est effectué pour évaluer l’état du patient avant le traitement, y compris l’étendue de la tumeur primaire, la présence et la localisation des métastases des ganglions lymphatiques cervicaux, ainsi que le dépistage des tumeurs malignes primaires synchrones. Une laryngoscopie par fibre optique doit être réalisée au cabinet pour l’examen des voies respiratoires qui sont souvent compromises en cas de maladie avancée, ainsi que pour l’évaluation de l’atteinte laryngée.
La biopsie des lésions de la langue peut généralement être réalisée en milieu clinique sous anesthésie locale ou peut être réalisée sous anesthésie générale lors d’une panendoscopie formelle. Les masses palpables du cou ou les gros ganglions cervicaux métastatiques se prêtent généralement à une biopsie par aspiration à l’aiguille fine. La ponction à l’aiguille fine guidée par échographie est souvent utilisée pour obtenir un diagnostic lorsque la maladie cervicale présumée est difficile à localiser. On a constaté que la sensibilité et la spécificité de cette technique étaient supérieures à celles de la ponction à l’aiguille fine traditionnelle. La biopsie chirurgicale ouverte d’une maladie métastatique cervicale suspectée est généralement contre-indiquée.
Imagerie diagnostique
Tomographie par ordinateur
La tomographie par ordinateur (CT) avec contraste intraveineux est l’étude radiographique la plus couramment utilisée pour le cancer de la langue. La CT avec contraste permet une évaluation tridimensionnelle de la tumeur primaire donnant des informations inestimables concernant les structures anatomiques connexes et l’étendue de l’invasion locale. En général, les patients diagnostiqués avec un CSC avancé de la langue devraient également subir une CT de contraste du thorax pour évaluer la maladie métastatique pulmonaire.
La CT reste la modalité d’imagerie de choix lors de l’évaluation du cou cliniquement N0, obèse ou précédemment irradié pour la maladie métastatique cervicale.
L’imagerie par résonance magnétique
L’imagerie par résonance magnétique (IRM) offre une résolution supérieure des tissus mous par rapport à la TDM. L’augmentation de la précision diagnostique dans l’extension de la lésion primaire des tissus mous ainsi que l’amélioration de la précision pour la stadification des ganglions lymphatiques cervicaux ont incité certains auteurs à recommander une IRM de routine pour les tumeurs malignes de la tête et du cou. L’IRM est une excellente modalité d’imagerie, dont la précision est supérieure à celle du scanner conventionnel lorsqu’il s’agit d’évaluer l’étendue de l’invasion de la tumeur primaire. Les grandes lésions situées dans la langue et le plancher de la bouche qui sont sujettes à des artefacts tomographiques dentaires et osseux sont particulièrement adaptées à l’IRM. L’IRM est particulièrement utile dans les cas qui présentent une invasion périneurale et peut améliorer la précision liée à l’extension de la maladie dans ces lésions. Malgré cette précision accrue, comme dans le cas de la tomographie, l’IRM offre une précision insuffisante pour détecter les maladies micrométastatiques.
Tomographie par émission de positons
La tomographie par émission de positons (TEP) est une technique d’imagerie fonctionnelle qui utilise un traceur radiomarqué, le 18-fluoro-2-désoxyglucose (18-FDG), pour détecter les cellules métaboliquement actives, comme c’est le cas pour le cancer. La TEP présente une précision accrue (vrais positifs) pour la détection des tumeurs malignes de la tête et du cou, la surveillance des tumeurs après la thérapie et l’évaluation des maladies métastatiques cervicales/à distance.
Avec une lésion primaire connue au stade avancé, la TEP offre peu d’avantages par rapport à la CT ou à l’IRM. La TEP offre une résolution inférieure pour évaluer l’étendue de la lésion primaire et doit être associée à la TDM pour améliorer la précision du diagnostic. Actuellement, la limite de détection est corrélée à une résolution d’environ 5 mm. Bien que la TEP soit très prometteuse dans l’évaluation du cou N0 au stade précoce de la maladie, chez les patients atteints de cancers de la langue avancés, l’état du cou n’a qu’une signification pronostique.
Panendoscopie
La panendoscopie (laryngoscopie directe, œsophagoscopie, bronchoscopie) est fréquemment utile lors de l’évaluation des cancers de la langue. L’étendue de la tumeur primaire est évaluée, en particulier la relation de la tumeur avec la ligne médiane, la base de la langue et la mandibule. Des biopsies sont réalisées au moment de la panendoscopie si le diagnostic histologique n’a pas encore été établi. La panendoscopie est également utilisée pour écarter les tumeurs malignes synchrones.
Stadification du CCS de la langue
Tous les patients évalués pour une tumeur maligne de la tête et du cou doivent être stadifiés selon le système de stadification TNM de l’American Joint Committee on Cancer (AJCC) pour les lésions de la cavité buccale, comme indiqué ci-dessous.
Classification TNM de l’AJCC : SCCA de la cavité buccale
Tumeur primaire (T)
-
TX – La tumeur primaire ne peut pas être évaluée
-
T0 – Pas de preuve de tumeur primaire. Aucune preuve de tumeur primaire
-
Tis – Carcinome in situ
-
T1 – Tumeur de 2 cm ou moins dans sa plus grande dimension
-
T2 – Tumeur de plus de 2 cm mais pas plus de 4 cm dans sa plus grande dimension
-
T3 – Tumeur de plus de 4 cm dans sa plus grande dimension
-
T4 (lèvre) – La tumeur envahit l’os cortical, le nerf alvéolaire inférieur, le plancher de la bouche, ou la peau du visage, c’est-à-dire le menton ou le nez
-
T4a (cavité buccale) – La tumeur envahit l’os cortical, dans le muscle profond (extrinsèque) de la langue (génioglosse, hyoglosse, palatoglosse, et styloglosse) le sinus maxillaire, ou la peau de la face
-
T4b – La tumeur implique l’espace des masticateurs, les plaques ptérygoïdes, ou la base du crâne et/ou englobe l’artère carotide interne
Ganglions lymphatiques régionaux (N)
-
NX – Les ganglions lymphatiques régionaux ne peuvent être évalués
-
N0 – Pas de métastase ganglionnaire régionale
-
N1 – Métastase dans un seul ganglion lymphatique ipsilatéral, 3 cm ou moins dans sa plus grande dimension
-
N2 – Métastase dans un seul ganglion lymphatique ipsilatéral, plus de 3 cm mais pas plus de 6 cm dans sa plus grande dimension ; ou dans des ganglions lymphatiques bilatéraux ou controlatéraux, aucun ne dépassant 6 cm dans sa plus grande dimension
-
N2a – Métastase dans un seul ganglion lymphatique ipsilatéral de plus de 3 cm mais ne dépassant pas 6 cm dans sa plus grande dimension
-
N2b – Métastase dans plusieurs ganglions lymphatiques ipsilatéraux, aucun ne dépasse 6 cm dans sa plus grande dimension
-
N2c – Métastase dans des ganglions lymphatiques bilatéraux ou controlatéraux, aucune ne dépasse 6cm dans sa plus grande dimension
-
N3 – Métastase dans un ganglion lymphatique de plus de 6cm dans sa plus grande dimension
Métastase distante (M)
-
MX – Métastase distante non évaluable
-
M0 – Pas de métastase distante
-
M1 – Métastase distante
Système de stadification de l’AJCC : SCCA de la cavité buccale
Groupement des stades
Facteurs affectant le pronostic
Épaisseur tumorale
En général, l’augmentation de la taille et de l’épaisseur de la tumeur est significativement prédictive d’une diminution de la survie et augmente le taux de récidive locorégionale. La mesure de l’épaisseur de la tumeur et du schéma d’invasion chez les patients présentant un cancer buccal précoce peut permettre d’identifier les patients présentant une maladie plus agressive. Les patients dont le diamètre de la tumeur est supérieur à 1,5 cm ou dont l’épaisseur de la tumeur est supérieure à 5 mm peuvent alors être envisagés pour un traitement adjuvant plus agressif et une dissection élective du cou, quel que soit le stade, en raison du risque accru de métastases ganglionnaires cervicales.
L’IRM est suffisamment précise pour déterminer l’épaisseur tumorale des CSC de la cavité buccale, bien que l’évaluation histologique reste la norme. Bien que l’épaisseur de la tumeur prédise de manière fiable les métastases ganglionnaires régionales et la diminution de la survie, les stratégies de traitement spécifiques basées sur l’épaisseur de la tumeur n’ont pas encore été évaluées en raison du large éventail de facteurs liés au pronostic chez les patients atteints de CSC de la cavité buccale. Dans le cas du SCC de la cavité buccale à un stade avancé (stades III, IV), l’épaisseur de la tumeur n’est généralement pas un facteur à prendre en compte dans la planification du traitement, car la profondeur dépasse habituellement 5 mm et les patients reçoivent généralement une chirurgie agressive avec une chimioradiothérapie néoadjuvante et/ou adjuvante.
Invasion périneurale
L’invasion périneurale a été associée à un risque accru de récidive locale et de métastases cervicales et est généralement considérée comme un facteur prédictif indépendant de survie pour les patients atteints de CSC de la cavité buccale. La présence d’une atteinte nerveuse périphérique, même minime, a été associée à une diminution de la survie. Si cela est confirmé pathologiquement, cela devrait inciter à envisager fortement un cours complet de radiothérapie postopératoire pour traiter la tumeur primaire, car les résultats liés à la récidive locorégionale sont mauvais.
Marges chirurgicales positives
La tumeur résiduelle microscopique résultant de marges chirurgicales positives augmente statistiquement la récidive locale et la mortalité lors du traitement du CSC de la tête et du cou. Les patients traités par chirurgie comme modalité primaire présentent des taux de contrôle local significativement améliorés si une marge chirurgicale négative est obtenue. Les chirurgiens qui effectuent des résections pour un CSC primaire avancé de la cavité buccale doivent s’efforcer d’obtenir une marge d’au moins 1 cm, avec une préférence pour les marges de 2-3 cm, afin de minimiser la probabilité de marges positives. Les marges chirurgicales positives, que ce soit au niveau du site primaire ou dans le cou après dissection du cou, nécessitent l’utilisation d’une radiothérapie postopératoire pour améliorer les résultats. Il a été rapporté que la survie sans maladie à deux ans s’améliore de 33,6 % à 75,6 % chez les patients présentant des marges chirurgicales positives et ayant reçu une radiothérapie postopératoire (≥62,5 Gy).
Métastases cervicales
La présence de métastases des ganglions lymphatiques cervicaux a été citée à plusieurs reprises comme le facteur le plus significatif qui présage une diminution de la survie et une récidive locorégionale dans les CSC de la langue. En outre, les métastases des ganglions lymphatiques cervicaux situés à des niveaux plus éloignés du cou (niveaux III/IV), ou dans le cou controlatéral, ont également tendance à avoir des taux de survie significativement réduits. Les taux de survie globaux à 5 ans, lorsqu’on compare les patients sans signe de métastase des ganglions cervicaux à ceux qui présentent une maladie ganglionnaire positive, sont respectivement de 42,8 % et 17,5 %. Les patients qui présentent un CSC de la cavité buccale à un stade avancé présentent généralement des métastases ganglionnaires par définition. La présence de métastases ganglionnaires cervicales doit être considérée comme un signe de mauvais augure et doit inciter à un traitement précoce et agressif afin d’optimiser les résultats.
Extraction extracapsulaire
Les métastases ganglionnaires cervicales qui présentent une extension extracapsulaire ont une survie globale statistiquement diminuée. La présence d’une extension extracapsulaire ganglionnaire est également préoccupante pour la récidive cervicale après traitement. Les CCS de la langue à un stade avancé peuvent présenter une maladie ganglionnaire cervicale étendue qui augmente la probabilité d’une extension extracapsulaire. Les patients dont les multiples ganglions lymphatiques présentent une extension extracapsulaire ont généralement un pronostic extrêmement mauvais.
Facteurs de décision dans la planification du traitement
Épaisseur tumorale
En général, l’augmentation de la taille et de l’épaisseur de la tumeur est significativement prédictive d’une diminution de la survie et augmente le taux de récidive locorégionale. La mesure de l’épaisseur de la tumeur et du schéma d’invasion chez les patients présentant un cancer buccal précoce peut permettre d’identifier les patients présentant une maladie plus agressive. Les patients dont le diamètre de la tumeur est supérieur à 1,5 cm ou dont l’épaisseur de la tumeur est supérieure à 5 mm peuvent alors être envisagés pour un traitement adjuvant plus agressif et une dissection élective du cou, quel que soit le stade, en raison du risque accru de métastases ganglionnaires cervicales.
L’IRM est suffisamment précise pour déterminer l’épaisseur tumorale des CSC de la cavité buccale, bien que l’évaluation histologique reste la norme. Bien que l’épaisseur de la tumeur prédise de manière fiable les métastases ganglionnaires régionales et la diminution de la survie, des stratégies de traitement spécifiques basées sur l’épaisseur de la tumeur n’ont pas encore été évaluées en raison du large éventail de facteurs liés au pronostic parmi les patients atteints de CSC de la cavité buccale. Dans le cas du SCC de la cavité buccale à un stade avancé (stades III, IV), l’épaisseur de la tumeur n’est généralement pas une considération dans la planification du traitement, car la profondeur dépasse habituellement 5 mm et les patients reçoivent généralement une chirurgie agressive avec une chimioradiothérapie néoadjuvante et/ou adjuvante.
Invasion périneurale
L’invasion périneurale a été associée à un risque accru de récidive locale et de métastases cervicales et est généralement considérée comme un facteur prédictif indépendant de la survie des patients atteints de CSC de la cavité buccale. La présence d’une atteinte nerveuse périphérique, même minime, a été associée à une diminution de la survie. Si cela est confirmé pathologiquement, cela devrait inciter à envisager fortement un cours complet de radiothérapie postopératoire pour traiter la tumeur primaire, car les résultats liés à la récidive locorégionale sont mauvais.
Marges chirurgicales positives
La tumeur résiduelle microscopique résultant de marges chirurgicales positives augmente statistiquement la récidive locale et la mortalité lors du traitement du CSC de la tête et du cou. Les patients traités par chirurgie comme modalité primaire présentent des taux de contrôle local significativement améliorés si une marge chirurgicale négative est obtenue. Les chirurgiens qui effectuent des résections pour un CSC primaire avancé de la cavité buccale doivent s’efforcer d’obtenir une marge d’au moins 1 cm, avec une préférence pour les marges de 2 à 3 cm, afin de minimiser la probabilité de marges positives. Les marges chirurgicales positives, que ce soit au niveau du site primaire ou dans le cou après dissection du cou, nécessitent l’utilisation d’une radiothérapie postopératoire pour améliorer les résultats. Il a été rapporté que la survie sans maladie à deux ans s’améliore de 33,6 % à 75,6 % chez les patients présentant des marges chirurgicales positives et ayant reçu une radiothérapie postopératoire (≥62,5 Gy).
Métastases cervicales
La présence de métastases des ganglions lymphatiques cervicaux a été citée à plusieurs reprises comme le facteur le plus significatif qui présage une diminution de la survie et une récidive locorégionale dans les CSC de la langue. En outre, les métastases des ganglions lymphatiques cervicaux situés à des niveaux plus éloignés du cou (niveaux III/IV), ou dans le cou controlatéral, ont également tendance à avoir des taux de survie significativement réduits. Les taux de survie globaux à 5 ans, lorsqu’on compare les patients sans signe de métastase des ganglions cervicaux à ceux qui présentent une maladie ganglionnaire positive, sont respectivement de 42,8 % et 17,5 %. Les patients qui présentent un CSC de la cavité buccale à un stade avancé présentent généralement des métastases ganglionnaires par définition. La présence de métastases ganglionnaires cervicales doit être considérée comme un signe de mauvais augure et doit inciter à un traitement précoce et agressif afin d’optimiser les résultats.
Extraction extracapsulaire
Les métastases ganglionnaires cervicales qui présentent une extension extracapsulaire ont une survie globale statistiquement diminuée. La présence d’une extension extracapsulaire ganglionnaire est également préoccupante pour la récidive cervicale après traitement. Les CCS de la langue à un stade avancé peuvent présenter une maladie ganglionnaire cervicale étendue, ce qui augmente la probabilité d’une extension extracapsulaire. Les patients dont les multiples ganglions lymphatiques présentent une extension extracapsulaire ont généralement un pronostic extrêmement mauvais.