A XeF4 vagy Xenon-tetrafluorid egy kémiai vegyület, amely xenon és fluorid atomokból áll. Ez a világ első felfedezett bináris vegyülete. A nemesgázok egyik fajtája, melynek kémiai egyenlete
Xe +2 F2 -> XeF4
A XeF4 szilárd fehér megjelenésű, sűrűsége szilárd állapotban 4,040 g cm-3 . Hétköznapi körülmények között színtelen kristályosnak tűnik. Fenséges hőmérséklete 115,7 Celsius-fok vagy 240,26 Fahrenheit-fok. A többi xenon-fluoridhoz hasonlóan a xenon-tetrafluorid is exergonikus képződésű. Normál hőmérsékleten és nyomáson stabil állapotban marad. Vízzel azonnal reakcióba lép, és molekuláris oxigént, hidrogén-fluoridot és tiszta xenongázt szabadít fel.
| A molekula neve | Xenon-tetrafluorid (XeF4) |
| Valencia száma Elektronok száma a molekulában | 36 |
| A XeF4 hibridizációja | sp3d2 hibridizáció |
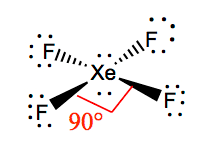
| Kötésszögek | 90 fok és 180 fok |
| A XeF4 molekuláris geometriája | négyzetes sík |
Fizikai és kémiai tulajdonságainak megismerése, ismernünk kell Lewis szerkezetét és molekuláris geometriáját. Ismerjük meg a Xenon-tetrafluorid Lewis-szerkezetét.
A Lewis-szerkezet elkészítéséhez ismernünk kell a XeF4 valenciaelektronjait, hogy elkészíthessük a szerkezetét, és tudnunk kell az atomok elhelyezkedését a molekulában.
Tartalom
XeF4 Valenciaelektronok
Ebben a molekulában egy xenon- és négy fluoratom van. Mindkét atom valenciaelektronjait kiszámítjuk, hogy meghatározzuk a XeF4 összes valenciaelektronjának számát.
A xenon valenciaelektronjai = 8
Fluor valenciaelektronjai = 7*4 ( mivel négy fluoratom van, megszorozzuk 4-gyel)
A Xef4 összes valenciaelektronjainak száma: 8 + 7*4
: 8 + 28
: 36
A XeF4-ben tehát összesen 36 valenciaelektron van.
XeF4 Lewis-szerkezete
Most, hogy ismerjük a xenon-tetrafluorid valenciaelektronjait, könnyebb lesz lerajzolni a Lewis-szerkezetét. Ez a Lewis pontszerkezet a molekula egyes atomjai körüli valenciaelektronok képi ábrázolása a molekulában kialakuló kötéssel együtt.
A kötéseket a szerkezetben vonalakkal, míg a kötésképzésben részt nem vevő elektronokat pontokként ábrázoljuk. Azokat az elektronokat, amelyek nem alkotnak kötést, nem kötő elektronoknak vagy magányos elektronpároknak nevezzük.
Mivel a xenon a legkevésbé elektronegatív atom, ezért azt helyezzük középre, a többi fluoratomot pedig köréje, így:

Most, hogy az összes atomot elhelyeztük, mutassuk meg az egyes fluor- és xenonatomok közötti kötéseket. A molekulában minden kötés két elektront vesz fel, és mivel ebben a molekulában négy egyszerű kötés van, a 36-ból 8 elektron van felhasználva.
Kezdjük el a többi valenciaelektron elhelyezését az atomok körül. Minden fluoratom körül hat valenciaelektron lesz, mivel egy elektron felhasználásra került a kötés kialakításához.
Láthatjuk, hogy a 28 elektronból már 24-et elhelyeztünk a fluoratomok körül. A fennmaradó nem kötő elektronokat vagy magányos elektronpárokat a Xenonra fogjuk helyezni, mivel ez kivétel a nyolcas szabály alól.
Tegyük ezt a két nem kötődő elektronpárt a Xenonra, és már meg is van a Lewis szerkezetünk, ahol két magányos elektronpár van a Xenonon és hat nem kötődő elektron minden egyes fluoratomon.
XeF4 hibridizáció
A központi Xenon atom pályái hibridizálódnak, ami új hibridizált pályák kialakulását eredményezi. A xenonnak hat elektronja van az 5p pályákon és két elektronja az 5s pályákon. A xenon alapállapotában nincsenek elektronok a d- és f-orbitálisokban. Amikor azonban ez az atom gerjesztett állapotban van, a p-orbitálisokban lévő két elektron átkerül a d-orbitálisokba; ennek eredményeként összesen négy párosítatlan elektron van. Ebből kettő a p-orbitálisokban, a másik két párosítatlan elektron pedig a d-orbitálisokban van. Ezek a hibridizált pályák sp3d2 hibridizációhoz vezetnek a XeF4-ben.
XeF4 molekuláris geometria
Egy adott molekula molekuláris geometriáját könnyebb megérteni, ha ismerjük a Lewis szerkezetét. Mivel a xenon két magányos elektronpárral rendelkezik, olyan szerkezetet vesz fel, amely segít ezeknek a magányos pároknak elkerülni a taszítóerőket. Annak érdekében, hogy ezek a taszítóerők minimálisak legyenek, a magányos párok egymásra merőleges síkban helyezkednek el. És mivel négy fluoratom van, a molekula olyan elrendezésű lesz, hogy a molekulageometriája négyzetes síkú. A XeF4 elektrongeometriája oktaéderes, így a xenon-tetrafluorid molekuláris geometriája négyzetes síkú.

XeF4 Kötésszögek
A F-Xe-F kötésszögei 90 fokosak, a magányos párok szögei pedig 180 fokosak. A fluoratomok 90 fokban helyezkednek el egymáshoz képest, ami az elektronok szimmetrikus eloszlását eredményezi a molekula síkjában. Ezek a kötésszögek hozzájárulnak a négyzetes síkú molekulageometria kialakulásához.
XeF4 polaritás – A XeF4 poláris vagy nem poláris?
Bár a xenon- és fluoratomok közötti kötések polárisak, a XeF4 nem poláris molekula. Kíváncsi vagy hogyan? Az összes Xe-F kötés egymással szemben áll kölcsönösen, így a dipólusmomentum összege nulla. Mivel a xenonatomon négy elektron van, amelyek nem kötő elektronpárokként lokalizálódnak. Mivel a molekulában az atomok és az elektronok általános elrendeződése olyan, hogy a dipólusok vektori összege nulla, a XeF4 egy nem poláris molekula.
Következtető megjegyzések
A xenon-tetrafluorid egyike azoknak a molekuláknak, amelyeket viszonylag könnyű megérteni. Lewis-szerkezete az egyik legkevésbé bonyolult szerkezet, mivel az összes fluoratom szimmetrikusan helyezkedik el. A molekulában a magányos párok a molekulára merőleges síkban, oktaéder alakban helyezkednek el, hogy taszító erejüket minimálisra csökkentsék.
Ezzel a blogbejegyzéssel összefoglalva elmondhatjuk, hogy a XeF4-nek 36 valenciaelektronja van. A Xenon központi atomján két magányos, nem kötő elektronpárral rendelkezik. A molekula oktaéderes elektrongeometriával és négyzetes síkú molekulageometriával rendelkezik. A XeF4 nem poláris molekula és sp3d2 hibridizációval rendelkezik.