Tartalom
- 1 Funkció
- 2 Mechanizmus a szál-transfer inhibition actio
- 3 HIV és AIDS
- 4 A szerkezet hatása
- 5 PFV intaszóma kristályosítás
- 5.1 Kristályosítási technika
- 5.2 Kristallográfiai és finomítási statisztikák
- 6 Általános felépítés & Összetevők
- 6.1 Szerkezet
- 6.2 Integráz és DNS kölcsönhatások
- 6.3 Aktív hely
- 7 Integráz gátlók
- 7.1 További források
- 8 A retrovírus integráz 3D szerkezetei
Funkció
A retrovírus integráz egy esszenciális retrovírus enzim, amely kötődik a vírus DNS-hez és beilleszti azt a gazdasejt kromoszómájába. Az 1-es típusú humán immundeficiencia vírus (HIV-1) reverz transzkriptált cDNS-ét illeszti be a gazdasejt genomjába a kórokozó fitneszének és virulenciájának növelése érdekében. Az integrázt a retrovírusok egy osztálya termeli (mint a HIV), és a vírus arra használja, hogy genetikai anyagát beépítse a gazdasejt DNS-ébe. A gazdasejt gépezete ezután a beépült genetikai anyagból mRNS-t, majd fehérjét állít elő, így szaporítva a vírust. Bár számos integráz-gátló gyógyszert vizsgáltak, a szálátvitel-gátló hatásért felelős mechanizmust még nem sikerült feltárni. Hare el al (2010) azonban meghatározta a retrovírusos integráció szerkezeti összetevőit. A retrovírus integráz teljes szerkezetének további tisztázása és annak alkalmazása a funkcionális és enzimatikus tevékenységek szabályozására potenciálisan lehetővé teheti a kutatók számára, hogy késleltessék a retrovírusos betegségek progresszióját. Ezenkívül a HIV-1 integráció tanulmányozása egy ígéretes új célponthoz vezethet, és hozzájárulhat a vírusellenes terápia farmakofór modelljeinek létrehozásához.
HIV Integráz inhibitorok: Az Isentress néven forgalmazott raltegravir jelenleg a HIV-integráz terápiás gátlójaként engedélyezett. Engedélyezése 2007. október 12-én történt. fágintegrázzal kapcsolatban lásd: Fágintegráz.
A szálátviteli gátló actio
Caption
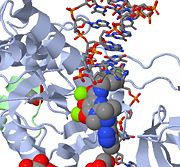
Fentebb egy JMOL-kép az MK-0518-ról, amely blokkolja a vírus-DNS 3′ végének az aktív centrumhoz való kötődését. Vegyük észre az MK-0518 fémkelátképző oxigénatomjait, amelyek kölcsönhatásba lépnek az aktív centrumban található magnéziumkationokkal.
A HIV 1-es típusú integráz egy viszonylag új és újszerű célpontja az inhibitoroknak. Az FDA 2007-ben engedélyezte az első HIV-1 integrázgátlót, a raltegravirt HIV-1 kombinációs terápiaként történő alkalmazására . A strang-transzfer gátlók úgy hatnak, hogy megakadályozzák a vírus DNS-ének összehangolt integrációját a gazdaszervezet kromoszómájába. A vírusnak a gazdasejtbe való belépése után a reverz transzkriptáz a vírus ssRNS-ét dsDNS-é alakítja át. Ezen a ponton az integráz komplexet képez a vírus-DNS-szel, létrehozva a preintegrációs komplexet (intaszóma). A preintegrációs komplex ezután a sejtmagba chaperonizálódik, ahol két nukleotidot kivágnak a 3′ végéből. Ezután a DNS kovalensen integrálódik a gazdaszervezet DNS-ébe. A szálátviteli inhibitorok megszakítják ezt a folyamatot, megakadályozva a vírus-DNS integrálódását a gazdakromoszómába. A strang-transzfer gátlók a retrovírus integráz aktív helyén található fémion kofaktorok bevonásával fejtik ki hatásukat. Az inhibitorokban található fémkelátképző oxigénatomok közvetlenül a fémkofaktorokkal lépnek kölcsönhatásba, míg a halobenzilcsoport az aktív centrumban az elmozdult 3′ vírus-DNS által létrehozott zsebbe illeszkedik.
HIV és AIDS

2010-ben több mint 25 millió ember halt meg AIDS-ben, és becslések szerint körülbelül 33 millióan élnek HIV-vel.
Már több mint 25 millió ember halt meg AIDS-ben, és becslések szerint körülbelül 33 millióan élnek ma HIV-vel. A retrovírus integráz gátlókról lásd: Raltegravir és a retrovírus integráz gátló farmakokinetika.
A szerkezet hatása
Röntgenkrisztallográfiai elemzésekből a HIV-fertőzés és virulencia mechanizmusának megértéséhez kritikus fontosságú egyes gazdasejt-fehérjék háromdimenziós struktúrái kerültek elő. A HIV-proteáz és integráz szerkezetek a legmagasabb rangú szerkezetek közé tartoznak, amelyek hozzájárultak számos élet megmentéséhez és számos HIV-fertőzött egyén életminőségének javításához. A szerkezetalapú gyógyszertervezésben proteáz- és integrázgátlók kifejlesztésére alkalmazzák, és a nagy aktivitású antiretrovirális terápia (HAART) jelentős összetevőjeként használják.
Míg a meglévő antiretrovirális szerek javítják az életminőséget, valamint sok beteg életét meghosszabbítják, a betegséget nem képesek felszámolni. Az integrázgátlókkal végzett vizsgálatok azt mutatják, hogy más antiretrovirális gyógyszerekkel kombinálva csökkentik a vírus alkalmazkodását, és lehetőségük lehet a más gyógyszerekkel szemben rezisztenciát szerzett betegek mentőterápiájára. További információért lásd
- AIDS a proteázgátlók előtt & HIV-proteázgátlók: A Breakthrough
- Treatments: Retroviral Integrase Inhibitor Pharmacokinetics References.
PFV Intasome Crystallization
A HIV-1 vírus DNS-végződéseinek utánzásához Hare és munkatársai (2010) szolubilis és teljesen funkcionális prototype foamy virus (PFV) intasome preparátumokat használtak, amelyeket rekombináns PFV integráz és kétszálú oligonukleotidok segítségével nyertek.
Az integráz-DNS-komplexek figyelemre méltó stabilitását az in vitro szálátadási reakciók megfigyelésével határozták meg, amelyeket a deproteinációs vándorlás három módozatába soroltak: (1) egyszeri összehangolt események: linearizált célplazmid; (2) többszörös összehangolt események: elkenődés; (3) féloldali események: nyitott cirkuláris DNS. A PFV intaszóma további jellemzése strukturális lényegességet is mutatott, ami erős fehérje-fehérje és fehérje-DNS kölcsönhatásokat feltételezett a nagy ionerősségű körülmények közötti hosszan tartó inkubáció ellenére. Átfogó kristályosítási vizsgálatok életképes kristálykonfigurációt eredményeztek, amely 2,9 Angström felbontású röntgensugarakat diffraktált. Végül háromdimenziós szerkezetet határoztak meg. Az aszimmetrikus egység egyetlen integráz dimert tartalmazott egy stabilan kötött vírus-DNS-molekulával, valamint egy szimmetriával konzociált integráz dimerpárt, amely egy hosszúkás tetramert alkotott. A dimer interfészét intermolekuláris aminoterminális és katalitikus magdomének (belső alegység-külső alegység) kölcsönhatásai stabilizálták. Az oblong tetramer általános alakja egyedi, bár hasonlóságot mutat a korábban közölt HIV-1 integráz komplexekkel.
Kristályosítási technika
A fehérje-DNS komplexeket a teljes hosszúságú, vad típusú PFV IN és a vírusvéget modellező szintetikus dsDNS felhasználásával képeztük.
Az intaszómát gőzcseppes függő diffúziós technikát alkalmazva kristályosítottuk. A tárolóoldat 1,35 M ammónium-szulfátból, 25% (v/v) glicerinből, 4,8% (v/v) 1,6-hexándiolból és 50 mM 2-(N-morfolino)etanolszulfonsavból (MES) állt pH 6,5 mellett. A fehérje-DNS kristályokat MK0518, GS9137, Mg(II) és/vagy Mn(II) jelenlétében is áztattuk. A kristályszerkezetet molekuláris helyettesítéssel oldottuk meg.
Kristallográfiai és finomítási statisztikák
Hare és munkatársai (2010) hét kristályszerkezet adatait publikálták. Ezek az adatok tartalmazzák a PFV IN komplexet (apo forma) és hat további szerkezetet, beleértve a Mg-hez, Mn-hez, Mg/MK0518-hoz, Mn/MK0518-hoz, Mg/GS9137-hez és Mn/GS9137-hez kötött komplexet. Mind a hét szerkezet a P41212 tércsoportba tartozik. Finomításuk 2,85 és 3,25 Å közötti felbontásra történt.
Általános felépítés & Összetevők
Szerkezet
Az összeállított PFV intaszóma általános szerkezete egy tetramer modell, amely két doménszerkezeten alapul, dimer-dimer határfelülettel. A korábbi intaszóma modellek hasonló, de rugalmasabb szerkezetet ábrázolnak, míg a PFV intaszóma erősen kötöttnek bizonyult. Homológiamodellezéssel Hare és munkatársai (2010) azt javasolják, hogy a rövidebb doménközi linkerek a rugalmasság tényezői lehetnek, különösen a HIV-1 integrázban. A tetramer belső alegységei részt vesznek az általános tetramerizációban és a vírus DNS-kötésben. A külső alegységek katalitikus magdoménjei támaszként működhetnek, de mivel az amino- és karboxi-terminális domének az elektronsűrűség-térképeken felbontatlanok, funkciójuk továbbra is bizonytalan. A katalitikus magdomén és a karboxi-terminális domén linkere hosszának nagy részében nyújtott konformációt vesz fel, és a belső alegység amino-terminális doménjével és katalitikus magdomén linkerével párhuzamosan helyezkedik el. A doménközi linkerek A doménközi linkerek (CCD-CTD linker és NTD-CCD linker) az intaszóma mindkét felét összekötik, és a szerkezetet tovább stabilizálja egy pár karboxi-terminális domén, amely kölcsönhatásba lép mindkét belső katalitikus magdoménnel.
Integráz és DNS kölcsönhatások
A terminális hat nukleotidon belül erős fehérje-DNS kölcsönhatások találhatók. Mindkét karboxi-terminális domén kölcsönhatásba lép mindkét vírus-DNS-molekula foszfodiészter gerincével. Továbbá az amino-terminális domén-hosszabbító domén és az amino-terminális domén kölcsönhatásba lép a vírus-DNS-sel az ellentétes katalitikus magdomén aktív helyén.
Aktív hely
Az aktív hely karboxilátjai az Asp 128, Asp 185, Glu 221 oldalláncai.
Az aktív helyek közelében egy-egy cinkatom található.
- .
- .
Integráz gátlók
| Név | Márka | Cég | Szabadalom | Megjegyzések |
| Raltegravir | Isentress | Merck & Co. | – | MK-0518 néven is ismert. Az MK-0518 izopropil- és metil-oxadiazoljai hidrofób és egymásra épülő kölcsönhatásokban vesznek részt a Pro 214 és Tyr 212 oldalláncokkal, hogy stabilizálják ezt a hatóanyagot a PFV intaszóma aktív helyén belül. A gyógyszer-kötési kölcsönhatás ezen módja a reaktív 3′ vírus-DNS-vég kiszorítását okozza a PFV intaszóma aktív helyéről. Az MK-0518 aktív centrumhoz való kötődését követően a reaktív 3′ hidroxilcsoport több mint 6 Angströmnyire eltávolodik a PFV intaszóma aktív centrumától. A raltegravirt az FDA 2007. október 12-én engedélyezte más HIV-ellenes szerekkel együtt történő alkalmazásra a felnőttek HIV-fertőzésének kezelésére. Ez az első FDA által jóváhagyott integráz inhibitor. |
| Elvitegravir | – | Gilead Science | – | GS-9137 kölcsönhatásba lép a PFV intaszóma Pro 214-ével kinolon bázisán és izopropil csoportján keresztül. Kísérleti stádiumban; osztozik a kinolon antibiotikumok magszerkezetén. Az elvitegravir II. fázisú vizsgálatai kezelésben részesült embereken befejeződtek. A III. fázisú vizsgálatok kezelésben részesült betegeken folyamatban vannak. Folyamatban van az elvitegravir II. fázisú vizsgálata olyan személyeken, akik még soha nem részesültek antiretrovirális terápiában. Ebben a vizsgálatban a Norvir helyett alkalmazott, jelenleg GS9350 nevű erősítő hatóanyagot is értékelni fogják. Az elvitegravir ígéretes olyan HIV-pozitív betegek számára, akik korábban más HIV-ellenes gyógyszereket szedtek. |
| MK-2048 | – | Merck & Co. | – | Második generációs integrázgátló, amelyet HIV-fertőzés ellen kívánnak alkalmazni. Az első rendelkezésre álló integrázgátlóhoz, a raltegravirhez képest jobb, mivel 4-szer hosszabb ideig gátolja a HIV integráz enzimet. Vizsgálják a preexpozíciós profilaxis (PrEP) részeként történő alkalmazására. |
See also Retroviral Integrase Inhibitor Pharmacokinetics.
Retrovirális integráz gátló farmakokinetika.