Abstract
Az arzén alacsony koncentrációban serkenti a proliferációt, magas koncentrációban pedig gátolja a sejtnövekedést, ami kétfázisú hatást mutat a biológiai folyamatokra. A kétfázisú hatás megköveteli, hogy az arzén koncentrációját megfelelő küszöbértéken tartsák a rákos sejtek gátlásához a kemoterápia során. Az apoptózis lehet az arzén kettős tulajdonságaival kapcsolatos elsődleges mechanizmus.
Kulcsszavak
arzén, bifázisos hatás, endémiás arzén, karcinogenezis, kemoterápia
Kiemelendő
- Az arzén olyan karcinogén, amely alacsony koncentrációban serkenti a sejtproliferációt.
- Az arzén emellett rákszupresszor, amely nagy koncentrációban gátolja a sejtek növekedését.
- Az arzén biológiai szerepe kétfázisú hatást mutat a sejtnövekedésre.
- Az arzén kettős tulajdonságaival kapcsolatos lehetséges mechanizmus lehet az apoptózis.
Kommentár
Az arzén elem (As) széles körben elterjedt a természetben, amely gyakran oxigénnel vagy kénnel vegyületeket alkot. Az arzén szorosan kapcsolódik a biológiai folyamatokhoz is. Patofiziológiai jellemzői a következő szempontok szerint épülnek be: (a) az alacsony dózisú arzén serkenti a sejtproliferációt és a karcinogenezist. Amikor nátrium-arzenitet használtunk humán HepG2 rákos sejtek vagy nem daganatos HHI-5 hepatociták kezelésére, azt találtuk, hogy a sejtpusztulás százalékos aránya negatív volt a kezdeti fázisban, ami azt jelenti, hogy az alacsony dózisú arzenit elősegíti a sejtek növekedését (1. ábra). Az arzén az alacsony koncentrációk szűk tartományában fokozhatta a sejtek életképességét. Ahogy az arzenit szintje egy kritikus pontig emelkedett, elkezdte gátolni a proliferációt és gyorsítani a sejthalált. A következetes eredményről más tanulmányok is beszámoltak. A különböző geológiai régiókban az ivóvíz arzénkoncentrációja meghaladja az Egészségügyi Világszervezet által ajánlott szabványos értéket (0,01 mg/l). Az arzénnel dúsított vizet ivó helyi lakosok endémiás arzénbetegségben szenvednek. A különböző szervek (pl. bőr, tüdő, vese, húgyhólyag, máj stb.) rákos megbetegedései az endémiás területeken jelentősen magasabbak, mint a nem endémiás területeken . Az arzént a Nemzetközi Rákkutatási Ügynökség emberi rákkeltő anyagként azonosította; b) az arzén magas koncentrációja gátolja a sejtnövekedést. A klinikai gyakorlatban az arzénvegyületeket (pl. As2O3, As2S2 stb.) gyakran használják a rákos sejtek elpusztítására a kemoterápia során. Sőt, az arzenid volt az első vonalbeli gyógyszer egyes rákos megbetegedések, például a leukémia és a szilárd zsigeri daganatok kezelésére . Néha az arzénvegyületeket más gyógyszerekkel kombinálva használják a legjobb terápiás hatás elérése érdekében. Az arzenid nemcsak a tumor kialakulását indukálja, hanem a rákos sejteket is megöli, mint alapvető gyógyszer a klinikai kezelésben. Az arzén kettős tulajdonságokkal rendelkezik: karcinogén és rákszupresszor. Így a sejtnövekedésben betöltött kétirányú szerepének leírására egy új fogalmat, a “kétfázisú hatást” javasolják.
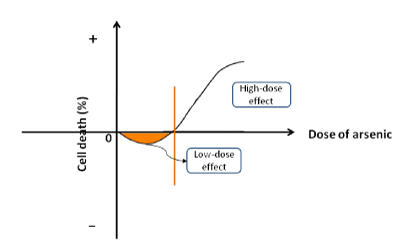
1. ábra. A kétfázisú hatás sematikus ábrája. Az arzén alacsony dózisban serkenti a sejtproliferációt, míg magas koncentrációban gyorsítja a sejthalált
Mi az a pontos mechanizmus, amely az arzén kettős tulajdonságait eredményezi? Jelenleg nincs egyértelmű válasz a kérdésre. A rendelkezésre álló adatok azonban alátámasztják, hogy az apoptózis döntő szerepet játszik. Az apoptózis egy génvezérelt, energiaigényes, öngyilkos folyamat a szöveti struktúra fenntartása érdekében. Az apoptotikus és anti-apoptotikus kompetenciák közötti egyensúly nemcsak a sejtek életképességét határozza meg, hanem közvetlenül befolyásolja a szöveti működést is. Eddig az apoptózist tekintették a karcinogenezist és a rák elnyomását összekötő elsődleges mechanizmusnak. Az apoptózisfehérjék (IAP) gátlójának erőteljes funkciója van a sejtek túlélésének szabályozásában és az apoptózis kaszkád szabályozásában . Ezenkívül az IAP-k kifejeződését több nukleáris faktor, például az NF-kappa B, a FoxA2, a C/EBP-béta és így tovább, modulálja . Az arzén és az apoptózis közötti kapcsolat gondos vizsgálatot érdemel. Több bizonyítékra van szükségünk annak bizonyítására, hogy a) az alacsony dózisú arzén gátolja az apoptózist és serkenti a sejtproliferációt. Jól ismert, hogy a karcinogenezisnek le kell győznie az apoptózis ellenállását; (b) a nagy dózisú arzén kiváltja az apoptózist és elpusztítja a rákos sejteket. A rákkezelés alapvető stratégiája a rákos sejtek apoptózisának kiváltása. Egy ésszerű hipotézis szerint az arzén alacsony koncentrációban gátolja az apoptózist, míg magas koncentrációban elősegíti az apoptózist. Azt is feltételezik, hogy az arzén kettős tulajdonságaiért az IAP-ok és szabályozó hálózatuk lehet a felelős.
Az arzén (arzenid) kétfázisú hatásának feltárása különös jelentőséggel bír a rák klinikai kezelésében. Ha az arzénvegyületet más gyógyszerekkel együtt adják, az arzénvegyületek dózisa gyakran csökken. Az arzén kettős tulajdonságai miatt értékelnünk kell az arzénvegyület gyógyhatását a gyógyszerek kombinált szedése során. Ebben a pillanatban az arzén helyi koncentrációját meghatározott szinten kell tartani a rákos sejtek apoptózisának kiváltásához. Ellenkező esetben az arzenid elősegítheti a rákos sejtek proliferációját. Nincs semmilyen terápiás hatás, sőt ellenkező kimenetelű. Ezért figyelembe kell vennünk az arzenid kétirányú válaszát, különösen más gyógyszerekkel kombinálva. Mi a pontos küszöbérték ahhoz, hogy az arzenid gátolja a daganatot? Hogyan adagoljuk az arzenidet, hogy elérjük a küszöbkoncentrációt, és hogyan tartsuk azt állandó értéken? Milyen biomarkerek ésszerűek az arzenid vérben lévő koncentrációjának nyomon követésére? A fenti kérdésekre mindeddig nem született válasz. Az arzén biológiai jellemzői a toxikológia számára is új témát vetnek fel. A toxikológia hagyományos definíciója szerint a sejtek elpusztítását vagy a halálozási arány növelését általában toxikológiai viselkedésnek tekintik. A rákos sejtek szaporodásának fokozása azonban szintén mérgező a szervezet számára. Tehát az alacsony dózisú arzén viselkedése a toxikológia egy másik aspektusa. Talán inverz toxikológiaként vagy fordított toxikológiaként definiálható. Jelenleg olyan molekuláris markereken dolgozunk, amelyekkel megbecsülhető az arzén koncentrációja a vérben, és értékelhető a terápiás hatása. A leukémia és a szolid tumorok különböző koncentrációjú arzéntartalmú gyógyszereket igényelhetnek (4). Nagy mintákon végzett klinikai vizsgálatokra van szükség ahhoz, hogy tesztelni lehessen az arzenid valódi szerepét a különböző rákos megbetegedések kezelésében. Emellett jelenleg a sejtek funkcionális állapotának számszerűsítése áll a középpontban.
Összefoglalva, az arzénnek kétfázisú hatása van a sejtnövekedésre, ami alacsony koncentrációban a proliferációban, magas koncentrációban pedig a gátlásban nyilvánul meg. A kétfázisú hatás miatt a rákkezelés során a rákos sejtek elpusztításához egy küszöbértéket kell fenntartani az arzénkoncentrációnak. Ellenkező esetben az arzenid serkentheti a rákos sejtek proliferációját, és ezzel fordított hatást érhet el. Az előzetes vizsgálatok azt mutatják, hogy az anti-apoptotikus IAP-család és szabályozási hálózata fontos szerepet játszik az arzén biológiájában. Az apoptózis az arzén kettős tulajdonságaival kapcsolatos lényeges mechanizmus lehet.
Erdélynyilatkozat
A szerzőknek nincs mit nyilvánosságra hozniuk.
Köszönet
Ezt a munkát a “The National Natural Science Foundation of China”, projekt száma 81773367 támogatta. Köszönjük Yang Jianbo professzor javaslatát és tanácsait a kézirat elkészítésében.
- Yedjou C, Tchounwou P, Jenkins J, McMurray R (2010) Basic mechanisms of arsenic trioxide (ATO)-induced apoptosis in human leukemia (HL-60) cells. J Hematol Oncol 3: 28.
- Tseng CH, Chong CK, Tseng CP, Centeno JA (2007) Blackfoot disease in Taiwan: its link with anorganic arsenic exposure from drinking water. Ambio. 36: 82-84.
- Smith AH, Marshall G, Roh T, Ferreccio C, Liaw J, et al. (2018) Lung, bladder, and kidney cancer mortality 40 years after arsenic exposure reduction. Journal of the National Cancer Institute 110: 241-249.
- Gill H, Yim R, Lee HKK, Mak V, Lin SY, et al. (2018) Az orális arzéntrioxid-alapú reindukciós és fenntartó kezeléssel kezelt, visszaesett akut promilocitás leukémia hosszú távú kimenetele: Egy 15 éves prospektív vizsgálat. Cancer 124: 2316-2326.
- Varfolomeev E, Blankenship JW, Wayson SM, Fedorova AV, Kayagaki N, et al. (2007) IAP antagonists induce autoubiquitination of c-IAPs, NF-kappaB activation, and TNFalpha-dependent apoptosis. Cell 131: 669-681.