Az interleukin 12 (IL-12) egy 70 kDa molekulatömegű pro-inflammatorikus citokin, amely két alegységből, az IL-12p35 (35 kDa) és az IL-12p40 (40 kDa) alegységből áll. Az egyedi heterodimer szerkezet közös a család három tagjával, azaz az IL-23 (p19/p40), IL-27(p28/Ebi3) és IL-35 (p35/Ebi3) családtagjaival.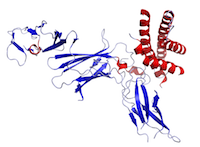
Az IL-12, más néven IL-12p70-t 1989-ben Kobayashi M. et al. egymástól függetlenül fedezte fel (természetes ölősejteket stimuláló faktornak nevezve), majd 1990-ben Stern A.S. et al. (citotoxikus limfocita érési faktornak nevezték el).
Ábra Ez az IL-12 szerkezete, amelyet a Protein Data Bank (PDB: 1F45) adatai alapján hoztak létre és PyMOL segítségével ábrázoltak.
Az IL-12 a naiv CD4+ T-sejtek Th1-sejtekké való differenciálódását indukálja és aktiválja az NK-sejteket. Aktiválás után az NK-sejtek IFN-γ-t és IL-2-t, de IL-12-t is termelnek, ami pozitív visszacsatolási mechanizmusra utal. Az IL-12 megvédi a CD4+ Th1 sejteket az antigén által kiváltott apoptotikus haláltól, és szinergista hatást fejtett ki az IL-18-mal a fejlődő Th1 sejtekben. Ezenkívül az IL-12 szerepet játszik a T-sejtek mozgásában és migrációjában azáltal, hogy funkcionális adhéziós molekulák, például a P- és E-szelektin ligand expresszióját indukálja a Th1-sejteken, de nem a Th2-sejteken. Ezért a Th1 sejtek szelektíven toborzódnak a Th1 immunválaszt elősegítő helyekre. Funkcionálisan ezek a sejtek segítenek az intracelluláris kórokozók eltávolításában; ellentétben a Th2 sejtekkel, amelyek az extracelluláris betolakodók ellen védő humorális immunitásért felelősek. A Th1-választ előnyben részesítő IL-12 és a Th2-választ előnyben részesítő IL-4 közötti egyensúly határozza meg az immunválaszban kifejezett korai preferenciát.
Az IL-12p35 jelentős szekvencia-homológiát mutat az IL-6 citokinnal, míg a p40 lánc szerkezetileg homológ az IL-6 receptor (IL-6R) α-láncának extracelluláris doménjével. Ez arra utal, hogy az IL-12 szerkezete az IL-6 család egyik primordiális citokinjéből és annak egyik receptorából fejlődött ki. Bár az IL-12p35 transzkriptum számos sejttípusban megtalálható, a szabad IL-12p35 nem szekretálódik az IL-12p40 alegység nélkül. Ez utóbbi alegységet elsősorban az aktivált monociták, makrofágok, neutrofilek és dendritikus sejtek termelik. Az IL-12p70 biológiai aktivitását egy két alegységből álló membránreceptor-komplexhez (IL-12R) való kötődés közvetíti: IL-12R-β1 és IL-12R-β2. Míg az IL-12Rβ1 alegység konstitutívan expresszálódik, addig az IL-12R-β2 expresszióját a Th1 sejteken az IFN-γ felszabályozza, és korrelál az IL-12-re való érzékenységgel. Az IL-12 kötődését követően a JAK-STAT jelátviteli útvonal aktiválódik, a STAT4 pedig a T-sejtes válaszok domináns közvetítője.