A molekula fizikai tulajdonságainak, hibridizációjának és alakjának megértéséhez fontos ismerni a molekula Lewis-szerkezetét. Ma az I3- vagy más néven triodidion Lewis-szerkezetét tekintjük át, mivel negatív töltéssel rendelkezik. Ebben a molekulában három jódmolekula van, ezért a vegyület neve triodid. A molekula Lewis szerkezetének megértéséhez ismernünk kell a jódmolekula valenciaelektronjait.
Lewis szerkezet
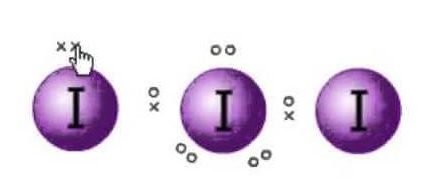
A Lewis szerkezet a molekulák elektronjainak ábrázolása. Vannak magányos párok és valenciaelektronok, amelyek segítenek a molekula hibridizációjának és alakjának meghatározásában. Mivel jódmolekulák vannak, egy jódmolekula lesz a középpontban. Emellett a jód a periódusos rendszer hetedik csoportjában van, és hét valenciaelektron van a külső pályáján.

Három jódmolekulánk van itt, amely egy plusz elektronnal együtt negatív töltést ad neki. Tehát a valenciaelektronok száma összesen : 7×3 + 1= 22.
Ebben a molekulában összesen 22 valenciaelektron van. Van egy nyolcas szabály, amelyet minden atom követ. E szabály szerint minden atom külső pályáján nyolc elektronnak kell lennie. Ha a központi atom külső héjában 8 elektron van, akkor két másik atomnak kell kiegészítenie a nyolcadot. Mivel minden atomnak nyolc elektronra van szüksége a külső héjában ahhoz, hogy kiegészítse a nyolcadot, a központi jódatom egyik elektronját mindkét szomszédos jódatom el fogja foglalni. Ez azt jelenti, hogy 8-1-1=6.
Mivel az elektronokat mindkét atom el fogja foglalni.
Így a jód központi atomjának valenciaelektronja hat lesz. Ez a hat elektron fogja alkotni a magányos elektronpárokat, amelyek nem kötődnek. Mivel most ez alkotja az elektronpárokat, három magányos pár és két kötéspár lesz az elektronokból, mivel minden jódatomnak van egy kötése a központi atomhoz, amely egy-egy elektronon osztozik, összesen 3 magányos pár és 2 kötéspár van a központi atomon.
Hibridizáció
Minden molekula hibridizációjának megismerésére van egy egyszerű képlet, amelyet használhatunk. Ez a képlet a hibridizációs szám megállapítására szolgál, amely segít a molekula hibridizációjának megismerésében.
A hibridizációs számokat és az általa meghatározott hibridizációt a következőképpen állapítjuk meg:
- 2: sp hibridizáció
- 3: sp2 hibridizáció
- 4: sp3 hibridizáció
- 5: hibridizáció
A szám megtalálásának képlete a következő,
Hibridizációs szám: Valenciaelektron száma + egyértékű + (negatív töltés) – (pozitív töltés)/2
A jódatomok valenciaelektronja 7, mivel a legkülső héjban hét elektron van. Az egyértékű atom száma kettő, mivel a három jódatomból kettő egyértékű. Most, amikor az I3- ion töltéséhez érünk, negatív töltéssel rendelkezik, így ennek a negatív töltésnek az értéke 1 lesz.
Most tegyük az összes értéket a képlet szerint,
7+1+2/2
=10/2
=5
Így a hibridizációs szám 5, ami azt jelenti, hogy a hibridizációja sp3d.
Az adott molekula hibridizációjának megállapításának másik módja a magányos párok és a valenciaelektronok segítségével történik. Ebben a molekulában a magányos párok száma 3, a valenciaelektronokon osztozó atomok száma pedig 2.
Ezért 3+2=5, ami szintén sp3d hibridizációra utal.
Az I3- ion alakja

Az I3- molekula alakja lineáris. Három jódatom van benne, amelyek közül egynek extra negatív töltése van. Ennek az egy plusz elektronnak köszönhetően 3 magányos elektronpár és 2 kötéspár van, így a sztérikus száma 5. Mivel a központi jodidatomon három magányos pár van, ezek a párok igyekeznek egymást a lehető legnagyobb mértékben taszítani. Így a nagyobb távolság érdekében a párok az egyenlítői pozíciókat veszik fel, és a másik két jódatom 180 fokban van egymástól. Így az I3- ion általános alakja lineáris.
Polaritás
Íme tehát a trükkös rész ezzel az ionnal kapcsolatban, először is mintha töltés lenne rajta, molekula helyett többatomos ionnak nevezhetnénk. Az ionok azok a töltések, amiket a molekulákon látunk. Mivel az I3-nak egy elektronja van, ez az ion összességében negatív töltéssel rendelkezik. A molekulák polaritással rendelkeznek, mert mindkét töltés részben pozitív töltésű és részben negatív töltésű. A molekulákon a molekulán lévő töltések elkülönülésétől függően dipólusmomentum van. Ha a két töltés közötti távolság nagyobb, akkor a dipólusmomentum is nagyobb lesz.
De amikor az I3- ionról beszélünk, az egy negatív töltésű ion. Még ha meg is rajzoljuk, a Lewis szerkezetét, akkor sem látunk benne dipólusmomentumot vagy poláris kötéseket, mivel maga a teljes töltés negatív az ionon. Tehát sem nem poláris, sem nem poláris. Ha azonban le kell írnunk az iont, használhatjuk a ” mint egy poláris molekula” kifejezést, mert az I3- vízben oldódik.
Végszóként összefoglalva ezt az egész cikket, az I3- egy többatomos ion, amelynek 22 valenciaelektronja, 3 magányos párja, 2 kötéspárja és sp3d hibridizációja van. Lineáris alakú, és nincs polaritása.