Tartalom
- 1 Bevezetés
- 2 Szerkezeti jellemzők
- 3 Funkció
- 4 Jelentősége az emberi egészség szempontjából & Betegségek
- 5 Külső hivatkozások
Bevezetés
A humán gyomorlipáz (HGL, E.C. 3.1.1.1.3) (PBD ID: 1hlg) az a lipáz, amely az étkezési zsírok emésztésének megindításáért felelős a gyomorban . Ezt a saválló enzimet az emberi gyomor fundikus fősejtjei választják ki, és egészséges felnőtteknél az összes lipolitikus (azaz a zsírbontással járó) folyamat 10-20%-át katalizálja . A HGL specifikusan katalizálja a triacilglicerin hidrolízisét, hogy diacilglicerin és egy karboxilát melléktermék keletkezzen , egy olyan folyamat, amely megkönnyíti a hasnyálmirigy lipáz általi későbbi zsírbontást. Ami a betegséggel kapcsolatos következményeket illeti, bizonyítékok utalnak arra, hogy a HGL szekréciója megváltozik a gyomorhurutban (a leggyakoribb gyomorbetegség, amelyben a gyomornyálkahártya gyulladt) szenvedő egyéneknél . Továbbá a károsodott hasnyálmirigy-funkcióval (és ezért csökkent hasnyálmirigy-lipáz-szintekkel) rendelkező egyéneknek nagymértékben a HGL-től kell függeniük a táplálékkal bevitt zsírok emésztése érdekében .
Szerkezeti jellemzők
A HGL, egy hidroláz enzim, amely két 379 aminosav-maradék hosszúságú alegységből áll, rendelkezik egy , amely Ser-153, His-353 és Asp-324 maradékokat tartalmaz. Ez a szerkezet nélkülözhetetlen a lipidek lebontásához, összehangolva egy Leu-67 és Gln-154 , amely az átmeneti állapot stabilizálására szolgál. Szerkezetileg a humán gyomorlipáz komplexet mutat (a béta-lapok sárgával, az alfa-hélixek narancssárgával, a spirálok zölddel, a felbontott szénhidrátok pedig lilával ábrázolva). A HGL a 215-244-es maradékoknál helyet ad a (pirossal jelölt hidrofób régióknak), amelyek mind az aktív centrumot körülveszik, mind a fedéllel összekapcsolódnak. Ezek a területek feltehetően vonzzák a lipideket és elősegítik a dokkolást .
Funkció
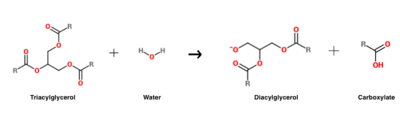
A HGL által katalizált triacilglicerin hidrolízisreakcióját .
A HGL körülbelül ötös optimális pH-nál működik, és elsősorban a rövid láncú triacilglicerin hidrolízisét katalizálja .
A HGL katalitikusan aktív szerinnel rendelkező észterázként a HGL a már ismert szerinészteráz mechanizmushoz hasonló mechanizmust mutat. Az aktív centrumban található szerint először az Asp-136 és a His-152 közötti sóhíd szomszédos kialakulása segíti elő, ami a Ser-153-tól egy proton kisajátítását indukálja. Az immár erősen nukleofil Ser-153 megtámadja a triacilglicerin molekula acetátcsoportjának karbonil szénjét. A tetraéderes species-t az oxianion lyuk stabilizálja. Amint azonban a species szétesik a kovalens kötésű acetátra és a lipázra, a szerin deaciláción megy keresztül, amelyben a víz nukleofilként viselkedik. Ez a végső lépés állítja vissza a Ser-153-at protonált állapotába .
Jelentősége az emberi egészség szempontjából & Betegség
A HGL hidrolitikus hatása kissé járulékos az egészséges felnőtteknél, akiknél a HGL a táplálékkal bevitt zsírok lebontásának legfeljebb 10-20%-át modulálja . A HGL jelenléte azonban döntő fontosságú a koraszülött csecsemőknél, akik gyakran gyenge hasnyálmirigyműködést mutatnak, valamint a kóros hasnyálmirigy elégtelenségben (pl. krónikus hasnyálmirigy-gyulladás) szenvedő felnőtteknél . Ezek az egyének nem képesek megfelelő mennyiségű hasnyálmirigy-lipázt termelni, ezért az étkezési zsírok emésztésében elsősorban a HGL-re kell támaszkodniuk . Ezekben az egyénekben a HGL felelős az étrendi trigliceridek 30-60%-ának hidrolizálásáért .
Tomasik és munkatársai (2013) a HGL-szekréció hormonális szabályozását vizsgálták gyomorhurutos gyermekek és serdülők esetében. A HGL-aktivitást három csoportban hasonlították össze: egy kísérleti csoportot, amely Helicobacter pylori okozta gyomorhuruttal diagnosztizált serdülőkből állt (n = 10), egy másik kísérleti csoportot, amely a gyomorhurut egy nem H. pylori által kiváltott formájával rendelkező serdülőkből állt (n = 10), és egy egészséges serdülőkből álló kontrollcsoportot (n = 14). A HGL-aktivitást, valamint a glükagonszerű peptid-1, a kolecisztokinin és a glükózfüggő inzulinotrop peptid plazmakoncentrációit az egyes betegektől endoszkópos mérésekkel gyűjtött gyomornedvminták elemzésével figyelték meg.
A betegek, akiknek a felületes gyomorhurutját a H. pyloritól eltérő kórokozók idézték elő, alacsonyabb HGL-aktivitást mutattak mind az egészséges serdülőkhöz (p < .005), mind azokhoz képest, akiknél H. pylori-gasztritiszt diagnosztizáltak (p < .005). A glükózfüggő inzulinotrop peptid átlagos plazmakoncentrációja alacsonyabb volt az egészségeseknél (p < 0,005), mint a nem H. pylori-gasztritiszben szenvedőknél (p < 0,003) és a H. pylori-gasztritiszben szenvedőknél (p < 0,01). A HGL-szekréció glükagonszerű peptid-1 (GLP-1) és kolecisztokinin (CCK) általi szabályozása tehát megváltozottnak bizonyult a gyomorhurutos serdülőknél; e megállapítás alátámasztására a meglévő irodalomban azt javasolták, hogy a GLP-1 és a CCK gátolja a HGL-szekréciót . Ezenkívül a glükózfüggő inzulinotróp peptid a humán gyomorlipáz aktivitásának erőteljes aktivátorának bizonyult minden kísérleti és kontrollcsoportban .
PDB – 1HLG: http://www.rcsb.org/pdb/explore.do?structureId=1HLG
.