Introduction: Defining Terms
A Cannabis taxonómiájára vonatkozó korábbi adatokat korábban áttekintettük (Russo, 2007), amelyeket az alábbiakban összefoglalunk és kiegészítünk. A Cannabis a Cannabaceae család kétlaki egynyári növénye, amelyhez hagyományosan a komló, a Humulus spp. tartozik. Alternatívaként a Cannabis-t a Moraceae, Urticaceae, vagy akár a Celtidaceae családokba is sorolták a kloroplasztisz restrikciós helytérképek (Weigreffe et al., 1998) és a kloroplasztisz mat K génszekvenciák (Song et al., 2001) alapján. Újabban a Cannabaceae nyolc nemzetséget foglal magába: Celetis, Pteroceltis, Aphananthe, Chaetachme, Gironniera, Lozanella, Trema és Parasponia, amelyek 170 páratlan fajt foglalnak magukban (McPartland, 2018), amit négy plasztid lókusz genetikai elemzése is alátámaszt (Yang et al., 2013). A Cannabisnak a sztyeppei társfajokkal (Poaceae, Artemisia, Chenopodiaceae) és a Humulusnak (komló) az erdei nemzetségekkel (Alnus, Salix, Populus) való ökológiai társulásához kapcsolódó fosszilis pollenmintákon végzett jelenlegi kutatások megállapították, hogy bár a Cannabis a jelek szerint legalább 19,6 millió évvel ezelőtt a Tibeti-fennsíkról származik, Európában is legalább egymillió éve őshonos (McPartland et al., 2018), és megcáfolták azt a hagyományos nézetet, hogy ezt a “táborlakót” az ember hozta oda.
Magának a Cannabisnak a fajbesorolása nagy vitákkal terhelt. A Cannabis sativa-t, azaz a “termesztett Cannabis”-t többek között Fuchs nevezte így 1542-ben (Fuchs, 1999), egy 211 évvel a botanikai binomálisok rendszerezése előtt 211 évvel Linnaeus Species Plantarum című művében (Linnaeus, 1753). Lamarck később külön fajként javasolta a Cannabis indica-t, egy Indiából származó, kisebb termetű, bódító hatású indiai növényt (Lamarck, 1783). A kérdés a következő évszázadokban két ellentétes filozófiával megoldatlan maradt. Ernest Small az egyetlen faj koncepcióját képviselte (Small és Cronquist, 1976). A Cannabis polytípusos kezelése is nyert követőket (Schultes et al., 1974; Anderson, 1980) morfológiai kritériumok alapján, amelyek a Cannabis sativa L. Cannabis indica Lam. és a Cannabis ruderalis Jan. elkülönítését javasolták, ezt a sémát a szisztematikus kemotaxonómia is alátámasztotta. A világ minden tájáról származó 157 Cannabis-hozzáférés főkomponens-elemzése (PCA), amely 17 génlokuszon értékelte az allozimfrekvenciákat, a szétválást sugallta (Hillig, 2005b). A kelet-európai ruderális mintákból származó “sativa” génállományt a keskenylevelű európai és közép-ázsiai rost- és magnövényekhez kapcsolták, míg egy “indica” csoportosítás magában foglalta a távol-keleti mag- és rostnövényeket és a világ nagy részéből származó széleslevelű drognövényeket, valamint az indiai szubkontinensről származó vad akcessziókat. A közép-ázsiai útszéli minták (Cannabis ruderalis) egy harmadik csoportot képviseltek. A gázkromatográfiás (GC) és keményítő-gélelektroforézis vizsgálatok szintén a sativa és az indica faji elkülönítését sugallták (Hillig és Mahlberg, 2004).
A 69 mintán végzett agronómiai tényezők a keleti kender és a drognövények Cannabis indica-ba sorolását sugallták (Hillig, 2005a), amit a töredékhossz-polimorfizmusok (Datwyler és Weiblen, 2006) is alátámasztottak.
A közelmúltban úgy tűnt, hogy a PCA a terpenoidtartalomra mutatott rá, mint a legmeggyőzőbb megkülönböztető kemotaxonómiai markerre a feltételezett sativa és indica fajok között (Elzinga et al., 2015). Hasonlóképpen, a PCA úgy érezték, hogy elválasztja a kábítószeres Cannabist a kendertől (Sawler et al., 2015). Egy nemrégiben végzett tanulmány 13 mikroszatellita lókusz genotipizálása révén mutatta ki a Cannabis drog és a kender akcessziók elhatárolását a genom egészében, nem csupán a kannabinoid- vagy rosttermelést befolyásoló génekkel (Dufresnes et al., 2017). Giovanni Appendino professzor csak a cisz-Δ9-THC sztereoizomer jelenlétéről számolt be a kenderakkcessziókban (Giovanni Appendino, személyes közlés). Ezek a megkülönböztetések azonban a THC-tartalomra vonatkozó jogszabályi korlátozások elkerülése érdekében a kender és a kábítószer-kultúrák keresztezésének jelenlegi tendenciája miatt könnyen elsikkadhatnak.
A Cannabis-fajok vitája – Cannabis sativa vs. indica vs. afghanica – a mai napig töretlenül folytatódik a főszereplők által előadott szenvedélyes érvekkel (Clarke és Merlin, 2013, 2016; Small, 2015; McPartland és Guy, 2017; Small, 2017). Ez a szerző, aki a kérdés minden oldalán állt valamikor, úgy döntött, hogy elkerüli a kibékíthetetlen rendszertani vitát, mint szükségtelen figyelemelterelést (Piomelli és Russo, 2016), és inkább azt hangsúlyozza, hogy csak a Cannabis-hozzáférések közötti biokémiai és farmakológiai különbségek relevánsak. McPartland nemrégiben megjelent korszakalkotó áttekintésében egyetértett: “A Cannabis “Sativa”-ként és “Indica”-ként való kategorizálása hiábavaló gyakorlattá vált. A mindenütt jelenlévő kereszteződés és hibridizáció értelmetlenné teszi a megkülönböztetésüket”. (McPartland, 2018) (210. o.).
Egy további nem értelmes nevezéktani vita a köznyelvben a Cannabis “törzseire” vonatkozik, amely elnevezés baktériumokra és vírusokra megfelelő, de növényekre nem (Bailey és Bailey, 1976; Usher, 1996; Brickell et al., 2009), különösen a Cannabis esetében, ahol a kémiai fajta, rövidítve “chemovar” a legmegfelelőbb elnevezés (Lewis et al., 2018).
A Cannabis genom és az alternatív gazdaszervezet biokémiai termelése
2011 mérföldkő volt a Cannabis genomika számára, amikor a Medical Genomics és a Nimbus Informatics online jelentést adott ki a teljes, 400 millió bázispáros genomszekvenciáról, amelyhez rövidesen egy genom- és transzkriptom-tervezet is csatlakozott (van Bakel et al., 2011).
Ez a fejlemény kiemelkedő nyilvánosságot és vitát váltott ki azzal kapcsolatban, hogy mit jelenthet. Míg az emberi genomot mintegy 20 évvel korábban elemezték, addig a Cannabisra gyakorolt hatásai nagy találgatások tárgyát képezték.
A hír új kutatások fellendülését katalizálta, de az alkalmazott Cannabisgenetikában már korábban is jelentős előrelépés történt. A Δ9-tetrahidrokannabinol (THC) azonosítása és szintézise 1964-ben Izraelben sikerült (Gaoni és Mechoulam, 1964), de csak jóval később sikerült klónozni a bioszintetizáló enzimet, a tetrahidrokannabinsav-szintázt (THCA-szintáz) (Sirikantaramas és mtsai., 2004; 1. ábra). Az enzim kristályosítása következett (Shoyama és mtsai., 2005). A kannabidioilsav-szintázt, amely a kannabidioilsavat (CBDA), a kannabidiol (CBD) prekurzorát katalizálja, már korábban azonosították és tiszta formában előállították (Taura és mtsai., 1996; 1. ábra). Ezek a fejlemények további felfedezéseket ösztönöztek, beleértve a THCA-szintáz régészeti fitokémiai felfedezését egy 2700 éves közép-ázsiai sírból származó Cannabis-kincsben, valamint az enzim génszekvenciájának két, korábban nem ismertetett egynukleotid-polimorfizmusát (SNP) (Russo et al., 2008).
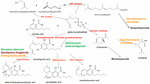
1. ábra. A Cannabis sativa bioszintetikus útvonalai és enzimjei (piros színnel), a természetes Helichrysum umbraculigerum faj és a későbbi termékek előállítására genetikailag módosított alternatív fajok (színnel) jelzése .
2011-re azonosították a főbb fitokannabinoidok előállításához szükséges enzimeket. Hasonlóképpen, a szelektív fejlett mendeli nemesítés specifikus egyes komponensekben gazdag Cannabis-fajtákat eredményezett. Így magas THC- és magas CBD-tartalmú növényeket állítottak elő a gyógyszeripari fejlesztésekhez (de Meijer és mtsai., 2003; de Meijer, 2004), analóg módon magas cannabigerol (CBG) (de Meijer és Hammond, 2005) és cannabichromén (CBC) vonalakat nemesítettek (de Meijer és mtsai., 2009a). A szelektív nemesítés kiterjedt a propil-fitokannabinoid analógokra, a tetrahidrokannabivarinra (THCV), a kannabidivarinra (CBDV), a kannabigerivarinra (CBGV) és a kannabikromivarinra (CBCV) is (de Meijer, 2004). Az ezen “minor kannabinoidok” magas titereivel rendelkező növények elérhetősége érdekes új gyógyszeripari alkalmazásokat vetít előre (Russo, 2011; Russo és Marcu, 2017).
A Cannabis genomjához való hozzáférés egyszerűsítheti a THC-knockout növények előállítását a CRISPR-technológia (clustered regularly-interspaced short palindromic repeats) segítségével. Bár ez vonzó lehet az ipari kender nemesítése számára, a növénytermesztés egy korábbi generációja már olyan kenderfajtákat hozott létre, amelyek könnyen teljesítik a nemzetközi korlátozásokat, amelyek 0,1%-os vagy annál kisebb THC-tartalmat követelnek meg (Wirtshafter, 1997; McPartland et al., 2000; Small és Marcus, 2003). Valójában cannabinoid-mentes, funkcionális cannabigerolsav-szintáz nélküli cannabist (1. ábra) is termesztettek már hagyományos módon (de Meijer és mtsai., 2009b). Így továbbra sem világos, hogy a Cannabis géntechnológiája egyáltalán szükséges-e e növény esetében, amelynek hihetetlen plaszticitása már most is bőséges biokémiai sokféleséget mutat. A genetikailag módosított szervezet (GMO) Cannabis bevezetése jelentős vitákat váltana ki a lakosság bizonyos rétegei között, és valószínűleg a szabadalmi és nemesítési jogokkal kapcsolatos jogi vitákat idézne elő.
Könnyen elképzelhető számos további sci-fi forgatókönyv. Az 1990-es években egy internetes átverés azt a pletykát terjesztette, hogy egy apokrif Nanofsky professzor THC-termelésre alkalmas géneket vitt be a narancsba (Citrus x. sinensis (L.) Osbeck). Bár ez technológiailag megvalósítható lenne, a Cannabis csodálatos kannabinoid-termelésének fényében ez nem lenne több, mint egy laboratóriumi karneváli mutatvány. A levelek mirigyes trichomáiban tiltott fitokannabinoidokat tartalmazó, lopakodó borsmenta (Menthax piperita Lamiaceae) logikusabb választás lehet az ilyen földalatti felforgató álmodozásokhoz, és világszerte vízfolyások mentén küldhetne rizómákat és futókat.
A komlóból (Humulus lupulus L. Cannabaceae) és a lenből (Linum usitatissimum L. Linaceae) származó kannabidiol előállítására vonatkozó korábbi állítások megalapozatlanok, de cannabigerolsavat és cannabigerolt mutattak ki a dél-afrikai Helichrysum umbraculigerum Less. Asteraceae (Bohlmann és Hoffmann, 1979; Appendino et al., 2015; Russo, 2016; 1. ábra), de koncentrációjára való hivatkozás nélkül. Ezt az állítást a közelmúltban megerősítették a légi részek szárított mintáiból megfigyelt nyomokban (Mark Lewis, személyes közlés).
Mivel a kannabinoidok tisztán de novo biokémiai szintézisének bonyolultságát nem tartották költséghatékonynak (Carvalho et al., 2017), alternatív mikrobiális gazdatesteket javasoltak (Zirpel et al., 2017). 2004-ben sikerült elérni a THCA-szintáz cDNS-klónozását, amely lehetővé tette a cannabigerolsav (CBGA) THC-vé történő átalakítását (Sirikantaramas et al., 2004), és CBGA-táplálásra 8%-os THCA-termelődést mutattak ki dohány szőrös gyökereiben (Nicotiana tabacum cv.Xanthi Solanaceae) (1. ábra). Az enzimet rekombináns baculovírus segítségével a rovarban, a Spodoptera frugiperda (J.E. Smith) Noctuidae (őszi páncélféreg) rovarban is kifejezték. Ezt követően ez a kutatócsoport az élesztők, a Pichia pastoris (ma Komagataella phaffii Phaff Saccharomycetaceae) felé fordult (Taura et al., 2007; 1. ábra), és 24 óra alatt 98%-os CBGA-ból THCA-vá történő átalakulást ért el, 32,6 mg/L táptalajhozam mellett. A THCA-szintáz rekombináns formája 4,5X hatékonyabbnak bizonyult, mint a Cannabisban és 12X hatékonyabbnak, mint a S. frugiperdában. Ezt a folyamatot később optimalizálták, az aktivitás 64,5-szeres javulásával (Zirpel et al., 2018), a K. phaffii-ban 8 óra 37°C-on történő inkubáció után 3,05 g/L THCA termelésről számoltak be. Egy egyszerű számítás szerint ez a hozam mindössze 15 g 20%-os THCA növényi Cannabis kivonatából is elérhető lenne.
A cannabis terpenoidok előállítása hasonlóan lehetséges alternatív gazdaszervezetekben is. A Saccharomyces cerevisiae Meyen ex E.C. Hansen Saccharomycetaceae farnezil-difoszfát-szintáz enzim hiányos mutánsai helyette geranil-pirifoszfátot halmoznak fel, amely az orvosilag hasznos terpenoid, a linalool termelésébe kerül (Oswald et al., 2007; 1. ábra). Hasonlóképpen, más kutatók a S. cerevisiae mitokondriumainak bioszintetikus képességeit hasznosították a szeszkviterpenoidok farnezil-difoszfát-termelésének növelésére (Farhi et al., 2011), bár nem a Cannabisra jellemzőek.
A meglévő Cannabis genomszekvenciák jelenleg nincsenek teljesen annotálva. Következésképpen a Cannabis genetikai funkcióira vonatkozó gyakorlati adatok megszerzéséhez alkalmazott előismeretekre és detektívmunkára lesz szükség. Az ilyen vizsgálatokban a legnagyobb potenciál az epigenetika területén rejlik majd, amely a növény génexpressziójának vagy fenotípusának örökletes változásai mögött áll. A legkiemelkedőbb hiányosság a kannabinoid-termelés szabályozására vonatkozó ismeretek hiánya. A Cannabis terpenoidjait termelő terpénszintázok bioszintetikus útvonalainak és szabályozásának megértése alig kezdődött el (Booth et al., 2017), és továbbra is további kutatások érett célpontjai (Russo, 2011).
A Cannabis termesztésében további problémát jelent továbbra is a voucher példányok hiánya (amelyeket az USA kábítószer-ellenőrzési hatósága az I. jegyzékben szereplő engedély nélkül betilt) és a chemovar hozzáférések hivatalos letétbe helyezése a mag- és szövetraktárakban. Ez utóbbit a GW Pharmaceuticals és ettől függetlenül a NaPro Research (Lewis et al., 2018) végezte el a skóciai National Collection of Industrial, Food and Marine Bacteria (NCIMB) gyűjteményben. Számos magánvállalat jogi korlátozások és a szellemi tulajdon elvesztésétől való félelem miatt kerülte a csíraplazma megosztását.
Cannabis Synergy
1998-ban Raphael Mechoulam és Shimon Ben-Shabat professzorok azt állították, hogy az endokannabinoid rendszer “kísérő hatást” mutat, amelyben számos “inaktív” metabolit és szorosan kapcsolódó molekula jelentősen megnöveli az elsődleges endogén kannabinoidok, az anandamid és a 2-arachidonoilglicerin aktivitását (Ben-Shabat et al, 1998). Azt is posztulálták, hogy ez segít megmagyarázni, hogy a növényi gyógyszerek gyakran hatékonyabbak, mint izolált összetevőik (Mechoulam és Ben-Shabat, 1999). Bár az egymolekulás szintézis továbbra is a gyógyszerfejlesztés domináns modellje (Bonn-Miller et al., 2018), a növényi szinergia koncepcióját bőségesen bizonyították egyidejűleg, hivatkozva a “minor kannabinoidok” és a Cannabis terpenoidok farmakológiai hozzájárulására a növény általános farmakológiai hatásához (McPartland és Pruitt, 1999; McPartland és Mediavilla, 2001; McPartland és Russo, 2001, 2014; Russo és McPartland, 2003; Wilkinson et al., 2003; Russo, 2011). A Cannabisban az entourage-effektusra több idevágó példa is szemléltető:
A Cannabis alapú oromucosális kivonatok randomizált, kontrollált vizsgálatában az optimális opioidkezelés ellenére kezelhetetlen fájdalomban szenvedő betegeknél a THC-túlsúlyos kivonat nem határolódott el kedvezően a placebótól, míg a THC-t és cannabidiolt (CBD) egyaránt tartalmazó teljes növényi kivonat (nabiximols, vide infra) statisztikailag szignifikánsan jobbnak bizonyult mindkettőnél (Johnson et al, 2010), az egyetlen szembetűnő különbség a CBD jelenléte az utóbbiban.
A fájdalomcsillapítással kapcsolatos állatkísérletekben a tiszta CBD kétfázisú dózis-válasz görbét eredményez, úgy, hogy a kisebb dózisok csökkentik a fájdalomválaszt egy csúcspont eléréséig, amely után a dózis további növelése hatástalan. Érdekes módon a teljes spektrumú Cannabis-kivonat alkalmazása a CBD azonos dózisával megszünteti a kétfázisú választ egy lineáris dózis-válasz görbe javára, így a növényi kivonat bármilyen dózisban fájdalomcsillapító hatású, és nem figyelhető meg felső határhatás (Gallily et al., 2014).
Egy nemrégiben végzett vizsgálat több humán emlőrákos sejtvonalon tenyészetben és beültetett tumorban kimutatta a Cannabis-kivonat kezelésének fölényét a tiszta THC-vel szemben, ami az előbbiben látszólag a cannabigerol (CBG) és a tetrahidrokannabinolsav (THCA) kis koncentrációjának tulajdonítható (Blasco-Benito et al, 2018).
A kannabidiol görcsoldó hatását állatokban az 1970-es években figyelték meg, az első humán kísérleteket 1980-ban végezték (Cunha et al., 1980). Egy nemrégiben végzett kísérletben pentylenetetrazol által kiváltott görcsrohamokkal járó egereken öt különböző Cannabis-kivonatot alkalmaztak azonos CBD-koncentrációval (Berman et al., 2018). Bár az összes kivonat előnyöket mutatott a kezeletlen kontrollokhoz képest, markáns különbségeket figyeltek meg a nem-CBD kannabinoidok biokémiai profiljában, ami viszont jelentős különbségeket eredményezett a tónusos-klónikus rohamokat kialakító egerek számában (21,5-66,7%) és a túlélési arányban (85-100%), kiemelve ezeknek a “kisebb” összetevőknek a jelentőségét. Ez a tanulmány rávilágít a szabványosítás szükségességére a gyógyszerfejlesztésben, és bár úgy értelmezhető, hogy támogatja az egymolekulás terápiás modellt (Bonn-Miller és mtsai., 2018), hangsúlyozni kell, hogy a komplex botanikai szerek megfelelhetnek az amerikai FDA szabványoknak (Food and Drug Administration, 2015). Konkrétan két kannabiszalapú gyógyszer érte el a hatósági engedélyt, a Sativex® (nabiximolok, USA-ban elfogadott név) 30 országban, és az Epidiolex® az Egyesült Államokban.
Ezután felmerül a kérdés: Lehet-e egy Cannabis-készítmény vagy egyetlen molekula túl tiszta, ezáltal csökkentve a szinergikus potenciált? A legújabb adatok alátámasztják ezt, mint határozott lehetőséget. A magas CBD-tartalmú Cannabis-kivonatokat súlyos epilepszia, például a Dravet- és Lennox-Gastaut-szindróma kezelésére alkalmazó klinikusoktól származó anekdotikus információk azt mutatták, hogy betegeik a rohamgyakoriság jelentős javulását mutatták (Goldstein, 2016; Russo, 2017; Sulak et al., 2017), jóval alacsonyabb dózisokkal, mint amiről az Epidiolex, egy 97%-ban tiszta, THC-t eltávolított CBD-készítmény hivatalos klinikai vizsgálataiban beszámoltak (Devinsky et al., 2016, 2017, 2018; Thiele et al., 2018). Ezt a megfigyelést nemrégiben 11, összesen 670 beteggel végzett vizsgálat metaanalízisének vetették alá (Pamplona et al., 2018). Ezek az eredmények azt mutatták, hogy a betegek 71%-a javult a CBD-tartalmú Cannabis-kivonatokkal szemben a tisztított CBD 36%-ával (p < 0,0001). A rohamgyakoriság 50%-os javulásánál a két csoportban statisztikailag nem volt különbség, és mindkét csoport a betegek körülbelül 10%-ánál érte el a rohammentességet. Az átlagos napi adagok azonban jelentősen eltértek a csoportok között: 27,1 mg/kg/d a tisztított CBD esetében, míg a CBD-ben gazdag Cannabis-kivonatok esetében csak 6,1 mg/kg/d., ami a csak CBD-vel kezelt adagnak csak 22,5%-a. Továbbá az enyhe és súlyos mellékhatások előfordulása kimutathatóan magasabb volt a tisztított CBD-vel szemben a magas CBD-kivonattal kezelt betegeknél (p < 0,0001), ezt az eredményt a szerzők az alkalmazott alacsonyabb dózisnak tulajdonították, amelyet véleményük szerint a többi kísérő vegyület szinergista hozzájárulása révén értek el. Ezek a megfigyelések alátámasztják a több görcsoldó komponenst, például CBD-t, THC-t, THCA-t, THCV-t, CBDV-t, linaloolt, sőt még karyophyllene-t is kombináló Cannabis-kivonatok nagyobb hatékonyságának hipotézisét (Lewis et al., 2018).
Ezek és más tanulmányok szilárd alapot nyújtanak a Cannabis szinergiájára, és támogatják a növényi gyógyszerfejlesztést az egyes komponensek (Bonn-Miller et al., 2018) vagy az élesztőben vagy más mikroorganizmusokban történő fermentációs módszerekkel történő előállítással szemben. A hagyományos szelektív nemesítés erejének egyik példája (2. ábra) a CaryodiolTM névre keresztelt Cannabis kemovariáns, amely a CB2 agonistaként fokozott karyofilén-tartalma (0,83%), valamint a rendkívül kedvező, 1:39,4 THC:CBD III. típusú THC:CBD arány mellett készült. Egy ilyen készítmény számos klinikai állapot kezelésében alkalmazhatónak ígérkezik, többek között: fájdalom, gyulladás, fibrotikus rendellenességek, függőség, szorongás, depresszió, autoimmun betegségek, bőrgyógyászati állapotok és rák (Pacher és Mechoulam, 2011; Russo, 2011; Xi et al., 2011; Russo és Marcu, 2017; Lewis et al., 2018). Egy ilyen kombináció mikrobiális forrásokból történő előállításához több élesztőfajból származó kannabinoidok kombinációjára lehet szükség, és ennek következtében olyan kombinált terméket jelentene, amely nehéz szabályozási útnak van kitéve, szemben az egyetlen faj kivonataiból készült kannabiszkészítményekkel (pl. nabiximol), amelyeket világszerte 30 országban egységes készítményként fogadtak el (Food and Drug Administration, 2015).
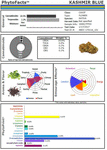
2. ábra. A CaryodiolTM, más néven “Kashmir Blue”, egy III. típusú, kannabidiol- és karyofilén-predomináns kemovariáns kannabinoid- és terpenoidtartalmának PhytoFactsTM ábrázolása. A PhytoFacts és a hagyományos nemesítési módszertan részleteit lásd (Lewis et al., 2018). Copyright© 2016 BHC Group, LLC. Minden jog fenntartva. E dokumentum vagy a fenti képek vagy jelek bármilyen jogosulatlan felhasználása sértheti a szerzői jogokat, a védjegyeket és más vonatkozó törvényeket.
Ez a cikk röviden felvázolta a közelmúlt technológiai kísérleteit a “fitokannabinoid kerék újra feltalálására”. Meggyőző érvek támasztják alá, hogy ez megtehető, de meg kell-e tenni? A Cannabis szinergia létezését alátámasztó adatok és a Cannabis genomjának elképesztő plaszticitása olyan valóságot sugall, amely szükségtelenné teszi az alternatív gazdaszervezetek, vagy akár a Cannabis sativa géntechnológiájának szükségességét, így bizonyítva, hogy “A növény jobban csinálja”.”
A szerzői hozzájárulások
A szerző megerősíti, hogy ő az egyedüli szerzője ennek a munkának, és jóváhagyta annak közzétételét.
Kérdések összeférhetetlenségi nyilatkozata
A Nemzetközi Cannabis és Cannabinoid Intézet kutatási igazgatója vagyok. A kannabiszkereskedelemmel foglalkozó ügyfeleket szolgáljuk.
Köszönet
A szerző nagyra értékeli a Montanai Egyetem Mansfield Könyvtár Könyvtár Könyvtárközi Kölcsönzési Irodájának munkatársainak segítségét a kutatási anyagok rendelkezésre bocsátásában.
Anderson, L. C. (1980). Levélváltozatok a Cannabis fajok között egy ellenőrzött kertben. Bot. Mus. Lealf. Harv. Univ. 28, 61-69.
Google Scholar
Appendino, G., Taglialatela-Scafati, O., Minassi, A., Pollastro, F., Ballero, L. M., Maxia, A., et al. (2015). Helichrysum italicum: a mediterrán gyógynövénygyógyászat alvó óriása. Herbalgram 105, 34-45.
Google Scholar
Bailey, L. H., and Bailey, E. Z. (1976). Hortus Third: Az Egyesült Államokban és Kanadában termesztett növények tömör szótára. New York, NY: Macmillan.
Google Scholar
Ben-Shabat, S., Fride, E., Sheskin, T., Tamiri, T., Rhee, M. H., Vogel, Z., et al. (1998). Egy kísérő hatás: az inaktív endogén zsírsav-glicerinészterek fokozzák a 2-arachidonoil-glicerin kannabinoid aktivitást. Eur. J. Pharmacol. 353, 23-31. doi: 10.1016/S0014-2999(98)00392-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Berman, P., Futoran, K., Lewitus, G. M., Mukha, D., Benami, M., Shlomi, T., et al. (2018). Egy új ESI-LC/MS megközelítés a Cannabisban található fitokannabinoidok átfogó metabolikus profiljának meghatározására. Sci. Rep. 8:14280. doi: 10.1038/s41598-018-32651-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Blasco-Benito, S., Seijo-Vila, M., Caro-Villalobos, M., Tundidor, I., Andradas, C., Garcia-Taboada, E., et al. (2018). Az “entourage-hatás” értékelése: egy tiszta kannabinoid kontra egy növényi gyógyszerkészítmény tumorellenes hatása az emlőrák preklinikai modelljeiben. Biochem. Pharmacol. 157, 285-293. doi: 10.1016/j.bcp.2018.06.025
PubMed Abstract | CrossRef Full Text | Google Scholar
Bohlmann, F., and Hoffmann, E. (1979). Cannabigerol-ahnliche verbindungen aus Helichrysum umbraculigerum. Phytochemistry 18, 1371-1374. doi: 10.1016/0031-9422(79)83025-3
CrossRef Full Text | Google Scholar
Bonn-Miller, M. O., ElSohly, M. A., Loflin, M. J. E., Chandra, S., and Vandrey, R. (2018). Cannabis és kannabinoid gyógyszerfejlesztés: a botanikai versus egymolekulás megközelítések értékelése. Int. Rev. Psychiatry 30, 277-284. doi: 10.1080/09540261.2018.1474730
PubMed Abstract | CrossRef Full Text | Google Scholar
Booth, J. K., Page, J. E., and Bohlmann, J. (2017). Terpénszintázok a Cannabis sativából. PLoS One 12:e0173911. doi: 10.1371/journal.pone.0173911
PubMed Abstract | CrossRef Full Text | Google Scholar
Brickell, C. D., Alexander, C., David, J. C., Hetterscheid, W. L. A., Leslie, A. C., Malecot, V., et al. (2009). A termesztett növények nemzetközi nómenklatúrájának kódexe. Leuven: International Society for Horticultural Science.
Google Scholar
Carvalho, A., Hansen, E. H., Kayser, O., Carlsen, S., and Stehle, F. (2017). Mikroorganizmusok tervezése kannabinoidok heterológ bioszintéziséhez. FEMS Yeast Res. 17:fox037. doi: 10.1093/femsyr/fox037
PubMed Abstract | CrossRef Full Text | Google Scholar
Clarke, R. C., and Merlin, M. D. (2013). Cannabis: Evolution and Ethnobotany. Berkeley, CA: University of California Press.
Google Scholar
Clarke, R. C., and Merlin, M. D. (2016). A kannabisz háziasítása, tenyésztéstörténete, mai genetikai sokféleség és jövőbeli kilátások. Crit. Rev. Plant Sci. 35, 293-327. doi: 10.1080/07352689.2016.1267498
CrossRef Full Text | Google Scholar
Cunha, J. M., Carlini, E. A., Pereira, A. E., Ramos, O. L., Pimentel, C., Gagliardi, R., et al. (1980). Cannabidiol krónikus adagolása egészséges önkénteseknek és epilepsziás betegeknek. Pharmacology 21, 175-185. doi: 10.1159/000137430
PubMed Abstract | CrossRef Full Text | Google Scholar
Datwyler, S. L., and Weiblen, G. D. (2006). Genetikai variáció a kenderben és a marihuánában (Cannabis sativa L.) az amplifikált töredékhosszúságú polimorfizmusok szerint. J. Forensic Sci. 51, 371-375. doi: 10.1111/j.1556-4029.2006.00061.x
PubMed Abstract | CrossRef Full Text | Google Scholar
de Meijer, E. (2004). “The breeding of cannabis cultivars for pharmaceutical end uses,” in Medicinal Uses of Cannabis and Cannabinoids, eds G. W. Guy, B. A. Whittle, and P. Robson (London: Pharmaceutical Press), 55-70.
Google Scholar
de Meijer, E. P., Bagatta, M., Carboni, A., Crucitti, P., Moliterni, V. M., Ranalli, P., et al. (2003). The inheritance of chemical phenotype in Cannabis sativa L. Genetics 163, 335-346.
PubMed Abstract | Google Scholar
de Meijer, E. P. M., and Hammond, K. M. (2005). A kémiai fenotípus öröklődése a Cannabis sativa L.-ben (II): cannabigerol-túlsúlyos növények. Euphytica 145, 189-198. doi: 10.1007/s10681-005-1164-8
CrossRef Full Text | Google Scholar
de Meijer, E. P. M., Hammond, K. M., and Micheler, M. (2009a). A kémiai fenotípus öröklődése a Cannabis sativa L.-ben (III): a cannabichromén arányának változása. Euphytica 165, 293-311.
Google Scholar
de Meijer, E. P. M., Hammond, K. M., and Sutton, A. (2009b). A kémiai fenotípus öröklődése a Cannabis sativa L.-ben (IV): kannabinoidmentes növények. Euphytica 168, 95-112.
Google Scholar
Devinsky, O., Cross, J. H., Laux, L., Marsh, E., Miller, I., Nabbout, R., et al. (2017). A kannabidiol kipróbálása gyógyszerrezisztens rohamok kezelésére a Dravet-szindrómában. N. Engl. J. Med. 376, 2011-2020. doi: 10.1056/NEJMoa1611618
PubMed Abstract | CrossRef Full Text | Google Scholar
Devinsky, O., Marsh, E., Friedman, D., Thiele, E., Laux, L., Sullivan, J., et al. (2016). Cannabidiol kezelésre rezisztens epilepsziás betegeknél: egy nyitott beavatkozási vizsgálat. Lancet Neurol. 15, 270-278. doi: 10.1016/S1474-4422(15)00379-8
CrossRef Full Text | Google Scholar
Devinsky, O., Patel, A. D., Thiele, E. A., Wong, M. H., Appleton, R., Harden, C. L., et al. (2018). A kannabidiol véletlenszerű, dózisméretű biztonsági vizsgálata Dravet-szindrómában. Neurology 90, e1204-e1211. doi: 10.1212/WNL.00000000000000005254
PubMed Abstract | CrossRef Full Text | Google Scholar
Dufresnes, C., Jan, C., Bienert, F., Goudet, J., and Fumagalli, L. (2017). A Cannabis széles körű genetikai diverzitása igazságügyi alkalmazásokhoz. PLoS One 12:e0170522. doi: 10.1371/journal.pone.0170522
PubMed Abstract | CrossRef Full Text | Google Scholar
Elzinga, S., Fischedick, J., Podkolinski, R., and Raber, J. C. (2015). Cannabinoidok és terpének mint kemotaxonómiai markerek a kannabiszban. Nat. Prod. Chem. Res. 3:181.
Google Scholar
Farhi, M., Marhevka, E., Masci, T., Marcos, E., Eyal, Y., Ovadis, M., et al. (2011). Élesztő szubcelluláris kompartmentek hasznosítása növényi terpenoidok előállítására. Metab. Eng. 13, 474-481. doi: 10.1016/j.ymben.2011.05.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Food and Drug Administration (2015). Botanical Drug Development Guidance for Industry, szerk. U.S.D.o.H.a.H. Services (Washington, DC: Food and Drug Administration). doi: 10.1016/j.ymben.2011.05.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Fuchs, L. (1999). Leonhart Fuchs nagy gyógynövénye: De Historia Stirpium Commentarii Insignes, 1542 (Nevezetes kommentárok a növények történetéhez). Stanford, CA: Stanford University Press.
Google Scholar
Gallily, R., Yekhtin, Z., and Hanus, L. (2014). A kannabidiol harang alakú dózis-válaszának leküzdése kannabidiolban dúsított kannabiszkivonat alkalmazásával. Pharmacol. Pharm. 6, 75-85. doi: 10.4236/pp.2015.62010
CrossRef Full Text | Google Scholar
Gaoni, Y., and Mechoulam, R. (1964). A hasis egyik aktív összetevőjének izolálása, szerkezete és részleges szintézise. J. Am. Chem. Soc. 86, 1646-1647. doi: 10.1021/ja01062a046
CrossRef Full Text | Google Scholar
Goldstein, B. (2016). Cannabis a gyermekkori epilepszia kezelésében. Chicago, IL: O’Shaughnessy’s, 7-9.
Google Scholar
Hillig, K. W. (2005a). Agronómiai tulajdonságok és allozim allélfrekvenciák kombinált elemzése 69 Cannabis hozzáférés esetében. J. Ind. Hemp 10, 17-30. doi: 10.1300/J237v10n01_03
CrossRef Full Text | Google Scholar
Hillig, K. W. (2005b). Genetikai bizonyítékok a Cannabis (Cannabaceae) fajképződésére. Genet. Resour. Crop Evol. 52, 161-180. doi: 10.1007/s10722-003-4452-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Hillig, K. W., and Mahlberg, P. G. (2004). A Cannabis (Cannabaceae) kannabinoid-variációjának kemotaxonómiai elemzése. Am. J. Bot. 91, 966-975. doi: 10.3732/ajb.91.6.966
PubMed Abstract | CrossRef Full Text | Google Scholar
Johnson, J. R., Burnell-Nugent, M., Lossignol, D., Ganae-Motan, E. D., Potts, R., and Fallon, M. T. (2010). Multicentrikus, kettős vak, randomizált, placebo-kontrollált, párhuzamos csoportos vizsgálat a THC:CBD kivonat és a THC-kivonat hatékonyságáról, biztonságosságáról és tolerálhatóságáról nehezen kezelhető, rákos betegeknél. J. Pain Symptom Manage. 39, 167-179. doi: 10.1016/j.jpainsymman.2009.06.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Lamarck, J. B. (1783). Encyclopédie Méthodique Botanique. Paris: Chez Panckoucke.
Lewis, M. A., Russo, E. B., and Smith, K. M. (2018). A Cannabis kemovarák farmakológiai alapjai. Planta Med. 84, 225-233. doi: 10.1055/s-0043-122240
PubMed Abstract | CrossRef Full Text | Google Scholar
Linnaeus, C. (1753). Species Plantarum. Holmiae: Laurentii Salvii.
Google Scholar
McPartland, J., Guy, G. W., and Hegman, W. (2018). A kannabisz őshonos Európában, és a termesztés a réz- vagy bronzkorban kezdődött: a fosszilis pollenvizsgálatok valószínűségi szintézise. Veg. His. Archaeobot. 27, 635-648. doi: 10.1007/s00334-018-0678-7
CrossRef Full Text | Google Scholar
McPartland, J. M. (2018). A kannabisz szisztematikája a család, a nemzetség és a faj szintjén. Cannabis Cannabinoid Res. 3, 203-212. doi: 10.1089/can.2018.0039
PubMed Abstract | CrossRef Full Text | Google Scholar
McPartland, J. M., Clarke, R. C., and Watson, D. P. (2000). Kender betegségek és kártevők: Management and Biological Control. Wallingford: CABI. doi: 10.1079/9780851994543.0000
CrossRef Full Text | Google Scholar
McPartland, J. M., and Guy, G. W. (2017). A kannabisz taxonómiájának modelljei, kulturális előítéletek, valamint a tudományos és a népnyelvi nevek közötti konfliktusok. Bot. Rev. 83, 327-381. doi: 10.1007/s12229-017-9187-0
CrossRef Full Text | Google Scholar
McPartland, J. M., and Mediavilla, V. (2001). “Non-cannabinoids in cannabis,” in Cannabis and Cannabinoids, eds F. Grotenhermen and E. B. Russo (Binghamton, NY: Haworth Press), 401-409.
Google Scholar
McPartland, J. M., and Pruitt, P. L. (1999). Gyógyszerek mellékhatásai, amelyeket a hasonló növényi gyógyszerek nem váltanak ki: a tetrahidrokannabinol és a marihuána esete. Altern. Ther. Health Med. 5, 57-62.
Google Scholar
McPartland, J. M., and Russo, E. B. (2001). Cannabis és kannabiszkivonatok: nagyobbak, mint a részek összege? J. Cannabis Ther. 1, 103-132. doi: 10.1300/J175v01n03_08
CrossRef Full Text | Google Scholar
McPartland, J. M., and Russo, E. B. (2014). “A kannabisz nem-fitokannabinoid összetevői és a növényi szinergia”, in Handbook of Cannabis, szerk. R. G. Pertwee (Oxford: Oxford University Press), 280-295.
Google Scholar
Mechoulam, R., and Ben-Shabat, S. (1999). A gan-zi-gun-nu-tól az anandamidig és a 2-arachidonoilglicerinig: a kannabisz folyamatos története. Nat. Prod. Rep. 16, 131-143. doi: 10.1039/a703973e
PubMed Abstract | CrossRef Full Text | Google Scholar
Oswald, M., Fischer, M., Dirninger, N., and Karst, F. (2007). Monoterpenoid bioszintézis a Saccharomyces cerevisiae-ben. FEMS Yeast Res. 7, 413-421. doi: 10.1111/j.1567-1364.2006.00172.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Pacher, P., and Mechoulam, R. (2011). A cannabinoid 2 receptorokon keresztül történő lipidjelzés egy védelmi rendszer része? Prog. Lipid Res. 50, 193-211. doi: 10.1016/j.plipres.2011.01.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Pamplona, F. A., da Silva, L. R., and Coan, A. C. (2018). A CBD-ben gazdag Cannabis-kivonatok potenciális klinikai előnyei a tisztított CBD-vel szemben a kezelésre rezisztens epilepsziában: megfigyelési adatok metaanalízise. Front. Neurol. 9:759. doi: 10.3389/fneur.2018.00759
PubMed Abstract | CrossRef Full Text | Google Scholar
Piomelli, D., and Russo, E. B. (2016). A Cannabis sativa versus Cannabis indica vita: interjú Dr. Ethan Russóval. Cannabis Cannabinoid Res. 1, 44-46. doi: 10.1089/can.2015.29003.ebr
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B. (2007). A kannabisz és készítményeinek története a mondában, a tudományban és a szóbeszédben. Chem. Biodivers. 4, 1614-1648. doi: 10.1002/cbdv.200790144
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B. (2011). A THC megszelídítése: a kannabisz lehetséges szinergiája és a fitokannabinoid-terpenoidok kísérőhatásai. Br. J. Pharmacol. 163, 1344-1364. doi: 10.1111/j.1476-5381.2011.01238.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B. (2016). A kannabiszon túl: növények és az endokannabinoid rendszer. Trends Pharmacol. Sci. 37, 594-605. doi: 10.1016/j.tips.2016.04.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B. (2017). Cannabis és epilepszia: egy ősi kezelés visszatér az előtérbe. Epilepsy Behav. 70(Pt B), 292-297. doi: 10.1016/j.yebeh.2016.09.040
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B., Jiang, H. E., Li, X., Sutton, A., Carboni, A., del Bianco, F., et al. (2008). Közép-Ázsiából származó ősi kannabisz fitokémiai és genetikai elemzése. J. Exp. Bot. 59, 4171-4182. doi: 10.1093/jxb/ern260
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B., and Marcu, J. (2017). Cannabis farmakológia: a szokásos gyanúsítottak és néhány ígéretes nyom. Adv. Pharmacol. 80, 67-134. doi: 10.1016/bs.apha.2017.03.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B., and McPartland, J. M. (2003). A kannabisz több mint egyszerű Delta(9)-tetrahidrokannabinol. Psychopharmacology 165, 431-432. doi: 10.1007/s00213-002-1348-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Sawler, J., Stout, J. M., Gardner, K. M., Hudson, D., Vidmar, J., Butler, L., et al. (2015). A marihuána és a kender genetikai szerkezete. PLoS One 10:e0133292. doi: 10.1371/journal.pone.0133292
PubMed Abstract | CrossRef Full Text | Google Scholar
Schultes, R., Klein, W., Plowman, T., and Lockwood, T. (1974). Cannabis: a taxonómiai elhanyagolás példája. Bot. Mus. Lealf. Harv. Univ. 23, 337-367.
Google Scholar
Shoyama, Y., Takeuchi, A., Taura, F., Tamada, T., Adachi, M., Kuroki, R., et al. (2005). A Cannabis sativából származó Delta1-tetrahidrokannabinolsav (THCA) szintáz kristályosítása. Acta Crystallogr. Sect. F Struct. Biol. Cryst. Commun. 61(Pt 8), 799-801. doi: 10.1107/S1744309105023365
PubMed Abstract | CrossRef Full Text | Google Scholar
Sirikantaramas, S., Morimoto, S., Shoyama, Y., Ishikawa, Y., Wada, Y., Shoyama, Y., et al. (2004). A marihuána pszichoaktivitását szabályozó gén: a Cannabis sativa L. Delta1-tetrahidrokannabinolsav-szintáz molekuláris klónozása és heterológ expressziója J. Biol. Chem. 279, 39767-39774. doi: 10.1074/jbc.M403693200
PubMed Abstract | CrossRef Full Text | Google Scholar
Small, E. (2015). A Cannabis sativa (marihuána, kender) evolúciója és osztályozása az emberi felhasználás szempontjából. Bot. Rev. 81, 189-294. doi: 10.1007/s12229-015-9157-3
CrossRef Full Text | Google Scholar
Small, E. (2017). Cannabis: A Complete Guide. Boca Raton, FL: CRC Press.
Google Scholar
Small, E., and Cronquist, A. (1976). A Cannabis gyakorlati és természetes taxonómiája. Taxon 25, 405-435. doi: 10.2307/1220524
CrossRef Full Text | Google Scholar
Small, E., and Marcus, D. (2003). Tetrahidrokannabinolszintek a kender (Cannabis sativa) csíraplazmaforrásokban. Econ. Bot. 57, 545-558. doi: 10.1663/0013-0001(2003)0572.0.CO;2
CrossRef Full Text | Google Scholar
Song, B.-H., Wang, X.-Q., Li, F.-Z., and Hong, D.-Y. (2001). Újabb bizonyítékok a Celtidaceae parafíliára a kloroplasztisz génmat K. Plant Syst. Evol. 228, 107-115. doi: 10.1007/s006060170041
CrossRef Full Text | Google Scholar
Sulak, D., Saneto, R., and Goldstein, B. (2017). A kézműves kannabisz jelenlegi helyzete az epilepszia kezelésében az Egyesült Államokban. Epilepsy Behav. 70(Pt B), 328-333. doi: 10.1016/j.yebeh.2016.12.032
PubMed Abstract | CrossRef Full Text | Google Scholar
Taura, F., Dono, E., Sirikantaramas, S., Yoshimura, K., Shoyama, Y., and Morimoto, S. (2007). Delta(1)-tetrahidrokannabinolsav előállítása transzgenikus Pichia pastorisból szekretált bioszintetikus enzimmel. Biochem. Biophys. Res. Commun. 361, 675-680. doi: 10.1016/j.bbrc.2007.07.07.079
PubMed Abstract | CrossRef Full Text | Google Scholar
Taura, F., Morimoto, S., and Shoyama, Y. (1996). Cannabidiolic-sav-szintáz tisztítása és jellemzése Cannabis sativa L-ből. Egy új enzim biokémiai elemzése, amely a cannabigerolsav cannabidiolic-savvá oxidociklizálását katalizálja. J. Biol. Chem. 271, 17411-17416. doi: 10.1074/jbc.271.29.17411
PubMed Abstract | CrossRef Full Text | Google Scholar
Thiele, E. A., Marsh, E. D., French, J. A., Mazurkiewicz-Beldzinska, M., Benbadis, S. R., Joshi, C., et al. (2018). Cannabidiol Lennox-Gastaut-szindrómához társuló rohamokban szenvedő betegeknél (GWPCARE4): randomizált, kettős vak, placebokontrollált 3. fázisú vizsgálat. Lancet 391, 1085-1096. doi: 10.1016/S0140-6736(18)30136-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Usher, G. (1996). A botanika szókincses szótára. Ware: Wordsworth Reference.
van Bakel, H., Stout, J. M., Cote, A. G., Tallon, C. M., Sharpe, A. G., Hughes, T. R., et al. (2011). A Cannabis sativa genomjának és transzkriptomjának tervezete. Genome Biol. 12:R102. doi: 10.1186/gb-2011-12-10-r102
PubMed Abstract | CrossRef Full Text | Google Scholar
Weigreffe, S. J., Sytsma, K. J., and Guries, R. P. (1998). Az Ulmaceae, egy család vagy két család? Evidence from chloroplast DNA restriction site mapping. Plant Syst. Evol. 210, 249-270. doi: 10.1007/BF00985671
CrossRef Full Text | Google Scholar
Wilkinson, J. D., Whalley, B. J., Baker, D., Pryce, G., Constanti, A., Gibbons, S., et al. (2003). Gyógyászati kannabisz: szükséges-e a delta9-tetrahidrokannabinol minden hatásához? J. Pharm. Pharmacol. 55, 1687-1694. doi: 10.1211/0022357022304
PubMed Abstract | CrossRef Full Text | Google Scholar
Wirtshafter, D. (1997). “A kendermag és a kendermagolaj táplálkozási értéke”, in Cannabis in Medical Practice, szerk. M. L. Mathre (Jefferson, NC: McFarland and Company), 181-191.
Google Scholar
Xi, Z. X., Peng, X. Q., Li, X., Song, R., Zhang, H. Y., Liu, Q. R., et al. (2011). Az agyi kannabinoid CB(2) receptorok modulálják a kokain hatását egerekben. Nat. Neurosci. 14, 1160-1166. doi: 10.1038/nn.2874
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, M.-Q., van Velzen, R., Bakker, F. T., Sattarian, A., Li, D.-Z., and Yi, T.-S. (2013). A Cannabaceae molekuláris filogenetikája és karakterfejlődése. Taxon 62, 473-485. doi: 10.12705/623.9
CrossRef Full Text | Google Scholar
Zirpel, B., Degenhardt, F., Martin, C., Kayser, O., and Stehle, F. (2017). Élesztők, mint a kannabinoid-bioszintézis platformszervezeteinek mérnöki megtervezése. J. Biotechnol. 259, 204-212. doi: 10.1016/j.jbiotec.2017.07.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Zirpel, B., Degenhardt, F., Zammarelli, C., Wibberg, D., Kalinowski, J., Stehle, F., et al. (2018). A Delta(9)-tetrahidrokannabinolsav-szintáz termelésének optimalizálása a Komagataella phaffii-ban poszt-transzlációs szűk keresztmetszetek azonosításán keresztül. J. Biotechnol. 272-273, 40-47. doi: 10.1016/j.jbiotec.2018.03.008
PubMed Abstract | CrossRef Full Text