- Bevezetés
- Anyagok és módszerek
- Tagadók
- Mágneses rezonancia képalkotás
- Adatgyűjtés és feldolgozás
- Atlaszkivonat
- Statisztikai elemzés
- Eredmények
- Az SCA3-as betegek szignifikáns elváltozásokat mutattak ki a tipikus infratentoriális elváltozások régióiban
- Az SCA3-ban szenvedő betegek agyi lateralizált szupratentoriális elváltozásokat tártak fel
- Diszkusszió
- Következtetések
- Adatok elérhetőségi nyilatkozata
- Etikai nyilatkozat
- A szerzők hozzájárulása
- Finanszírozás
- Érdekütközés
- Köszönet
- Kiegészítő anyagok
Bevezetés
A 3-as típusú spinocerebelláris ataxia (SCA3) egy örökletes neurodegeneratív betegség, amelyet a 14q32.1 kromoszóma kódoló régiójának CAG-expanziója okoz (1, 2). Klinikailag az SCA3-ban szenvedő betegeknél kisagyi szindróma, parkinsonizmus, ataxiás járás, diszartria, diszmetria, nystagmus, perifériás neuropátia, piramidális és extrapiramidális manifesztációk jelentkeznek (3-5). Az SCA3-ban szenvedő betegek érzelmi károsodástól, például depressziótól és szorongástól is szenvedtek (6, 7). Az SCA3 ezen magasabb rendű működési zavarai a neurodegeneráció hagyományos “olivopontocerebelláris” mintája helyett az extracerebelláris struktúrák további érintettségére utalnak (8-12). Emellett az SCA3-rendellenességet kisagyi kognitív affektív szindrómaként (CCAS) is leírták (6, 8).
Tanulmányokban pozitronemissziós tomográfiát (PET) és egyfotonemissziós komputertomográfiát használtak az agykéreg szubklinikai rendellenességeinek azonosítására (13, 14). Ezek a vizsgálatok azonban arról számoltak be, hogy a cerebrocerebelláris pálya zavara nem magyarázza meg teljesen az SCA3-ban szenvedő betegek kognitív és affektív károsodását. Például az SCA3-ban szenvedő betegek vizuospatialis deficitjei markánsan a parietális lebenyhez kapcsolódnak, és kevésbé kapcsolódnak a kisagyhoz. Kevés tanulmány foglalkozott a szupratentoriális régiók szerepével az SCA3-ban. A szupratentoriális régiók degenerációjának számszerűsítése kulcsfontosságú lehet az SCA3-ban szenvedő betegek működési zavarainak értékelésében. Az idegrendszeri képalkotó vizsgálatokban a regionális agykérgi atrófia mérése kulcsfontosságú a kognitív károsodással és az érzelmi diszfunkcióval való összefüggés értékeléséhez.
A diffúziós tenzor képalkotás (DTI) megkönnyítheti a fehérállomány (WM) láthatóvá tételét és jellemzését, és a DTI hatékony módszer az SCA3 vizsgálatára is (15). Az SCA3-t WM-domináns atrófiás neurodegeneratív betegségként igazolták (16). Korábbi vizsgálatok azt mutatták, hogy az SCA3-ban szenvedő betegek a kisagy és az agytörzs területein a frakcionális anizotrópia (FA) csökkenését mutatják, de a kisagyban, az agytörzsben, a talamuszban, valamint a frontális és temporális lebenyekben a radiális diffúzitás (RD) növekedését (17). Egy másik DTI-vizsgálat széles körű FA-csökkenést azonosított a kétoldali cerebralis-frontális, -parietális, -temporális és -occipitális WM-ben; a kisagyi WM-ben; a talamuszban; és az agytörzsben SCA3-ban szenvedő betegeknél (16). Ezenkívül az átlagos diffuzivitás (MD) növekedését hasonló, egymást nagymértékben átfedő mintázatban észlelték a kétoldali cerebrális-frontális, -parietális, -temporális és -occipitális WM-ben; a kisagyi WM-ben; a talamuszban; és az agytörzsben (16).
Ezzel a vizsgálattal a viszonylag fokális régiók atrófiáját értékeltük, és megmagyaráztuk a supratentoriális érintettséget SCA3-ban. Ebben a tanulmányban a fraktáldimenzió (FD) módszerét alkalmaztuk, amelynek előnye, hogy minimális szórású eredményeket produkál (18), az agykérgi morfológiai változások számszerűsítésére és a szupratentoriális régiók regionális agykérgi atrófiájának mérésére. Jelen vizsgálatban minden egyes résztvevő esetében megmértük a szürkeállomány 97 szegmensének 3D-FD értékeit a teljes agyból. Továbbá összehasonlítjuk ezeket a szürkeállomány-elváltozások eredményeit a közelmúltban végzett vizsgálatunk SCA3-ban előforduló fehérállomány-elváltozások DTI-elemzésével. Azt vártuk, hogy a vizsgált GM-elváltozások régiói ebben a tanulmányban kapcsolatban állnak a DTI-vizsgálatból származó WM-elváltozások régióival, és az eredmény igazolhatja a motoros károsodás és a szupratentoriális régiók atrófiája közötti összefüggést SCA3-ban szenvedő betegeknél.
Anyagok és módszerek
Tagadók
A vizsgálatban összesen 48 SCA3-ban szenvedő beteg és 50, nemben és életkorban illeszkedő egészséges személy, mint kontrollcsoport vett részt. A vizsgálatot a Helsinki Nyilatkozatnak megfelelően végeztük, és a Taipei Veterans General Hospital intézményi felülvizsgálati bizottsága hagyta jóvá. A vizsgálatban való részvétel előtt minden résztvevő írásbeli beleegyezését adta. Minden résztvevőt a Taipei Veterans General Hospital radiológiai osztályáról toboroztak. A SARA-t (az ataxia felmérésére és értékelésére szolgáló skála) alkalmazták az SCA3-ban szenvedő betegek ataxiájának klinikai értékelésére (19). Az SCA3-ban a Parkinson-kór progressziójának tüneteit a módosított Hoehn és Yahr-féle stádiumbeosztás alkalmazásával mérték (20). A SARA pontszámot, amely az ataxia tüneteinek súlyosságát 0 és 40 között értékelte, referenciaként használták a klinikai súlyosság progressziójának jelzésére a kisagyi degenerációhoz képest. Minden betegtől beszereztük az önbevallás szerinti kezdeti életkort, vagyis azt az életkort, amikor a betegeknél először jelentkezett valamelyik ataxiás tünet (21). Az egyes SCA3 betegek CAG ismétlődési hosszát polimeráz láncreakcióval határoztuk meg, a korábban leírtak szerint (22). Az 1. táblázat mindkét csoport demográfiai, klinikai és MR-képalkotó adatait mutatja be. Az SCA3-as betegek akkor feleltek meg a felvételi kritériumoknak, ha progresszív és egyébként megmagyarázhatatlan ataxiájuk volt, és pozitív volt a tesztjük az SCA3 genotípusra. Az SCA3-as betegeknél a betegség időtartama 8,89 ± 6,432 év volt. A kontrollcsoportba tartozóknak nem volt központi idegrendszeri betegségük, és nem mutattak semmilyen neurológiai eltérést a vizsgálati időszak alatt. A kontrollcsoport T1- és T2-súlyozott felvételeit tapasztalt neuroradiológus vizsgálta, hogy megbizonyosodjon arról, hogy nincs-e más neurológiai betegségre utaló fedetlen jel vagy váratlan eltérés.
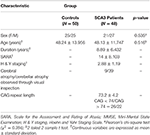
1. táblázat. A kontrollcsoport és a betegcsoport demográfiai, klinikai és MR-képi adatai.
Mágneses rezonancia képalkotás
Adatgyűjtés és feldolgozás
A teljes agyvelőt és kisagyat lefedő tengelyirányú emberi agyi MR-felvételeket 1,5-T Vision Siemens szkennerrel (Erlangen, Németország) készítettük. A résztvevőket körkörösen polarizált fejtekercs segítségével szkennelték, hogy T1-súlyozott képeket kapjanak (TR = 14,4 ms; TE = 5,5 ms; mátrixméret: 256 × 256; 1,5 mm-es axiális szeletek; FOV = 256 × 256 mm2; voxelméret, 1,0 × 1,0 × 1,5 mm3, szeletszám = 128). Az egyes résztvevők T1-súlyozott képeit axiális képpé formáztuk és az MRIcro szoftverrel (Chris Rorden, University of Nottingham, UK; www.sph.sc.edu/comd/rorden/mricro.html) elemzési formátumba konvertáltuk. Az 1. ábra az adatfeldolgozás és a statisztikai elemzés folyamatábráját szemlélteti. Az agyszövetek kivonásának pontosságának javítása érdekében az MRIcro szoftver agykivonási eszközének segítségével egy automatikus koponyacsíkozási funkciót alkalmaztunk a képtérfogatokra (1B. ábra). A további folyamatokat a DiffeoMap (Li, X.; Jiang, H.; és Mori, S.; Johns Hopkins University, www.MriStudio.org) segítségével végeztük. Ebben az eljárásban egy 12 paraméteres affin transzformációt (23) használtunk az egyes T1-súlyozott képek normalizálásához a JHU_MNI_SS_SS_T_ss T1 sablon felé.
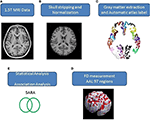
1. ábra. (A-E) A képfeldolgozás és a statisztikai elemzés menete.
Atlaszkivonat
A képi adatok feldolgozását az SPM8 toolbox (Wellcome Department of Cognitive Neurology, Institute of Neurology, University College London, London, UK, http://www.fil.ion.ucl.ac.uk/spm/) és az IBASPM toolbox (Individual Brain Atlases using Statistical Parametric Mapping, http://www.thomaskoenig.ch/Lester/ibaspm.htm) segítségével hajtottuk végre, mindkettő a MATLAB 2010 szoftverrel (Mathworks, Natick, MA, USA).
Az eljárás a normalizálás után három lépést tartalmaz: (1) a normalizált kép szegmentálása szürkeállományra, fehérállományra és agyi gerincvelői folyadékra a natív térben, (2) a szürkeállomány parcellázása 116 régióra a Montreali Neurológiai Intézet (MNI) anatómiai atlaszának (24) anatómiai jelölése alapján, és (3) a szürkeállomány-képek transzformálása az MNI-térbe és a szürkeállomány egyes voxeleinek anatómiai igazítása a 116 automatikus anatómiai jelölő struktúrához az IBASPM (24) segítségével, bal agyvelő: 45 régió, jobb nagyagy: 45 régió, kisagy: 26 régió; (1C. ábra). A kisagy 26 régióját az anatómiai struktúráknak megfelelően hét régióvá egyesítettük, és a 97 jelölt (45 mindkét agyféltekére és hét kisagyra, 1. kiegészítő táblázat) agyi struktúra térfogatát személyenként kivontuk (1C. ábra).
Az FD-módszert eredetileg Mandelbrot javasolta a tárgyak alakkal kapcsolatos komplexitásának egyetlen számértékre történő számszerűsítésére (25). Az FD-módszert a komplexitás topológiai mérésére használják; a magasabb FD-érték a vizsgált szövet nagyobb topológiai komplexitását jelenti (18, 26). Számos neurológus bizonyította, hogy az FD-érték kvantitatív mérőszámként szolgálhat az agyi redők morfológiai komplexitásának pontos leírására (18, 26, 27). Mivel az FD-elemzés logaritmikus skálán alapul, az FD-érték kis mértékű növekedése is a komplexitás jelentős növekedésének felelhet meg (18). Ebben a vizsgálatban a 3D box-counting módszert alkalmaztuk a szürkeállomány 97 szegmensének 3D-FD értékeinek mérésére a teljes agyból minden egyes résztvevő esetében (1D ábra). Egy kapcsolódó tanulmány részletezi a box-counting módszer algoritmusát (18).
Statisztikai elemzés
A csoportok közötti, nemhez és életkorhoz kapcsolódó különbségeket Pearson khi-négyzet tesztjével (χ2 = 0,384, p = 0,535) és a 2-farkú 2-mintás t-próbával (p = 0,516) mértük, külön-külön. Lineáris regressziót alkalmaztunk az életkor és a nem hatásának eltávolítására. 2-farkú t-próbát alkalmaztunk annak megállapítására, hogy van-e szignifikáns különbség a kontroll- és a betegcsoportok között az egyes agykérgi régiók 3D-FD-értékei tekintetében. Az eredmények szignifikanciáját a hamis felfedezési arány (FDR-korrigált p = 0,05) alapján határoztuk meg (28). Az egyes agyi régiók 3D-FD értéke és a klinikai jellemzők, például a betegség időtartama és a SARA közötti összefüggés nagyságát Pearson r-méréssel határoztuk meg (1E. ábra). Ezeket az elemzéseket a MATLAB 2010 Statistics Toolbox segítségével végeztük el.
Eredmények
Az SCA3-as betegek szignifikáns elváltozásokat mutattak ki a tipikus infratentoriális elváltozások régióiban
A tapasztalt neuroradiológusok jelentették az SCA3-as betegek MRI-leleteit (1. táblázat). A 2. ábra a 3D-FD értékek összehasonlítását mutatja az egyes lebenyekben az egészséges csoport és az SCA3 csoport között. Összességében az SCA3-ban szenvedő betegek minden lebenyben szignifikánsan csökkent 3D-FD-értékeket mutattak, és a kisagyhoz társult a 3D-FD-érték legjelentősebb csökkenése (2. ábra). Az SCA3 betegek kisagykéreg 3D-FD értékei szignifikáns korrelációt mutattak a SARA pontszámukkal (r = -0,3346; p = 0,023). A továbbiakban 97 régióra parcelláztuk az agy- és kisagykéreget, és minden egyes parcellázott régióban számszerűsítettük az atrófiát. Az SCA3-ban szenvedő betegeknek tipikus infratentoriális léziós régiói voltak, beleértve a pontinus magokat, a kisagykéreg és az inferior olajbogyókat. Az atrófiás régiók szignifikánsan csökkent 3D-FD értékeinek részleteit az egészséges csoport és az SCA3 csoport között a 2. táblázat foglalja össze.
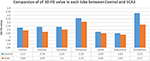
2. ÁBRA. A 3D-FD értékek összehasonlítása az egyes lebenyekben az egészséges csoport és az SCA3 csoport között. Az SCA3 minden egyes lebenyében a 3D-FD érték szignifikánsan alacsonyabbnak mutatkozott a kontrollcsoportnál. A kisagy, a frontális lebeny, a parietális lebeny és a nyakszirti lebeny szignifikáns különbségének p-értéke kisebb, mint 0,01, a többi lebeny esetében pedig kisebb, mint 0,05.
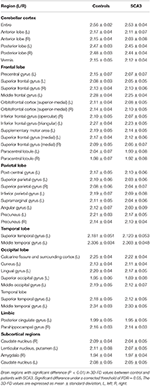
Táblázat 2. táblázat. Szignifikánsan atrófiás régiók az SCA3-ban szenvedő betegeknél (p < 0,05).
Az SCA3-ban szenvedő betegek agyi lateralizált szupratentoriális elváltozásokat tártak fel
Az infratentoriális elváltozások mellett az összes SCA3-ban szenvedő betegnél szupratentoriális régiókban is megfigyeltek elváltozásokat. Kiterjedt elváltozásokat mutattak 39 agyi parcellás régióban (p < 0,05), beleértve a homloklebenyt, a fali lebenyt, a nyakszirti lebenyt és a halántéklebenyt. Lateralizált atrófiát mutattak ki, és túlnyomórészt a bal féltekében (jobb/bal: 12/27). Különösen a nyakszirti és a halántéklebenyben, az SCA3-ban szenvedő betegek csak a bal féltekében mutattak szignifikánsan csökkent 3D-FD értékeket. A frontális régiókban a premotoros kéreg (bal precentralis gyrus, kétoldali superior frontalis gyrus és bal-középső frontalis gyrus), a kiegészítő motoros kéreg (bal kiegészítő motoros terület) és az elsődleges motoros kéreg (bal precentralis gyrus) voltak a jelentős atrófiás régiók (3. ábra).
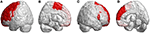
3. ábra. A homloklebenyen belüli régiók, amelyek alacsonyabb 3D-FD értékeket jeleznek az SCA3-ban szenvedő betegeknél a kontrollokhoz képest. (A) Bal-külső nézet, (B) bal-belső nézet, (C) jobb-külső nézet és (D) jobb-belső nézet. Az SCA3-ban szenvedő betegeknél szignifikánsan csökkentek a 3D-FD értékek a frontális régiókban, beleértve a premotoros kéreg (bal precentralis gyrus, kétoldali superior frontalis gyrus és bal középső frontalis gyrus), a kiegészítő motoros kéreg (bal kiegészítő motoros terület) és az elsődleges motoros kéreg (bal precentralis gyrus). Egyéb elsorvadt régiókat figyeltek meg a bal alsó homlokgyrusban (opercularis), a bal alsó homlokgyrusban (háromszög), a kétoldali orbitofrontális kéregben (superior-1 medialis), a kétoldali felső homlokgyrusban (medialis) és a kétoldali paracentrális lebenyben SCA3-ban szenvedő betegeknél. Az összes szignifikánsan csökkent 3D-FD értékű régiót piros színnel ábrázoltuk.
A többi elsorvadt régió a bal alsó frontális gyrusban (opercularis), a bal alsó frontális gyrusban (háromszögletű), a kétoldali orbitofrontális kéregben (superior-mediális), a kétoldali felső frontális gyrusban (medialis) és a kétoldali paracentrális lebenyben volt. A parietális lebenyben csökkent FD-értékeket észleltek a bal postcentralis gyrusban, a bal supramarginalis gyrusban, a bal angularis gyrusban, a kétoldali superior parietalis gyrusban és a kétoldali precuneusban az SCA3-ban szenvedő betegeknél (4. ábra).
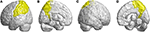
4. ábra. A parietális lebenyen belüli régiók, amelyek a 3D-FD értékének csökkenését jelzik az SCA3-ban szenvedő betegeknél a kontrollokhoz képest. (A) Bal-külső nézet, (B) bal-belső nézet, (C) jobb-külső nézet és (D) jobb-belső nézet. A kontrollokhoz képest az SCA3-as betegek szignifikánsan alacsonyabb 3D-FD értékeket mutattak a bal postcentralis gyrusban, a bal supramarginalis gyrusban, a bal angularis gyrusban, a kétoldali superior parietalis gyrusban és a kétoldali precuneusban a parietális lebenyben. Az összes szignifikánsan csökkent 3D-FD értékű régiót sárga színnel ábrázoltuk.
A nyakszirti lebenyben az SCA3 betegek szignifikánsan alacsonyabb FD-értékeket mutattak ki a bal féltekén a calcarine fissure-ban és a környező kéregben, a cuneusban, a lingualis gyrusban, valamint a felső és középső nyakszirti gyriben (5A. ábra, kék szín). A halántéklebenyben a csökkent FD-értékkel rendelkező régiók az SCA3-as betegeknél a bal-felső halánték- és a bal-középső halántékgyriben voltak (5A. ábra, lila szín). A limbikus régió bal hátsó cinguláris gyrusában a 3D-FD értékek szintén szignifikánsan csökkentek az SCA3-ban szenvedő betegeknél (5B,D ábra, zöld szín). Az SCA3-ban szenvedő betegeknél a bazális ganglionokban, beleértve a kétoldali caudate magot és a bal putament, jelentős atrófia régiói voltak megfigyelhetők (5B,D ábra, aquakék szín). A jobb-külső occipitális lebenyben nem figyeltek meg jelentős atrófiás régiókat az SCA3-ban szenvedő betegeknél (5C ábra).
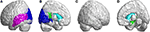
5. ábra. Az okcipitális lebenyben, a temporális lebenyben és a szubkortikális lebenyben található régiók, amelyek szignifikánsan alacsonyabb 3D-FD értékeket jeleztek az SCA3-ban szenvedő betegeknél a kontrollokhoz képest. (A) Bal-külső nézet, (B) bal-belső nézet, (C) jobb-külső nézet és (D) jobb-belső nézet. A kék régiók szignifikánsan alacsonyabb 3D-FD értékeket mutatnak a nyakszirti lebenyben, beleértve a calcarine fissure-t és a környező kéreg, cuneus és lingualis gyrus, valamint a bal félteke felső és középső nyakszirti gyrusát. A lila régiók alacsonyabb 3D-FD-értékeket jelölnek a bal felső halántékgyrusban és a bal középső halántékgyrusban. Az aquakék régiók alacsonyabb 3D-FD értékeket jelölnek a szubkortikális régiókban, beleértve a kétoldali caudatumot és a bal putament. A zöld régiók szignifikánsan alacsonyabb 3D-FD értékeket képviselnek a limbikus rendszer bal hátsó cinguláris gyrusában és a parahippocampalis gyrusban.
A 6. ábrán számos agyi atrófiás régiót találtunk, beleértve a kisagyat, a cerebelláris-thalamocorticalis és a bazális ganglion-thalamocorticalis kapcsolati áramköröket, amelyek arra utaltak, hogy az SCA3-ban szenvedő betegek kisagy-thalamocorticalis és bazális ganglion-thalamocorticalis károsodást mutattak ezeken az útvonalakon.

6. ábra. Az SCA3 részt vesz mind a kisagyi-thalamokortikális, mind a bazális ganglion-thalamokortikális útvonalakban. (A) Bal-külső nézet, (B) bal-belső nézet, (C) jobb-külső nézet és (D) jobb-belső nézet. A kisagyi-talamokortikális hurokban az SCA3-ban szenvedő betegek szignifikánsan alacsonyabb 3D-FD értékeket mutatnak a kisagyi, premotoros és kiegészítő motoros kéregben. Az SCA3-ban szenvedő betegek csökkent 3D-FD értékei a kisagykéregben és más, motorral kapcsolatos agyi régiókban magyarázatot adnak a klinikai tünetek jelenlétére. A basalis ganglia-thalamocorticalis hurokban az SCA3-ban szenvedő betegek szignifikánsan alacsonyabb 3D-FD értékeket mutatnak a frontális kéregben, az elsődleges motoros kéregben, a putamenben és a caudatusban. Ezek az eredmények morfológiai változásokat mutatnak a bazális ganglia-thalamocorticalis hurokban az SCA3-ban szenvedő betegeknél.
Diszkusszió
Klinikailag az SCA3-ban szenvedő betegek kisagyi szindrómát és parkinsonizmust mutatnak (3-5). Az infratentoriális és szupratentoriális kéreg atrofizált régiói a 2. táblázatban felsoroltak, és széles körű átfedést mutattak, mint két funkcionális régióban, nevezetesen a kisagyhoz kapcsolódó (CB-hez kapcsolódó) kéregben (29) és a bazális ganglionokhoz kapcsolódó (BG-hez kapcsolódó) kéregben (30). A CB-vel kapcsolatos kéreg magában foglalja a kisagyat, a prefrontális, a szenzomotoros kéreg, a prefrontális kéreg és a temporális lebeny, a BG-vel kapcsolatos kéreg pedig a primer motoros kéreg, a kiegészítő motoros terület, a premotoros kéreg és a bazális ganglionok. Eredményeink azt mutatták, hogy összhangban vannak a korábbi hagyományos neuroimaging vizsgálatokkal, miszerint a kisagy a leginkább érintett és elsorvadt régió az SCA3-ban szenvedő betegeknél (4, 31, 32). Emellett az SCA3-ban szenvedő betegek kisagykéregben mért 3D-FD értéke szignifikánsan negatív korrelációt mutatott a SARA pontszámokkal (r = -0,3346; p = 0,023), ahogy arról Rezende és munkatársai már korábban beszámoltak (33).
Az infratentoriális régiókban az SCA3-ban szenvedő betegeknél a putamen és a caudate 3D-FD értékei szignifikánsan csökkentek. Neuropatológiai vizsgálatok neuronvesztést mutattak ki a putamenben és a caudatumban, ami a bazális ganglionok atrófiájához vezethet a parkinsonizmussal összefüggésben (34). A parkinsonos jellegzetességek az SCA3-mutáció uralkodó fenotípusa, és általában bazális ganglionális tünetekkel járnak együtt (35-37). A boncolási vizsgálatok szerint a bazális ganglionok érintettsége gyakori az SCA3-ban szenvedő betegeknél. A PET-vizsgálatokkal végzett funkcionális képalkotás szintén kimutatta a caudatus és a putamen korai funkcionális hanyatlását SCA3-ban szenvedő betegeknél. Emellett az SCA3-ban szenvedő betegeknél szignifikánsan kisebb volt a bazális ganglionok térfogata (35). A kapcsolódó vizsgálatok azonban csak a bazális ganglionokra és az infratentoriális régiókra összpontosítottak. A 6. ábrán igazoltuk, hogy az SCA3-ban nemcsak a bazális ganglionok, hanem a kisagyi-talamokortikális és a bazális ganglion-talamokortikális pályák károsodása is előfordulhat.
Az SCA3-ban szenvedő betegeknél a kisagyi-talamokortikális hurokban a premotoros kéreg és a kiegészítő motoros kéreg 3D-FD értékei jelentősen csökkentek. A premotoros kéreg és a kiegészítő motoros terület a mozgásszabályozással, például az izomerővel és a nyúlás irányával van kapcsolatban. Ezen területek károsodása a mozgás dekompozíciója mellett a járás, az állás és a végtagok ataxiáját is előidézheti (38, 39). A kisagykéreg és más, mozgással kapcsolatos agyi régiók csökkent 3D-FD értékei az SCA3-ban szenvedő betegeknél magyarázatot adhatnak a klinikai tünetek jelenlétére. Ezenkívül a bazális ganglion-talamocortikális hurokban az SCA3-ban szenvedő betegek szignifikánsan csökkent 3D-FD értékeket mutatnak a frontális és az elsődleges motoros kéregben. A primer motoros kéreg szintén a bazális ganglionok kimenetének egyik fő célpontja (40). A bazális ganglion-talamocortikális hurok zavarai szintén hozzájárulhatnak a parkinsonos motoros diszfunkcióhoz (41). E vizsgálat eredményei a bazális ganglion-thalamocorticalis hurok morfológiai változásait hangsúlyozzák SCA3-ban szenvedő betegeknél, amelyekkel korábbi neuroimaging vizsgálatok nem foglalkoztak.
A közelmúltban diffúziós tenzoros képalkotást (DTI) használtunk a fehérállomány (WM) változásának vízmolekuláris diffúziójának mérésére SCA3-ban (15). Azt találtuk, hogy az SCA3 széleskörű fehérállomány-elváltozásokat mutatott a kétoldali cerebralis-frontális, -parietális, -temporális és -occipitális WM-ben; a kisagyi WM-ben; a talamuszban és az agytörzsben. Azonos módon, ebben a vizsgálatban megfigyeltük, hogy az SCA3 szinte ugyanazokban a parcellás régiókban mutatott e WM-elváltozásokat, amelyek GM-elváltozásokat mutattak. Ezek a jelenlegi eredmények megerősítik a supratentoriális régiók érintettségét az SCA3-ban szenvedő betegeknél. Braga és munkatársai hasonló eredményekről számoltak be, bizonyítva, hogy az SCA3 a végrehajtó funkciók, a verbális folyékonyság, az absztrakt gondolkodás és a munkamemória károsodásán keresztül okoz CCAS-t (8). Neuropatológiai vizsgálatokban kimutatták, hogy a CCAS a kisagyi áramkör zavarából ered, amely a prefrontális, a superior parietális, a superior temporális és a limbikus kéreggel áll kapcsolatban (42, 43). A vizsgálatok megerősítették a kisagy szerepét a kognitív funkciókban; ugyanakkor a kognitív, affektív és vizuospatikus funkciók közvetlenül összefüggnek az agykérgi degenerációval. Az SCA3-ban szenvedő betegeknél a szupratentoriális régiók szignifikánsan elsorvadt területei kiterjedtebbek voltak, mint a CCAS-asszociált régiók. A szupratentoriális kéreg atrófiája lehet az elsődleges tényező, amely az ataxiával és a Parkinsonizmussal kapcsolatos régiók diszfunkciójához társul. Ezek az eredmények arra utalnak, hogy az SCA3-at már nem szabad a kisagyra és annak kapcsolataira korlátozódó betegségnek tekinteni; inkább az egész agyat érintő patológiának kell tekinteni.
A vizsgálatnak azonban még mindig voltak bizonyos korlátai. A fő korlátok ebben a tanulmányban az SCA-ban a CCAS értékelésére szolgáló specifikus kognitív értékelések és klinikai paraméterek hiánya. További vizsgálatok indokoltak a jelen eredmények és a klinikai adatok, például a funkcionális MRI-adatok közötti összefüggés tekintetében. Ez segíthet pontosabb módszert biztosítani a kognitív és a motoros érintettség, valamint a regionális atrófia közötti összefüggés értékeléséhez SCA3-ban szenvedő betegeknél.
Következtetések
Ebben a tanulmányban a 3D-FD módszert használtuk a regionális morfológiai eltérések számszerűsítésére SCA3-ban szenvedő betegeknél, valamint a szupratentoriális atrófia és a motoros érintettség közötti összefüggés értékelésére SCA3-ban szenvedő betegeknél. Eredményeink az agykéreg jelentős degenerációját mutatták ki bizonyos régiókban, amelyek talán kisagyi vagy bazális ganglionokkal kapcsolatosak. Eredményeink összefüggésbe hozhatók az SCA3 gyakori tüneteivel, mint például az ataxia, a parkinsonizmus, a dysarthria és a dysmetria. Az SCA3-at már nem szabad a kisagyra és annak kapcsolataira korlátozódó betegségnek tekinteni; inkább az egész agyat érintő patológiának kell tekinteni.
Adatok elérhetőségi nyilatkozata
Az e tanulmányhoz generált összes adatkészletet a cikk/kiegészítő anyag tartalmazza.
Etikai nyilatkozat
Az emberi résztvevőkkel végzett vizsgálatokat a Taipei Veterans General Hospital intézményi felülvizsgálati bizottsága felülvizsgálta és jóváhagyta. A betegek/résztvevők írásbeli beleegyezésüket adták a vizsgálatban való részvételhez.
A szerzők hozzájárulása
P-SW és Y-TW megszervezték a kutatási projektet, átnézték és kritizálták a kéziratot. T-YW írta a kéziratot. H-MW hozzáfért a kutatási adatokhoz. B-WS megszervezte a kutatást és elvégezte az adatgyűjtést. C-WJ végezte a statisztikai elemzést, megírta és átdolgozta a kéziratot.
Finanszírozás
A tanulmányt a tajvani Tudományos és Technológiai Minisztérium (MOST108-2634-F-010-002); a tajvani Nemzeti Egészségügyi Kutatóintézetek (NHRI-EX106-10526EI); a Nemzeti Yang-Ming Egyetem és a Shin-Kong Wu-Ho Su Memorial Hospital Research Program (107GB006) támogatta.
Érdekütközés
A szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségként értelmezhetők.
Köszönet
A szerzők köszönetet mondanak mindazoknak, akik részt vettek ebben a vizsgálatban, és köszönetet mondanak a Wallace Academic Editingnak a kézirat szerkesztéséért.
Kiegészítő anyagok
A cikkhez tartozó kiegészítő anyagok online elérhetők a következő címen: https://www.frontiersin.org/articles/10.3389/fneur.2020.00124/full#supplementary-material
1. Kawaguchi Y, Okamoto T, Taniwaki M, Aizawa M, Inoue M, Katayama S, et al. CAG expansions in a novel gene for Machado-Joseph disease at chromosome 14q32.1. Nat Genet. (1994) 8:221-8. doi: 10.1038/ng1194-221
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Vizsgálati eredmények és eredmények (1994) 8:221-8. Riess O, Rub U, Pastore A, Bauer P, Schols L. SCA3: neurológiai jellemzők, patogenezis és állatmodellek. Cerebellum. (2008) 7:125-37. doi: 10.1007/s12311-008-0013-4
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Stevanin G, Durr A, Brice A. Clinical and molecular advances in autosomal dominant cerebellar ataxias: from genotype to phenotype and physiopathology. Eur J Hum Genet. (2000) 8:4-18. doi: 10.1038/sj.ejhg.5200403
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Az angol nyelvű szakirodalomban (2000) 8:4-18. Schols L, Bauer P, Schmidt T, Schulte T, Riess O. Autoszomális domináns kisagyi ataxiák: klinikai jellemzők, genetika és patogenezis. Lancet Neurol. (2004) 3:291-304. doi: 10.1016/S1474-4422(04)00737-9
PubMed Abstract | CrossRef Full Text
5. The Neurológiai Klinika (2004) 3:291-304. Roeske S, Filla I, Heim S, Amunts K, Helmstaedter C, Wüllner U, et al. Progresszív kognitív diszfunkció a 3-as típusú spinocerebelláris ataxiában. Movement Disord. (2013) 28:1435-8. doi: 10.1002/mds.25512
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Braga-Neto P, Pedroso JL, Alessi H, Dutra LA, Felicio AC, Minett T, et al. Cerebelláris kognitív affektív szindróma Machado Joseph betegségben: alapvető klinikai jellemzők. Cerebellum. (2012) 11:549-56. doi: 10.1007/s12311-011-0318-6
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Zawacki TM, Grace J, Friedman JH, Sudarsky L. Executive and emotional dysfunction in Machado-Joseph disease. Movement Disord. (2002) 17:1004-10. doi: 10.1002/mds.10033
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Braga-Neto P, Dutra LA, Pedroso JL, Barsottini OGP. Kognitív diszfunkció a 3-as típusú spinocerebelláris ataxiában: változó topográfiák és mintázatok. Movement Disord. (2014) 29:156-7. doi: 10.1002/mds.25756
PubMed Abstract | CrossRef Full Text | Google Scholar
9. 9. Beszélgetés a kardiovaszkuláris rendellenességekről és a kórképekről. Lopes TM, D′Abreu A, Junior MCF, Yasuda CL, Betting LE, Samara AB, et al. Widespread neuronal damage and cognitive dysfunction in spinocerebellar ataxia type 3. J Neurol. (2013) 260:2370-9. doi: 10.1007/s00415-013-6998-8
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Roeske S, Filla I, Heim S, Amunts K, Helmstaedter C, Wüllner C, et al. Reply to: Cognitive dysfunction in spinocerebellar ataxia type 3: variable topographies and patterns. Movement Disord. (2014) 29:157-8. doi: 10.1002/mds.25755
PubMed Abstract | CrossRef Full Text | Google Scholar
11. XI. Barbas H. A kognitív-érzelmi interakciók anatómiai alapjai a főemlősök prefrontális kéregében. Neurosci Biobehav R. (1995) 19:499-510. doi: 10.1016/0149-7634(94)00053-4
PubMed Abstract | CrossRef Full Text | Google Scholar
12. D’Abreu A, Franca MC Jr, Yasuda CL, Campos BA, Lopes-Cendes I, Cendes F, et al. Neocortical atrophy in machado-joseph disease: a longitudinal neuroimaging study. J Neuroimaging. (2012) 22:285-91. doi: 10.1111/j.1552-6569.2011.00614.x
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Az agykárosodástól való félreértés és az elmebajosodástól való félreértés. Soong BW, Liu RS. Pozitronemissziós tomográfia a Machado-Joseph-kór tünetmentes génhordozóinál. J Neurol Neurosur PS. (1998) 64:499-504. doi: 10.1136/jnnp.64.4.499
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Wullner U, Reimold M, Abele M, Burk K, Minnerop M, Dohmen BM, et al. Dopamine transporter positron emission tomography in spinocerebellar ataxias type 1, 2, 3, and 6. Arc Neurol. (2005) 62:1280-5. doi: 10.1001/archneur.62.8.1280
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Orvosi és pszichiátriai vizsgálatok. Jao CW, Soong BW, Huang CW, Duan CA, Wu CC, Wu YT, et al. Diffúziós tenzoros mágneses rezonancia képalkotás a multiplex rendszer atrófia cerebelláris típus és a spinocerebelláris ataxia 3 típus megkülönböztetésére. Brain Sci. (2019) 9:354. doi: 10.3390/brainsci9120354
PubMed Abstract | CrossRef Full Text | Google Scholar
16. A Brain Sci. Kang JS, Klein JC, Baudrexel S, Deichmann R, Nolte D, Hilker R. White matter damage is related to ataxia severity in SCA3. J Neurol. (2014) 261:291-9. doi: 10.1007/s00415-013-7186-6
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Guimarães RP, D’Abreu A, Yasuda CL, Franca MC Jr, Silva BH, Cappabianco FA, et al. A mikroszerkezeti fehérállomány-károsodás multimodális értékelése spinocerebelláris ataxia 3. típusában. Mov Disord. (2013) 28:1125-32. doi: 10.1002/mds.25451
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Wu YT, Shyu KK, Jao CW, Wang ZY, Soong BW, Wu HM, et al. Fractal dimension analysis for quantifying cerebellar morphological change of multiple system atrophy of the cerebellar type (MSA-C). NeuroImage. (2010) 49:539-51. doi: 10.1016/j.neuroimage.2009.07.042
PubMed Abstract | CrossRef Full Text | Google Scholar
19. A neuroimage.2009.07.042
PubMed Abstract | CrossRef Full Text | Google Scholar
. Schmitz-Hübsch T, du Montcel ST, Baliko L, Berciano J, Boesch S, Depondt C, et al. Scale for the assessment and rating of ataxia. Egy új klinikai skála kidolgozása. Neurológia. (2006) 66:1717-20. doi: 10.1212/01.wnl.0000219042.60538.92
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Taxaxia. Hoehn MM, Yahr MD. Parkinsonizmus: kezdet, progresszió és mortalitás. Neurológia. (1998) 50:318. doi: 10.1212/WNL.50.2.318
PubMed Abstract | CrossRef Full Text | Google Scholar
21. A neurológia és a neurológiai betegségek és a neurológiai problémák kezelése. Jardim LB, Pereira ML, Silveira I, Ferro A, Sequeiros J, Giugliani R. Neurológiai leletek Machado-Joseph betegségben: kapcsolat a betegség időtartamával, altípusaival és (CAG)n. Arch Neurol. (2001) 58:899-904. doi: 10.1001/archneur.58.6.899
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Arch. Soong B-W, Lu Y-C, Choo K-B, Lee H-Y. Az autoszomális domináns kisagyi ataxiák gyakorisági elemzése tajvani betegeknél és a 6-os típusú spinocerebelláris ataxia klinikai és molekuláris jellemzése. Arch Neurol. (2001) 58:1105-9. doi: 10.1001/archneur.58.7.1105
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Archneur. Woods RP, Grafton ST, Holmes CJ, Cherry SR, Mazziotta JC. Automatizált képregisztráció: I. Általános módszerek és intrasubject, intramodalitym validáció. J Comput Assist Tomo. (1998) 22:139-52. doi: 10.1097/00004728-199801000-00027
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Google Scholar
. Tzourio-Mazoyer N, Landeau B, Papathanassiou D, Crivello F, Etard O, Delcroix N, et al. Az aktivációk automatizált anatómiai jelölése SPM-ben az MNI MRI egyszemélyes agyának makroszkopikus anatómiai parcellázásával. NeuroImage. (2002) 15:273-89. doi: 10.1006/nimg.2001.0978
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Hosszú távú kutatási eredmények. Mandelbrot BB. Fraktálok: Form, véletlen és dimenzió. San Francisco, CA: Freeman (1977). p. 365.
Google Scholar
26. Esteban FJ, Sepulcre J, de Mendizabal NV, Goni J, Navas J, de Miras JR, et al. Fractal dimension and white matter changes in multiple sclerosis. NeuroImage. (2007) 36:543-9. doi: 10.1016/j.neuroimage.2007.03.057
PubMed Abstract | CrossRef Full Text | Google Scholar
27. A szklerózis szklerózis multiplexe. Ha TH, Yoon U, Lee KJ, Shin YW, Lee JM, Kim IY, et al. Az agykérgi felszín fraktáldimenziója skizofréniában és kényszerbetegségben. Neurosci Lett. (2005) 384:172-6. doi: 10.1016/j.neulet.2005.04.078
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Neulet. Benjamini Y, Hochberg Y. A hamis felfedezési arány ellenőrzése: a többszörös tesztelés gyakorlatias és hatékony megközelítése. J R Stat Soc B. (1995) 57:289-300. doi: 10.1111/j.2517-6161.1995.tb02031.x
CrossRef Full Text | Google Scholar
29. J R Stat Soc B (1995) 57:289-300. Schmahmann JD, Pandya DN. A rhesusmajom hátsó parietális asszociációs kérgéből a bázis pontisra irányuló projekciók anatómiai vizsgálata. J Comp Neurol. (1989) 289:53-73. doi: 10.1002/cne.902890105
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Girard B, Tabareau N, Berthoz A, Slotine JJ. Szelektív erősítés a bazális ganglionok összehúzódó modelljével. Pont A Mousson: NeuroComp (2006). 30-3. p.
Google Scholar
31. 31. Pont A Mousson: NeuroComp (2006). Burk K, Abele M, Fetter M, Dichgans J, Skalej M, Laccone F, et al. Autoszomális domináns kisagyi ataxia I. típusú klinikai jellemzők és MRI SCA1, SCA2 és SCA3 családokban. Brain. (1996) 119:1497-505. doi: 10.1093/brain/119.5.1497
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Agykutatás és agyklinika. Dohlinger S, Hauser TK, Borkert J, Luft AR, Schulz JB. Mágneses rezonancia képalkotás spinocerebelláris ataxiákban. Cerebellum. (2008) 7:204-14. doi: 10.1007/s12311-008-0025-0
PubMed Abstract | CrossRef Full Text | Google Scholar
33. 33. Az agyvelőbántalmak és az agykárosodástól való félreértés. Rezende TJ, D’Abreu A, Guimaraes RP, Lopes TM, Lopes-Cendesc I, Cendes F, et al. Cerebral cortex involvement in Machado-Joseph disease. Eur J Neurol. (2015) 22:277-83, e23-4. doi: 10.1111/ene.12559
CrossRef Full Text | Google Scholar
34. Google Scholar
. Lu CS, Chang HC, Kuo PC, Liu YL, Wu WS, Weng YH, et al. A 3-as típusú spinocerebelláris ataxia parkinsonos fenotípusa egy tajvani családban. Parkinsonism Relat D. (2004) 10:369-73. doi: 10.1016/j.parkreldis.2004.03.009
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Parkinsonism Relat D. (2004) 10:369-73. Klockgether T, Skalej M, Wedekind D, Luft AR, Welte D, Schulz JB, et al. Autosomális domináns kisagyi ataxia I. típus. MRI-alapú volumetria a hátsó fossa struktúrák és a bazális ganglionok volumetriája spinocerebelláris ataxia 1, 2 és 3 típusában. Brain. (1998) 121:1687-93. doi: 10.1093/brain/121.9.1687
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Socal MP, Emmel VE, Rieder CRM, Hilbig A, Saraiva-Pereira ML, Jardim LB. A Parkinson-fenotípus intrafamiláris variabilitása SCA-kban: új esetek az SCA2 és SCA3 expanziók miatt. Parkinsonism Relat D. (2009) 15:374-8. doi: 10.1016/j.parkreldis.2008.09.005
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Parkinsonism Relat. Bettencourt C, Santos C, Coutinho P, Rizzu P, Vasconcelos J, Kay T, et al. Parkinsoni fenotípus Machado-Joseph betegségben (MJD/SCA3): két esetről szóló beszámoló. BMC Neurol. (2011) 11:131. doi: 10.1186/1471-2377-11-131
PubMed Abstract | CrossRef Full Text | Google Scholar
38. PhD. Kandel ER, Schwartz JH, Jessell TM. Az idegtudomány alapelvei. New York, NY: McGraw-Hill (1991). p. 626-46.
Google Scholar
39. o. Asbury AK, McKhann GM. Az idegrendszer betegségei: Clinical Neurobiology. Philadelphia, PA: W.B. Saunders (1992). p. 319-341.
40. o. Hoover JE, Strick PL. Többszörös kimeneti csatornák a bazális ganglionokban. Science. (1993) 5:819-21. doi: 10.1126/science.7679223
CrossRef Full Text | Google Scholar
41. Google Scholar. Jan C, Pessiglione M, Tremblay L, Tandé D, Hirsch EC, François C, et al. A dopaminerg veszteség kvantitatív elemzése a funkcionális területekhez viszonyítva MPTP-vel kezelt majmokban. Eur J Neurosci. (2003) 18:2082-6. doi: 10.1046/j.1460-9568.2003.02946.x
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Hosszú távú kutatások a neuroterápiában. Rub U, de Vos RA, Brunt ER, Sebesteny T, Schols L, Auburger G, et al. Spinocerebelláris ataxia 3 típus (SCA3): a talamusz neurodegenerációja a talamusz ataxin-3 immunpozitív neuronális intranukleáris zárványoktól függetlenül következik be. Brain Pathol. (2006) 16:218-27. doi: 10.1111/j.1750-3639.2006.00022.x
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Rub U, Seidel K, Ozerden I, Gierga K, Brunt ER, Schöls L, et al. Consistent affection of the central somatosensory system in spinocerebellar ataxia type 2 and type 3 and its significance for clinical symptoms and rehabilitative therapy. Brain Res Rev. (2007) 53:235-49. doi: 10.1016/j.brainresrev.2006.08.003
PubMed Abstract | CrossRef Full Text | Google Scholar
.