- Introduction
- Anyagok és módszerek
- ICH indukciója
- Western Blotting
- Immunohisztokémia
- Enzyme Linked Immunosorbent Assay
- Genetic Knockdown of Galectin-3
- Statisztikai elemzés
- Eredmények
- A Galektin-1 és Galektin-3 időbeli expressziós mintázata ICH után
- A Galektin-1 és Galektin-3 sejtes lokalizációja ICH után
- Galektin-1 és Galektin-3 közvetítette gyulladásos válasz szabályozása
- Diszkusszió
- Következtetés
- Etikai nyilatkozat
- A szerzők hozzájárulása
- Finanszírozás
- Érdekütközésre vonatkozó nyilatkozat
- Kiegészítő anyag
- Rövidítések
Introduction
Az intracerebrális vérzés egy fatális stroke altípus (Qureshi et al., 2001a), amely a kórházi halálozási arány 40, illetve 80%-os rokkantsági arányt jelent (van Asch és mtsi., 2010). Az ICH az összes stroke 10-15%-áért felelős, az ICH előfordulása világszerte 2 millió eset évente (van Asch és mtsi., 2010), az Egyesült Államokban évente körülbelül 120 000 eset fordul elő (Ribo és Grotta, 2006; Broderick és mtsi., 2007; Aguilar és Freeman, 2010). Az incidencia azonban 2050-re várhatóan megduplázódik (Qureshi és mtsai., 2001b) az elöregedés és az antikoagulánsok terjedő használata miatt (Wang, 2010). Figyelemre méltó, hogy az ICH-nak nincs hatékony kezelése, és a betegség patofiziológiája kevéssé meghatározott.
A mikroglia, a CNS neuroimmun sejtjeinek aktivációjával jellemezhető neuroinflammáció az ICH által kiváltott másodlagos agykárosodás és a neurológiai funkciók elvesztésének kulcsfontosságú tényezője (Wang és Dore, 2007; Carmichael és mtsi., 2008; Wang, 2010). A vérkomponensek, köztük a trombin, a Hb és a Hb-metabolitok, például a hemin bejutása az agyba megteremti az ICH-t követő neuroinflammatorikus válaszok alapját (Wang és Dore, 2007; Carmichael és mtsi., 2008; Robinson és mtsi., 2009; Wang, 2010; Cai és mtsi., 2011; Dang és mtsi., 2011; Babu és mtsi., 2012; Lin és mtsi., 2012; Weng és mtsi., 2015; Min és mtsi., 2017). Figyelemre méltó, hogy a mikroglia proinflammatorikus aktivációja az ICH-t követően korrelál a vér-agy gát károsodásával, az agy duzzanatával/ödémával, a hematóma kiterjedésével, a neurológiai állapotromlással és a rossz funkcionális felépüléssel (Platt és mtsi., 1998; Hickenbottom és mtsi., 1999; Leira és mtsi., 2004; Zhao és mtsi., 2007). Továbbá, az ICH-t követő gyulladásos válasz szabályozza a vérből származó monociták/makrofágok agyi rekrutációját is, amelyekről ismert, hogy szabályozzák az ICH-indukált agykárosodást és ezáltal a funkcionális felépülést (Tessier és mtsai., 1997; Shiratori és mtsai., 2010; Starossom és mtsai., 2012).
A galektinek evolúciósan konzervált szénhidrát-kötő fehérjék családja (Barondes és mtsai, 1994a,b; Kasai és Hirabayashi, 1996), amelyek részt vesznek a sejtek aktiválásában, differenciálódásában, proliferációjában, migrációjában és apoptózisában (Perillo és mtsai., 1995; Yang és mtsai., 1996; Perillo és mtsai., 1998; Moiseeva és mtsai., 1999; Vespa és mtsai., 1999; Yamaoka és mtsai., 2000; Goldring és mtsai., 2002). A különböző galektin családtagok közül az újonnan felmerülő bizonyítékok a Galektin-1 és Galektin-3 kulcsszerepére utalnak a neuroimmun válaszokban számos neuropatológiai állapotban (Jeon és mtsai., 2010; Starossom és mtsai., 2012; Parikh és mtsai., 2015). Ugyanakkor kritikus tudáshiány van a sejtes expressziójuk és működésük megértésében ICH után. Jelen kézirat célja a Galektin-1 és Galektin-3 expressziójának hemorrhagiás sérülés okozta modulációjának és celluláris expressziójának tisztázása az agyban az ICH preklinikai modelljében.
Anyagok és módszerek
ICH indukciója
Intracerebrális vérzést indukáltunk felnőtt hím CD-1 egerekben (8-12 hét; n = 43), ahogyan arról korábban beszámoltunk (Sukumari-Ramesh et al., 2012a,b, 2016; Bonsack et al., 2016; Sukumari-Ramesh és Alleyne, 2016; Ahmad et al., 2017; Chen-Roetling et al., 2017). Röviden, az egeret elaltatták (ketamin és xilazin), és egy kis bemetszést ejtettek, hogy feltárják a koponyát. Nagysebességű fúróval egy fúrólyukat (0,5 mm) készítettünk a koponyán, körülbelül 2,2 mm-re laterálisan a bregmától. Ezután az egeret sztereotaxiás fejkeretre helyeztük, és egy 26-G Hamilton fecskendővel 0,04U bakteriális IV. típusú kollagenázt (Sigma, St. Louis, MO, Egyesült Államok) 0,5 μL foszfátpuffer sóoldatban (pH 7,4; PBS) 0,5 μL foszfátpuffer sóoldatban (PBS) a bal striatumba (3,0 mm) sztereotaxiás irányítás mellett injektáltunk. A tű eltávolítása után csontviaszt használtunk a furat lezárására. Az egereket az eljárás során 37 ± 0,5 °C-on tartottuk egy kisállat-hőmérsékletszabályozó segítségével. Az ICH utáni hematóma időbeli mintázata látható (S1. kiegészítő ábra).
Western Blotting
Az egereket elaltattuk és transzkardiálisan PBS-szel perfundáltuk. Az ipsilaterális agyszövetet (mind a hematomális, mind a peri-hematomális agyi régiók) proteáz- és foszfatáz-inhibitorokat tartalmazó RIPA-pufferben gyűjtöttük, és szonikációnak vetettük alá. Ezután a mintákat 14 000 fordulat/perc fordulatszámon 5 percig 4°C-on centrifugáltuk a felülúszó összegyűjtéséhez. BCA protein assay kit (Pierce, Rockford, IL, Egyesült Államok) segítségével megbecsültük a fehérjekoncentrációt, majd a minták 30-50 mikrogrammját 4-20%-os nátrium-dodecil-szulfát-poliakrilamid gélen futtattuk, és polivinilidén-difluorid (PVDF) membránra vittük át. A foltokat a megfelelő primer ellenanyaggal inkubáltuk egy éjszakán át 4°C-on. Ezt 2 órás inkubáció követte a megfelelő Alexa Fluor-jelölt másodlagos ellenanyaggal. A blotokat Li-Cor Odyssey közeli infravörös képalkotó rendszerrel olvastuk le, a mennyiségi meghatározást pedig Quantity One szoftverrel (Bio-Rad, Foster City, CA, Egyesült Államok) végeztük.
Immunohisztokémia
Az egereket elaltattuk és transzkardiálisan PBS-szel perfundáltuk. Az agyakat összegyűjtöttük és 4%-os paraformaldehidbe helyeztük egy éjszakára 4°C-on, majd lefagyasztottuk. Ezután az agyakat kriosztát segítségével 25 mm-es koronális metszetekre vágtuk, és üveglemezekre szereltük. A metszeteket 2 órán át 10%-os normál szamárszérumban inkubáltuk szobahőmérsékleten. Ezt egy éjszakán át tartó inkubáció követte a megfelelő primer ellenanyaggal 4°C-on. Mosás után a metszeteket a megfelelő Alexa fluor-jelölt másodlagos ellenanyaggal inkubáltuk 1 órán át szobahőmérsékleten. Az immunfluoreszcenciát Zeiss LSM510 Meta konfokális lézermikroszkóp segítségével határoztuk meg, és a sejtek ko-lokalizációját a korábban leírtak szerint határoztuk meg (Laird és mtsai., 2010). Állatonként három nem egymást követő metszetet és legalább 3 véletlenszerű mezőt elemeztünk a hematóma körül.
Enzyme Linked Immunosorbent Assay
RAW 264.7, egy egér makrofág sejtvonalat 24 lyukú lemezre telepítettünk, és 48 órán át inkubáltuk DMEM-ben (Dulbecco’s Modified Eagle Medium), amely 5% magzati szarvasmarha szérumot, 5% szarvasmarha növekedési szérumot és 1% penicillint/streptomycint tartalmazott. Ezután a sejteket egér rekombináns Galektin-1-gyel (6,25 vagy 12,5 μg/ml; R&D Systems, Minneapolis, MN, Egyesült Államok) inkubáltuk 1 órán keresztül, majd 18 órás LPS (100 ng/ml) vagy hemin (30 μg/ml) kezelés következett. A felülúszót összegyűjtöttük és felhasználtuk az IL-6 kimutatására, a gyártó utasításai szerinti ELISA módszerrel (Biolegend, San Diego, CA, Egyesült Államok). Röviden, egy 96 lyukú lemezt egy éjszakán át 4°C-on bevontunk egy specifikus befogadó antitesttel. Az 1 órás blokkolást követően a sejttenyésztési felülúszót a lyukakba adtuk, és 2 órán át szobahőmérsékleten inkubáltuk. A nem kötött anyagokat mosással távolítottuk el, majd detektáló antitestoldatot adtunk a lyukakhoz, és 1 órán át hagytuk inkubálni szobahőmérsékleten. További mosás után 100 μl avidin-lóretek-peroxidáz (HRP) oldatot adtunk minden egyes mélyedéshez 30 percig szobahőmérsékleten. A szubsztrátoldatot a színfejlődéshez a mosás után adtuk a mélyedésekhez. Stop-oldatot használtunk, és a lemezt 450 nm-en olvastuk le mikrotiterlemez-olvasóval (Bio-Tek, Epoch).
Genetic Knockdown of Galectin-3
RAW 264.7 sejteket vagy kontroll siRNS-szel (ON-TARGET plus Non-targeting Pool; GE Dharmacon) vagy Galektin-3 siRNS-szel (ON-TARGET plus Mouse Lgals3 siRNS; GE Dharmacon) transzfektáltuk HiPerFect Transfection Reagent (QIAGEN) segítségével a gyártó utasításainak megfelelően. A Galektin-3 knockdown-t 48 órával a transzfekció után western blottinggal ellenőriztük a korábban leírtak szerint.
Statisztikai elemzés
Az adatokat t-próbával vagy egyutas varianciaanalízissel, majd Student-Newman-Keuls post hoc teszttel elemeztük, és átlag ± standard hiba (SE) értékben fejeztük ki. A < 0,05 p-értéket szignifikánsnak tekintettük.
Eredmények
A Galektin-1 és Galektin-3 időbeli expressziós mintázata ICH után
Egerekben ICH-t vagy Sham-et idéztünk elő kollagenáz-injekciós módszerrel annak értékelésére, hogy a vérzéses sérülés a Galektin-1 és Galektin-3 expressziójának modulációját eredményezi-e az agyban. Tekintettel a Galektin-1 és Galektin-3 neuroimmun válaszokban betöltött feltűnő szerepére, a sham vagy ICH egerek ipsilaterális agyi metszeteit western blotting és immunhisztokémiai elemzéssel értékeltük különböző időpontokban, a műtét utáni 1. naptól a 7. napig terjedő időszakban, amely a sérülést követő időszak, amely az ICH után mind a mikroglia/macrofágok, mind az asztrociták pro- és anti-inflammatorikus aktivációjának figyelemre méltó indukcióját mutatta (Sukumari-Ramesh et al., 2012b, 2016; Bonsack és mtsai., 2016).
Az ICH után a látszólagos vagy kontralaterális agyterületről származó agyi metszeteken a Galektin-1 és Galektin-3 nagyon marginális vagy nem kimutatható expressziója volt megfigyelhető, míg a Galektin-1 és Galektin-3 fokozott expressziója a 3., 5. és 7. napon az ICH után (1., 2. ábra). E vonalak mentén a Galektin-1 immunpozitív sejtek száma a 3., az 5. és a 7. napon az ICH utáni 3. napon, illetve a 7. napon jelentősen, körülbelül 4-, 6 és 4-szeresére nőtt a látszathoz képest (1B ábra). Ezt a megfigyelést Western blotting elemzéssel is igazoltuk, amely a Galektin-1 figyelemre méltó és szignifikáns indukcióját mutatta ki a 3. naptól kezdődően az ICH után, a látszathoz képest (1C,D ábra). Továbbá, a Galektin-3 indukciója (2. ábra) tükrözte a Galektin-1 expresszióját az ICH után, és a Galektin-3 immunpozitív sejtek körülbelül 15, 28 és 24-szer magasabbak voltak a 3., 5. és 7. napon az ICH után (2B ábra) a látszathoz képest, és a Western blotting, majd a denzitometriás elemzés megerősítette a Galektin-3 sérülés okozta fokozott expresszióját az ICH után (2C,D ábra).
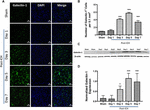
1. ábra. A Galektin-1 fokozott expressziója ICH után. (A) A Galektin-1 időbeli expressziós mintázatát ábrázoló konfokális képek ICH után (skálasáv = 20 μm; n = 3-5 csoportonként). (B) A Galektin-1-pozitív sejtek átlagos száma 0,1 mm2 -enként az ipsilaterális striatumban. (C) A Galektin-1 fokozott expresszióját az ipsilaterális striatumból származó agyszövet Western blottingjával igazoltuk. (D) A western blotting adatok denzitometriás elemzése (n = 3-5 csoportonként). ∗p < 0,05, ∗∗∗∗p < 0,001 vs. látszat.
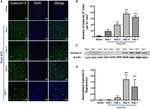
2. ábra. A Galektin-3 fokozott expressziója ICH után. (A) A Galektin-3 időbeli expressziós mintázata a perihematomális területen ICH után. A reprezentatív konfokális felvételek a Galektin-3 expressziójának figyelemre méltó növekedését mutatják ICH után a Sham-hez képest (skálasáv = 20 μm; n = 3-5 csoportonként). (B) A Galektin-3 pozitív sejtek átlagos száma 0,1 mm2 -enként az ipsilaterális striatumban. (C) A Galektin-3 időbeli expresszióját western blottinggal tovább igazoltuk. (D) A western blotting adatok denzitometriás elemzése (n = 3-5 csoportonként). ∗∗p < 0,01, ∗∗∗p < 0,001 vs. látszat.
A Galektin-1 és Galektin-3 sejtes lokalizációja ICH után
A Galektin-1 és Galektin-3 ICH utáni sejtes lokalizációjának meghatározásához az agyi metszeteket kettős jelölésű immunfestésnek vetettük alá. A Galektin-1 expressziója leginkább a GFAP-pozitív asztrocitákban volt megfigyelhető (3A. ábra), és a sztereotaxiás sejtszámlálás kimutatta, hogy a Galektin-1 pozitív sejtek 85%-a ICH után társ-kifejezte a GFAP-ot. Emellett a Galektin-1 expresszióját ICH után Iba1- pozitív mikroglia/makrofágokban is megfigyelték (3B ábra), de a Galektin-1 pozitív sejteknek csak 12%-a koexprimálta az Iba1-et.
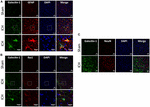
3. ábra. A Galektin-1 expressziója leginkább a gliasejtekben figyelhető meg ICH után. Agymetszeteket kétszeresen immunfestettük (A) Galektin-1 és GFAP, (B) Galektin-1 és Iba1, (a legalsó panel a nagy nagyítású képeket ábrázolja) és (C) Galektin-1 és NeuN (skálasáv = 20 μm; n = 3 csoportonként). A Galektin-1 expressziója főként a GFAP-pozitív sejtekben és az Iba1-pozitív sejtek egy alcsoportjában volt megfigyelhető. A NeuN pozitív sejtek nem expresszálták a Galektin-1-et (n = 3 csoportonként).
Ezzel szemben a Galektin-3 expressziója főként az Iba1-pozitív sejtekre korlátozódott (4A ábra), és a GFAP-pozitív sejtekben nem volt Galektin-3 expresszió (5A ábra), ami a Galektin-1 és Galektin-3 eltérő celluláris expressziójára utal ICH után. Továbbá, a Galektin-3 expresszióját proinflammatorikus, M1 mikroglia vagy makrofág marker, CD16/32-pozitív sejtekben figyelték meg (4B ábra), ami a Galektin-3 új szerepére utal az ICH utáni neuroinflammatorikus válaszokban. Figyelemre méltó, hogy a Galektin-3 pozitív sejtek 88 és 92%-a koexprimálta az Iba1 és a CD16/32 pozitív sejteket. Megjegyzendő, hogy a Galektin-3-at expresszáló mikroglia vagy makrofágok fagocita fenotípust mutattak (4A,B ábra), ami a mikroglia vagy makrofágok által közvetített fagocitózisban betöltött eddig feltáratlan szerepére utal ICH után. Továbbá, a NeuN-pozitív sejtek nem expresszáltak sem Galektin-1-et, sem Galektin-3-at (3C, 5B ábrák).
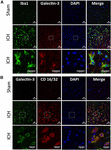
4. ábra. Galektin-3 expresszió mikroglia/makrofágokban ICH után. Agymetszeteket immunfestettük (A) Galektin-3 és Iba1, valamint (B) Galektin-3 és CD 16/32 tekintetében. Mind az Iba1 (a mikroglia/macrofágok markere), mind a CD16/32 (a proinflammatorikus M1 mikroglia vagy makrofágok markere) pozitív sejtek együttesen expresszálták a Galektin-3-at (n = 3 csoportonként).
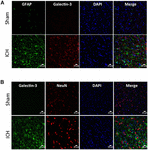
5. Ábra. A Galektin-3 sejtes lokalizációja ICH után. Az agyi metszeteket kétszeresen immunfestettük (A) Galektin-3 és GFAP, valamint (B) Galektin-3 és NeuN segítségével. A Galektin-3 expressziója sem a GFAP-pozitív, sem a NeuN-pozitív sejtekben nem volt jelen. Skálasáv = 20 μm; n = 3 csoportonként.
Galektin-1 és Galektin-3 közvetítette gyulladásos válasz szabályozása
A Galektin-1 és Galektin-3 ICH utáni lehetséges funkcionális szerepének megállapítására in vitro vizsgálatokat végeztünk. A rekombináns Galektin-1 (6,25 és 12,5 μg/ml) jelentősen mérsékelte az LPS által kiváltott proinflammatorikus citokin, az Interleukin -6 (IL-6) felszabadulását a RAW 264.7 sejtekből ELISA-val becsülve a kontrollokhoz képest (6. ábra), ami a Galektin-1 gyulladásban betöltött negatív szabályozó szerepére utal.

6. ábra. Rekombináns Galektin-1 és gyulladásos válasz. Az LPS (100 ng/ml) stimuláció előtt a Raw 264.7 sejteket rekombináns Galektin-1-gyel kezeltük, és az IL-6 felszabadulását ELISA segítségével mértük, a módszereknél részletezett módon. A rekombináns Galektin-1 jelentősen csökkentette az IL-6 LPS által kiváltott felszabadulását a RAW 246,7 sejtekből (n = 4 csoportonként). ∗∗∗p < 0,001 vs. LPS.
A Galektin-3 funkcionális szerepének vizsgálatához a Galektin-3 siRNS-mediált genetikai knockdownját végeztük RAW 264.7 sejteket, és megvizsgáltuk a gyulladásos választ. A siRNS-szel történő géncsendesítés jelentősen, 52,95%-kal csökkentette a Galektin-3 expresszióját a RAW 264.7 sejtekben, amint azt a western blotting bizonyította (7A,B ábra). Figyelemre méltó, hogy a Galektin-3 siRNS-sel történő genetikai kiütése nem módosította az IL-6 LPS által kiváltott felszabadulását (7C ábra), míg a Galektin-3 genetikai kiütése jelentősen fokozta a hemin (egy hemoglobin-metabolit, amely nagy koncentrációban halmozódik fel az intrakraniális hematómákban) által kiváltott IL-6 felszabadulást (7D ábra), ami a Galektin-3 eddig feltáratlan szerepére utal az ICH utáni gyulladásos válasz modulálásában.
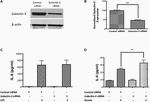
7. ábra. Galektin-3 és gyulladásos válasz (A) RAW 246.7 sejteket kezeltünk kontroll siRNS-sel vagy Galektin-3 siRNS-sel a módszereknél részletezettek szerint, és a Galektin-3 genetikai knockdownját (A) western blottinggal, majd (B) denzitometriás elemzéssel igazoltuk. ∗∗∗p < 0,001 vs. kontroll siRNS. (C) A Galektin-3 knockdown nem modulálta az IL-6 LPS-indukált felszabadulását (D), míg a kontrollhoz képest szignifikánsan nem szabályozta az IL-6 hemin-indukált felszabadulását RAW 246.7 sejtekből (n = 3 csoportonként). ∗∗p < 0,01 vs. hemin.
Diszkusszió
A galektinek az endogén szénhidrát-kötő fehérjék egy családja, amelyek kritikus szerepet játszanak mind fiziológiai, mind patológiai körülmények között azáltal, hogy kölcsönhatásba lépnek a sejtfelszíni glikozilált receptorokkal és modulálják az intracelluláris jelátviteli utakat (Perillo et al., 1995, 1998; Yang et al., 1996; Moiseeva et al., 1999; Vespa et al., 1999; Yamaoka et al., 2000; Goldring et al., 2002; Laaf et al., 2019). A galektinek jelentős szekvencia-hasonlóságot mutatnak szénhidrát-felismerő doménjükben (CRD), fokozott affinitással a β-galaktozidok iránt, és eredetileg az N-acetil-laktozamin nevű diszacharid felismerésének képessége határozta meg őket (Barondes és mtsai., 1994a,b; Kasai és Hirabayashi, 1996). A legújabb vizsgálatok azonban jelentős különbségeket mutatnak szénhidrátkötő tulajdonságaikban (Hirabayashi és mtsai., 2002; Leffler és mtsai., 2002; Carlsson és mtsai., 2007).
A galektin-1, a galektin család legubiquitábban expresszálódó tagja (Stillman és mtsai., 2006) szerepet játszik a veleszületett és adaptív immunitás szabályozásában, és intracelluláris és extracelluláris helyeken egyaránt jelen van (Verschuere és mtsai., 2014). A Galektin-1 extracelluláris funkciói nagyrészt a szénhidrát-kötő tulajdonságain alapulnak, míg az intracelluláris funkciók főként szénhidrát-független kölcsönhatásokat foglalnak magukban (Verschuere et al., 2014). A Galektin-1 perifériás immunválaszban betöltött szerepével összhangban a Galektin-1 ismert arról, hogy elnyomja a makrofágok aktiválódását (Barrionuevo et al., 2007), elősegíti a T-sejtek szelektív apoptózisát (Toscano et al., 2007), indukálja a gyulladáscsökkentő citokin, az IL-10 szekrécióját (van der Leij et al., 2004; Cedeno-Laurent et al., 2012), és csillapítja a makrofágok nitrogén-oxid (NO) termelését (Correa et al., 2003).
A galektin-1 az embrionális stádiumban széles körben expresszálódik az idegszövetekben, de éréskor főként a perifériás szövetekre korlátozódik (Horie és Kadoya, 2002). Következésképpen a sérülés nélküli agyi striatumban a Galektin-1 marginális expresszióját mutatták ki. Vérzéses agysérülést követően azonban nagyon figyelemre méltó Galektin-1 expressziót figyeltek meg a GFAP-pozitív asztrocitákban. Ezek mentén a Galektin-1 szerepet játszik az asztrociták differenciálódásában és az azt követő BDNF (Brain Derived Neurotrophic factor) felszabadulásában agysérülést követően, ami a Galektin-1 neuroprotektív szerepére utal (Sasaki és mtsai., 2004; Qu és mtsai., 2010). Továbbá a Galektin-1 szénhidrát-kötő képessége révén a felnőttkori neurogenezis egyik kulcsfontosságú szabályozója, és elősegíti a stroke utáni funkcionális helyreállást (Ishibashi és mtsai., 2007). A Galektin-1 adása csökkentette a neuronok apoptózisát, csökkentette az agyi infarktus térfogatát és javította az agyi iszkémia által kiváltott neurológiai funkciókat (Qu és mtsai., 2011). Emellett a natív és rekombináns galektin-1 megvédte az egér és patkány kisagyi neuronokat a glutamát neurotoxikus hatásaitól (Lekishvili és mtsai., 2006). Megjegyzendő, hogy a galektin-1 hatástalanítja a gyulladásos mikrogliát és véd a gyulladás által kiváltott neurodegenerációtól (Starossom és mtsai., 2012). Továbbá, vizsgálataink kimutatták, hogy a rekombináns Galektin-1 mérsékli egy proinflammatorikus citokin, az IL-6 felszabadulását LPS-stimulált RAW 264.7 egér makrofágokból a kontrollokhoz képest, ami a Galektin-1 negatív szabályozó szerepét implikálja a gyulladásban.
A Galektin-1 a CD45 egyik endogén ligandja (Walzel et al., 1999), amely szabályozza a mikroglia/macrofág aktivációt. Ezenkívül a Galektin-1 kölcsönhatása a CD45-tel e glikoproteinnek a plazmamembránon való megtartásához és foszfatáz aktivitásának fokozásához vezet. A legújabb vizsgálatok kimutatták, hogy a CD45 negatívan szabályozza a proinflammatorikus M1 mikroglia aktivációt, de elősegíti a gyulladáscsökkentő, M2 fenotípust a mitogén-aktivált protein kináz p38 (p38MAPK), a cAMP válaszelem kötő (CREB) és a nukleáris faktor kappa-light-chain-enhancer of activated B cells (NF-kB) jelátviteli útvonalak modulációján keresztül (Starossom és mtsai., 2012). Ez a hatás a Galektin-1-nek a CD45-ön lévő core 2 O-glikánokhoz való kötődésével járt együtt, ami arra utal, hogy az aktivált mikroglia/makrofágokon lévő glikánrészek kifejeződése szükséges a Galektin-1 kötődéséhez és működéséhez (Starossom és mtsai., 2012). Ezenkívül a Galektin-1 elnyomta a metamfetamin által kiváltott neuroinflammációt humán agyi mikrovaszkuláris endotélsejtekben (Parikh et al., 2015), és a Galektin-1 feltételezhetően részt vesz a neuritok kinövésében és a szinaptikus összeköttetésben. Összességében az adatok arra utalnak, hogy a Galektin-1 indukciója a reaktív asztrocitákban ICH után egy olyan intercelluláris kommunikációs mechanizmus lehet, amely elősegíti az asztrociták által közvetített neuroprotektív szabályozást ICH után, ami további vizsgálatot igényel.
A Galektin-3 egy 25-35 kDa méretű kiméra típusú fehérje, amelynek funkciói szorosan függnek a lokalizációtól (Thomas és Pasquini, 2018). A Galektin-3 expresszióját a sejtmagban és a citoplazmában találták (Liu és mtsai., 2002). Továbbá a makrofágok és az aktivált mikroglia felszabadíthatják a Galektin-3-at az extracelluláris térben, ami az extracelluláris mátrix átalakulásához, illetve megváltozott gyulladásos válaszhoz vezet (Li és mtsai., 2008; Jeon és mtsai., 2010). A klasszikus endoplazmatikus retikulum/Golgi szekréciós út helyett a Galektin-3 egy alternatív szekréciós útvonalat követ a szekréció és az export során (Mehul és Hughes, 1997), és a felszabaduláskor a Galektin-3 számos extracelluláris receptorral lép kölcsönhatásba. Bár a Galektin-3 szorosan kapcsolódik a gyulladásos reakciók kaszkádjához; a Galektin-3 pontos funkcionális szerepe a neuroinflammációban nagyrészt ellentmondásos. Arról azonban beszámoltak, hogy a mikroglia által felszabadított galektin-3 endogén TLR-4 (Toll Like Receptor-4) ligandumként viselkedik (Burguillos és mtsai., 2015). Továbbá a Galektin-3 genetikai deléciója csökkentette a neuronális veszteséget, és a Galektin-3 antitest adása neuroprotektív hatást fejtett ki a traumás agysérülés preklinikai modelljében (Yip és mtsai., 2017), ami együttesen a Galektin-3 károsító szerepére utal agysérülést követően. Ezzel szemben a Galektin-3 célzott deléciója súlyosbította az agyi iszkémiás agykárosodást és a neurodegenerációt agyi iszkémia után (Lalancette-Hebert és mtsai., 2012), ami a Gelectin-3 neuroprotektív szerepére utal agykárosodást követően. Ezenkívül a Gelectin-3 hozzájárul az angiogenezishez és a neurogenezishez, ami a poszt-iszkémiás agyi helyreállításban betöltött lehetséges szerepét implikálja (Yan és mtsai., 2009). A Galektin-3 elősegítette az oligodendroglia differenciálódását is, hozzájárulva a demyelinizáló rendellenességeket követő funkcionális helyreállításhoz (Pasquini és mtsai., 2011). A Galektin-3 ezen ellentmondásos funkcionális szerepe neuropathológiát követően a Galektin-3 eltérő szubcelluláris expressziójának vagy az agyi rendellenességek patofiziológiájának különbségének köszönhető, ami további vizsgálatot igényel.
Egyetértve más neuropathológiai állapotokkal, a Galektin-3 emelkedett expresszióját figyeltük meg ICH után, és az expresszió túlnyomórészt az Iba1 pozitív sejtekben, a CNS gyulladásos sejtjeiben volt megfigyelhető. Az Iba1 pozitív sejtek ICH után mikroglia vagy infiltráló makrofágok lehetnek, amelyek szerepet játszanak a veleszületett immunválaszban. A legújabb tanulmányok azt mutatják, hogy a mikroglia és a makrofágok eltérő szerepet játszhatnak az agyi patológiát követően (Gao és mtsai., 2017). Ennek mentén a primer mikroglia-kultúrával végzett vizsgálatok a Galektin-3 proinflammatorikus szerepét dokumentálják (Burguillos és mtsai., 2015), míg a makrofágokkal végzett vizsgálatok gyulladáscsökkentő szerepet mutatnak (MacKinnon és mtsai., 2008), ami további vizsgálatokat indokol. Továbbá, a Galektin-3 genetikai knockdownja RAW 246.7 sejtekben növelte az IL-6, egy proinflammatorikus citokin hemin-indukált felszabadulását, ami a Galektin-3 szerepét implikálja az ICH utáni gyulladásos válaszokban. Emellett a Galektin-3-at expresszáló mikroglia vagy makrofágok fagocitikus fenotípust mutattak, ami a mikroglia vagy makrofágok által közvetített fagocitózisban betöltött, eddig feltáratlan szerepére utal, amely kulcsszerepet játszik a hematóma feloldásában és az ICH utáni agyi regenerációban. Ezzel összhangban a legújabb jelentések szerint a parazita fertőzés során a CNS-ben felhalmozódó makrofágok bőségesen expresszálják a Galectin-3-at (Quenum Zangbede és mtsai., 2018), és az aktivált mikroglia a Galectin-3-on keresztül fagocitálja a sejteket (Nomura és mtsai., 2017). Ezenkívül az emelkedett plazma Galektin-3 szintek szoros összefüggésben álltak a gyulladással, a súlyossággal és a rossz kimenetellel az akut ICH-ban szenvedő betegeknél (Yan és mtsai., 2016). Ezért további vizsgálatokra van szükség a Galektin-3 ICH utáni funkcionális szerepének tisztázására.
Következtetés
A Galektin-1 és Galektin-3 nagyon mély és fokozott expressziót mutatott a 3. naptól a sérülés utáni 7. napig a perihematomális agyi régióban ICH után a Shamhez képest. Továbbá a Galektin-1 expressziója főként a GFAP-pozitív asztrocitákban volt megfigyelhető, míg a Galektin-3 expressziója főként az Iba1, valamint a CD16/32-pozitív sejtekben, a CNS gyulladásos sejtjeiben volt megfigyelhető. Ezen túlmenően genetikai vizsgálatok kimutatták mind a Galektin-1, mind a Galektin-3 negatív szabályozó szerepét egy proinflammatorikus citokin, az IL-6 felszabadulásában, az ingerület függvényében. Összességében az adatok arra utalnak, hogy a Galektin-1 és a Galektin-3 célpont lehet a gliás válaszok és ezáltal az ICH utáni agykárosodás modulálásában, ami további vizsgálatokat igényel.
Etikai nyilatkozat
Az állatkísérleteket az Augusta Egyetem kutatási és oktatási célú állatok felhasználásával foglalkozó bizottsága vizsgálta felül és hagyta jóvá, az NIH és az USDA irányelveinek megfelelően.
A szerzők hozzájárulása
FB végezte az immunhisztokémiai, valamint a sejtkultúrás vizsgálatokat és a Western blottingot, és részt vett az adatok elemzésében. SS-R fogalmazta meg és tervezte meg a kísérleteket, végezte az állatműtéteket, a genetikai vizsgálatokat és az adatelemzést, valamint megszerkesztette a kéziratot. Mindkét szerző elolvasta és jóváhagyta a végleges kéziratot.
Finanszírozás
Ezt a munkát a National Institutes of Health (R01NS107853) és az American Heart Association (14SDG18730034) támogatásával támogatta SS-R.
Érdekütközésre vonatkozó nyilatkozat
A szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségként értelmezhetők.
Kiegészítő anyag
A cikkhez tartozó kiegészítő anyag online elérhető a következő címen: https://www.frontiersin.org/articles/10.3389/fncel.2019.00157/full#supplementary-material
S1. ábra | A hematóma időbeli mintázata ICH után.
Rövidítések
CD16/32, Cluster of Differentiation 16/32; CD45: Cluster of Differentiation 45; CNS, központi idegrendszer; ELISA, enzimhez kötött immunszorbent assay; GFAP, gliális fibrilláris savas fehérje; Hb, hemoglobin; Iba1, ionizált kalciumkötő adaptor molekula 1; ICH, intracerebrális vérzés; LPS, lipopoliszacharid; NeuN, neuronális magok; PBS, foszfátpuffer sóoldat; RIPA, radioimmunoprecipitáció.
Aguilar, M. I, és Freeman, W. D. (2010). Spontán intracerebrális vérzés. Semin. Neurol. 30, 555-564.
Google Scholar
Ahmad, A. S., Mendes, M., Hernandez, D., and Dore, S. (2017). A laropiprant hatékonysága az agykárosodás minimalizálásában kísérletes intracerebrális vérzést követően. Sci. Rep. 7:9489.
PubMed Abstract | Google Scholar
Babu, R., Bagley, J. H., Di, C., Friedman, A. H., and Adamson, C. (2012). A trombin és a hemin mint központi tényezők az intracerebrális vérzés okozta másodlagos agykárosodás mechanizmusaiban és mint lehetséges beavatkozási célpontok. Neurosurg. Focus 32:E8.
PubMed Abstract | Google Scholar
Barondes, S. H., Castronovo, V., Cooper, D. N., Cummings, R. D., Drickamer, K., Feizi, T., et al. (1994a). Galektinek: állati béta-galaktozid-kötő lektinek családja. Cell 76, 597-598. doi: 10.1016/0092-8674(94)90498-7
CrossRef Full Text | Google Scholar
Barondes, S. H., Cooper, D. N., Gitt, M. A., and Leffler, H. (1994b). Galektinek. Az állati lektinek nagy családjának szerkezete és funkciója. J. Biol. Chem. 269, 20807-20810.
Google Scholar
Barrionuevo, P., Beigier-Bompadre, M., Ilarregui, J. M., Toscano, M. A., Bianco, G. A., Isturiz, M. A., et al. (2007). A galektin-1 új funkciója a veleszületett és az adaptív immunitás kereszteződésében: a galektin-1 egy nem apoptotikus ERK-függő útvonalon keresztül szabályozza a monocita/makrofág fiziológiát. J. Immunol. 178, 436-445. doi: 10.4049/jimmunol.178.1.436
PubMed Abstract | CrossRef Full Text | Google Scholar
Bonsack, F. T., Alleyne, C. H. Jr., and Sukumari-Ramesh, S. (2016). A TSPO fokozott expressziója intracerebrális vérzést követően: szerepe a gyulladásban? J. Neuroinflamm. 13:151.
PubMed Abstract | Google Scholar
Broderick, J., Connolly, S., Feldmann, E., Hanley, D., Kase, C., Krieger, D., et al. (2007). Irányelvek a spontán intracerebrális vérzés kezelésére felnőtteknél: 2007-es frissítés: az American Heart Association/american stroke association stroke council, high blood pressure research council, and the quality of care and outcomes in research interdiszciplináris munkacsoport iránymutatása. Circulation 116,e391-e413.
Google Scholar
Burguillos, M. A., Svensson, M., Schulte, T., Boza-Serrano, A., Garcia-Quintanilla, A., Kavanagh, E., et al. (2015). A mikroglia által szekretált galektin-3 a toll-like receptor 4 ligandjaként működik és hozzájárul a mikroglia aktivációhoz. Cell Rep. 10, 1626-1638. doi: 10.1016/j.celrep.2015.02.012
PubMed Abstract | CrossRef Full Text | Google Scholar
Cai, Y., Cho, G. S., Ju, C., Wang, S. L., Ryu, J. H., Shin, C. Y., et al. (2011). Az aktivált mikroglia kevésbé érzékeny a hemin toxicitásra a JNK és a p38 MAPK aktiváció nitrogén-oxid-függő gátlása miatt. J. Immunol. 187, 1314-1321. doi: 10.4049/jimmunol.1002925
PubMed Abstract | CrossRef Full Text | Google Scholar
Carlsson, S., Oberg, C. T., Carlsson, M. C., Sundin, A., Nilsson, U. J., Smith, D., et al. (2007). A galektin-8 és szénhidrát-felismerő doménjeinek affinitása ligandumokhoz oldatban és a sejtfelszínen. Glycobiology 17, 663-676. doi: 10.1093/glycob/cwm026
PubMed Abstract | CrossRef Full Text | Google Scholar
Carmichael, S. T., Vespa, P. M., Saver, J. L., Coppola, G., Geschwind, D. H., Starkman, S., et al. (2008). A károsodás és a védelem genomikus profiljai humán intracerebrális vérzésben. J. Cereb. Blood Flow Metab. 28, 1860-1875. doi: 10.1038/jcbfm.2008.77
PubMed Abstract | CrossRef Full Text | Google Scholar
Cedeno-Laurent, F., Opperman, M., Barthel, S. R., Kuchroo, V. K., and Dimitroff, C. J. (2012). A Galektin-1 immunregulációs szignatúrát vált ki a Th-sejtekben, amelyet funkcionálisan az IL-10 expresszió határoz meg. J. Immunol. 188, 3127-3137. doi: 10.4049/jimmunol.1103433
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen-Roetling, J., Kamalapathy, P., Cao, Y., Song, W., Schipper, H. M., and Regan, R. F. (2017). Az asztrocita heme-oxigenáz-1 csökkenti a mortalitást és javítja a kimenetelét kollagenáz-indukált intracerebrális vérzés után. Neurobiol. Dis. 102, 140-146. doi: 10.1016/j.nbd.2017.03.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Correa, S. G., Sotomayor, C. E., Aoki, M. P., Maldonado, C. A., and Rabinovich, G. A. (2003). A galektin-1 ellentétes hatásai az L-arginin alternatív metabolikus útjaira rezidens, gyulladásos és aktivált makrofágokban. Glycobiology 13, 119-128. doi: 10.1093/glycob/cwg010
PubMed Abstract | CrossRef Full Text | Google Scholar
Dang, T. N., Robinson, S. R., Dringen, R., and Bishop, G. M. (2011). A hemin felvétele, metabolizmusa és toxicitása tenyésztett neuronokban. Neurochem. Int. 58, 804-811. doi: 10.1016/j.neuint.2011.03.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Gao, H., Danzi, M. C., Choi, C. S., Taherian, M., Dalby-Hansen, C., Ellman, D. G., et al. (2017). A mikroglia és a makrofág TNFR2 ellentétes funkciói a kísérletes autoimmun encephalomyelitis patogenezisében. Cell Rep. 18, 198-212. doi: 10.1016/j.celrep.2016.11.083
PubMed Abstract | CrossRef Full Text | Google Scholar
Goldring, K., Jones, G. E., Thiagarajah, R., and Watt, D. J. (2002). A galektin-1 hatása a fibroblasztok és myoblasztok differenciálódására in vitro. J. Cell Sci. 115(Pt 2), 355-366.
PubMed Abstract | Google Scholar
Hickenbottom, S. L., Grotta, J. C., Strong, R., Denner, L. A., and Aronowski, J. (1999). Nukleáris faktor-kappaB és sejthalál kísérleti intracerebrális vérzés után patkányokban. Stroke 30, 2472-2477.
Google Scholar
Hirabayashi, J., Hashidate, T., Arata, Y., Nishi, N., Nakamura, T., Hirashima, M., et al. (2002). A galektinek oligoszacharid-specifikussága: keresés frontális affinitáskromatográfiával. Biochim. Biophys. Acta 1572, 232-254. doi: 10.1016/s0304-4165(02)00311-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Horie, H., and Kadoya, T. (2002). A galektin-1 alapvető szerepet játszik a felnőtt emlősök idegszöveteiben. Az oxidált galektin-1 szerepe. Glycoconjugate J. 19, 479-489. doi: 10.1023/b:glyc.0000014077.84016.52
PubMed Abstract | CrossRef Full Text | Google Scholar
Ishibashi, S., Kuroiwa, T., Sakaguchi, M., Sun, L., Kadoya, T., Okano, H., et al. (2007). A Galektin-1 szabályozza a neurogenezist a szubventrikuláris zónában és elősegíti a stroke utáni funkcionális felépülést. Exp. Neurol. 207, 302-313. doi: 10.1016/j.expneurol.2007.06.024
PubMed Abstract | CrossRef Full Text | Google Scholar
Jeon, S. B., Yoon, H. J., Chang, C. Y., Koh, H. S., Jeon, S. H., and Park, E. J. (2010). A galektin-3 citokinszerű szabályozó hatást fejt ki a JAK-STAT útvonalon keresztül. J. Immunol. 185, 7037-7046. doi: 10.4049/jimmunol.1000154
PubMed Abstract | CrossRef Full Text | Google Scholar
Kasai, K., and Hirabayashi, J. (1996). Galektinek: a glikokódokat megfejtő állati lektinek családja. J. Biochem. 119, 1-8. doi: 10.1093/oxfordjournals.jbchem.a021192
CrossRef Full Text | Google Scholar
Laaf, P., Elling, L., and Kren, V. (2019). Galektin-szénhidrát kölcsönhatások a biomedicinában és a biotechnológiában. Trends Biotechnol. 37, 402-415.
PubMed Abstract | Google Scholar
Laird, M. D., Sukumari-Ramesh, S., Swift, A. E., Meiler, S. E., Vender, J. R., and Dhandapani, K. M. (2010). A kurkumin enyhíti az agyi ödémát traumás agysérülést követően egerekben: az aquaporin-4 lehetséges szerepe? J. Neurochem. 113, 637-648. doi: 10.1111/j.1471-4159.2010.06630.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Lalancette-Hebert, M., Swarup, V., Beaulieu, J. M., Bohacek, I., Abdelhamid, E., Weng, Y. C., et al. (2012). A galektin-3 szükséges a rezidens mikroglia aktivációjához és proliferációjához iszkémiás sérülésre adott válaszként. J. Neurosci. 32, 10383-10395. doi: 10.1523/jneurosci.1498-12.2012
PubMed Abstract | CrossRef Full Text | Google Scholar
Leffler, H., Carlsson, S., Hedlund, M., Qian, Y., and Poirier, F. (2002). Bevezetés a galektinekbe. Glycoconjugate J. 19, 433-440. doi: 10.1023/b:glyc.0000014072.34840.04
CrossRef Full Text | Google Scholar
Leira, R., Davalos, A., Silva, Y., Gil-Peralta, A., Tejada, J., Garcia, M., et al. (2004). Korai neurológiai romlás intracerebrális vérzésben: előrejelzők és kapcsolódó tényezők. Neurology 63, 461-467. doi: 10.1212/01.wnl.0000133204.81153.ac
CrossRef Full Text | Google Scholar
Lekishvili, T., Hesketh, S., Brazier, M. W., and Brown, D. R. (2006). Az egér galektin-1 gátolja a glutamát toxicitását az NR1 NMDA receptor expressziójának módosításával. Eur. J. Neurosci. 24, 3017-3025. doi: 10.1111/j.1460-9568.2006.05207.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, Y., Komai-Koma, M., Gilchrist, D. S., Hsu, D. K., Liu, F. T., Springall, T., et al. (2008). A galektin-3 a lipopoliszacharid által közvetített gyulladás negatív szabályozója. J. Immunol. 181, 2781-2789. doi: 10.4049/jimmunol.181.4.2781
PubMed Abstract | CrossRef Full Text | Google Scholar
Lin, S., Yin, Q., Zhong, Q., Lv, F. L., Zhou, Y., Li, J. Q., et al. (2012). A hem aktiválja a TLR4 által közvetített gyulladásos sérülést a MyD88 / TRIF jelátviteli útvonalon keresztül az intracerebrális vérzésben. J. Neuroinflamm. 9:46.
PubMed Abstract | Google Scholar
Liu, F. T., Patterson, R. J., and Wang, J. L. (2002). A galektinek intracelluláris funkciói. Biochim. Biophys. Acta 1572, 263-273. doi: 10.1016/s0304-4165(02)0031313-6
CrossRef Full Text | Google Scholar
MacKinnon, A. C., Farnworth, S. L., Hodkinson, P. S., Henderson, N. C., Atkinson, K. M., Leffler, H., et al. (2008). Az alternatív makrofág aktiváció szabályozása a galektin-3 által. J. Immunol. 180, 2650-2658. doi: 10.4049/jimmunol.180.4.2650
CrossRef Full Text | Google Scholar
Mehul, B., and Hughes, R. C. (1997). A galektin 3 plazmamembrán-célzása, vezikuláris bimbózása és felszabadulása emlőssejtek citoplazmájából a szekréció során. J. Cell Sci. 110( Pt 10), 1169-1178.
PubMed Abstract | Google Scholar
Min, H., Choi, B., Jang, Y. H., Cho, I. H., and Lee, S. J. (2017). A hem-molekula az asztrocita TLR2 endogén agonistájaként működik, hogy hozzájáruljon a másodlagos agykárosodáshoz az intracerebrális vérzést követően. Mol. Brain 10:27.
PubMed Abstract | Google Scholar
Moiseeva, E. P., Spring, E. L., Baron, J. H., and de Bono, D. P. (1999). A galektin 1 modulálja a tenyésztett érrendszeri simaizomsejtek kötődését, terjedését és migrációját a sejtreceptorokkal és az extracelluláris mátrix komponenseivel való kölcsönhatásokon keresztül. J. Vasc. Res. 36, 47-58. doi: 10.1159/000025625
PubMed Abstract | CrossRef Full Text | Google Scholar
Nomura, K., Vilalta, A., Allendorf, D. H., Hornik, T. C., and Brown, G. C. (2017). Aktivált mikroglia desialilálja és fagocitálja a sejteket a neuraminidázon keresztül. Galektin-3 és a Mer tirozin kináz segítségével. J. Immunol. 198, 4792-4801. doi: 10.4049/jimmunol.1502532
PubMed Abstract | CrossRef Full Text | Google Scholar
Parikh, N. U., Aalinkeel, R., Reynolds, J. L., Nair, B. B., Sykes, D. E., Mammen, M. J., et al. (2015). A galektin-1 elnyomja a metamfetamin által kiváltott neuroinflammációt emberi agyi mikrovaszkuláris endotélsejtekben: neuroprotektív szerep a vér-agy gát integritásának fenntartásában. Brain Res. 1624, 175-187. doi: 10.1016/j.brainres.2015.07.033
PubMed Abstract | CrossRef Full Text | Google Scholar
Pasquini, L. A., Millet, V., Hoyos, H. C., Giannoni, J. P., Croci, D. O., Marder, M., et al. (2011). A galektin-3 irányítja az oligodendrociták differenciálódását a mielin integritásának és funkciójának szabályozására. Cell Death. Diff. 18, 1746-1756. doi: 10.1038/cdd.2011.40
PubMed Abstract | CrossRef Full Text | Google Scholar
Perillo, N. L., Marcus, M. E., and Baum, L. G. (1998). Galektinek: a sejtadhézió, a sejtproliferáció és a sejthalál sokoldalú modulátorai. J. Mol. Med. (Berl.) 76, 402-412. doi: 10.1007/s001090050232
PubMed Abstract | CrossRef Full Text | Google Scholar
Perillo, N. L., Pace, K. E., Seilhamer, J. J., and Baum, L. G. (1995). A T-sejtek galektin-1 által közvetített apoptózisa. Nature 378, 736-739. doi: 10.1038/378736a0
PubMed Abstract | CrossRef Full Text | Google Scholar
Platt, N., da Silva, R. P., and Gordon, S. (1998). A halál felismerése: az apoptotikus sejtek fagocitózisa. Trends Cell Biol. 8, 365-372. doi: 10.1016/s0962-8924(98)01329-4
CrossRef Full Text | Google Scholar
Qu, W. S., Wang, Y. H., Ma, J. F., Tian, D. S., Zhang, Q., Pan, D. J., et al. (2011). A galektin-1 csillapítja az asztrogliózissal kapcsolatos sérüléseket és javítja a patkányok felépülését fokális agyi iszkémia után. J. Neurochem. 116, 217-226. doi: 10.1111/j.1471-4159.2010.07095.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Qu, W. S., Wang, Y. H., Wang, J. H., Wang, J. P., Tang, Y. X., Zhang, Q., Tian, D. S., et al. (2010). A galektin-1 fokozza az asztrociták BDNF-termelését és javítja a funkcionális eredményt patkányokban iszkémia után. Neurochem. Res. 35, 1716-1724. doi: 10.1007/s11064-010-0234-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Quenum Zangbede, F. O., Chauhan, A., Sharma, J., and Mishra, B. B. (2018). A galektin-3 az M2 makrofágokban védő szerepet játszik a neuropatológia feloldásában agyi parazita fertőzésben a neutrofil forgalom szabályozásával. J. Neurosci. 38, 6737-6750. doi: 10.1523/jneurosci.3575-17.2018
PubMed Abstract | CrossRef Full Text | Google Scholar
Qureshi, A. I., Ling, G. S., Khan, J., Suri, M. F., Miskolczi, L., Guterman, L. R., et al. (2001a). A sérült, nekrotikus és apoptotikus sejtek mennyiségi elemzése az intracerebrális vérzés új kísérleti modelljében. Crit. Care Med. 29, 152-157. doi: 10.1097/00003246-200101000-00030
PubMed Abstract | CrossRef Full Text | Google Scholar
Qureshi, A. I., Tuhrim, S., Broderick, J. P., Batjer, H. H., Hondo, H., and Hanley, D. F. (2001b). Spontán intracerebrális vérzés. N. Engl. J. Med. 344, 1450-1460.
Google Scholar
Ribo, M., and Grotta, J. C. (2006). Az intracerebrális vérzés legújabb eredményei. Curr. Neurol. Neurosci. Rep. 6, 17-22. doi: 10.1007/s11910-996-0004-0
CrossRef Full Text | Google Scholar
Robinson, S. R., Dang, T. N., Dringen, R., and Bishop, G. M. (2009). Hemin toxicitás: a hemorrhagiás stroke-ot követő agykárosodás megelőzhető forrása. Redox Rep. 14, 228-235. doi: 10.1179/135100009×12525712409931
PubMed Abstract | CrossRef Full Text | Google Scholar
Sasaki, T., Hirabayashi, J., Manya, H., Kasai, K., and Endo, T. (2004). A galektin-1 indukálja az asztrociták differenciálódását, ami az agyi eredetű neurotrofikus faktor termeléséhez vezet. Glycobiology 14, 357-363. doi: 10.1093/glycob/cwh043
PubMed Abstract | CrossRef Full Text | Google Scholar
Shiratori, M., Tozaki-Saitoh, H., Yoshitake, M., Tsuda, M., and Inoue, K. (2010). A P2X7 receptor aktivációja NFAT és PKC/MAPK útvonalakon keresztül indukálja a mikroglia CXCL2 termelését. J. Neurochem. 114, 810-819. doi: 10.1111/j.1471-4159.2010.06809.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Starossom, S. C., Mascanfroni, I. D., Imitola, J., Cao, L., Raddassi, K., Hernandez, S. F., et al. (2012). A galektin-1 deaktiválja a klasszikusan aktivált mikrogliát és véd a gyulladás által kiváltott neurodegenerációtól. Immunity 37,249-263. doi: 10.1016/j.immuni.2012.05.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Stillman, B. N., Hsu, D. K., Pang, M., Brewer, C. F., Johnson, P., Liu, F. T., et al. (2006). A galektin-3 és a galektin-1 különböző sejtfelszíni glikoprotein receptorokhoz kötődve indukálja a T-sejtek halálát. J. Immunol. 176, 778-789. doi: 10.4049/jimmunol.176.2.778
PubMed Abstract | CrossRef Full Text | Google Scholar
Sukumari-Ramesh, S., and Alleyne, C. H. Jr. (2016). A tert-butil-hidrokinon sérülés utáni adagolása csillapítja az akut neurológiai sérülést az intracerebrális vérzést követően egerekben. J. Mol. Neurosci. MN 58, 525-531. doi: 10.1007/s12031-016-0722-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Sukumari-Ramesh, S., Alleyne, C. H. Jr., and Dhandapani, K. M. (2012a). A survivin asztrocita-specifikus expressziója intracerebrális vérzést követően egerekben: lehetséges szerep a reaktív gliózisban? J. Neurotrauma 29, 2798-2804. doi: 10.1089/neu.2011.2243
PubMed Abstract | CrossRef Full Text | Google Scholar
Sukumari-Ramesh, S., Alleyne, C. H. Jr., and Dhandapani, K. M. (2012b). Asztrogliózis: a beavatkozás célpontja az intracerebrális vérzésben? Transl. Stroke Res. 3(Suppl. 1), 80-87. doi: 10.1007/s12975-012-0165-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Sukumari-Ramesh, S., Alleyne, C. H. Jr., and Dhandapani, K. M. (2016). A hiszton-deacetiláz inhibitor szuberoylanilid-hidroxaminsav (SAHA) akut neuroprotekciót biztosít az intracerebrális vérzést követően egerekben. Transl. Stroke Res. 7, 141-148. doi: 10.1007/s12975-015-0421-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Tessier, P. A., Naccache, P. H., Clark-Lewis, I., Gladue, R. P., Neote, K. S., and McColl, S. R. (1997). Kemokin hálózatok in vivo: a C-X-C és C-C kemokinek részvétele a neutrofil extravasációban in vivo TNF-alfa hatására. J. Immunol. 159, 3595-3602.
PubMed Abstract | Google Scholar
Thomas, L., and Pasquini, L. A. (2018). A galektin-3 által közvetített gliális crosstalk irányítja az oligodendrocita differenciálódást és a (re)myelinizációt. Front. Cell. Neurosci. 12:297. doi: 10.3389/fncel.2018.00297
PubMed Abstract | CrossRef Full Text | Google Scholar
Toscano, M. A., Bianco, G. A., Ilarregui, J. M., Croci, D. O., Correale, J., Hernandez, J. D., et al. (2007). A TH1, TH2 és TH-17 effektor sejtek differenciális glikozilációja szelektíven szabályozza a sejthalálra való érzékenységet. Nat. Immunol. 8, 825-834. doi: 10.1038/ni1482
PubMed Abstract | CrossRef Full Text | Google Scholar
van Asch, C. J., Luitse, M. J., Rinkel, G. J., van der Tweel, I., Algra, A., and Klijn, C. J. (2010). Az intracerebrális vérzés előfordulása, halálozási aránya és funkcionális kimenetele az idő múlásával, életkor, nem és etnikai származás szerint: szisztematikus áttekintés és metaanalízis. Lancet Neurol. 9, 167-176. doi: 10.1016/s1474-4422(09)70340-0
PubMed Abstract | CrossRef Full Text | Google Scholar
van der Leij, J., van den Berg, A., Blokzijl, T., Harms, G., van Goor, H., Zwiers, P., et al. (2004). A dimerikus galektin-1 IL-10 termelést indukál a T-limfocitákban: fontos eszköz az immunválasz szabályozásában. J. Pathol. 204, 511-518. doi: 10.1002/path.1671
PubMed Abstract | CrossRef Full Text | Google Scholar
Verschuere, T., Toelen, J., Maes, W., Poirier, F., Boon, L., Tousseyn, T., et al. (2014). A gliomából származó galektin-1 szabályozza a veleszületett és adaptív tumorellenes immunitást. Int. J. Cancer 134, 873-884. doi: 10.1002/ijc.28426
PubMed Abstract | CrossRef Full Text | Google Scholar
Vespa, G. N., Lewis, L. A., Kozak, K. R., Moran, M., Nguyen, J. T., Baum, L. G., et al. (1999). A galektin-1 specifikusan modulálja a TCR jeleket, hogy fokozza a TCR apoptózist, de gátolja az IL-2 termelést és a proliferációt. J. Immunol. 162, 799-806.
PubMed Abstract | Google Scholar
Walzel, H., Schulz, U., Neels, P., and Brock, J. (1999). Galektin-1, a CD45 receptor-típusú fehérje-tirozin-foszfatáz természetes ligandja. Immunol. Lett. 67, 193-202. doi: 10.1016/s0165-2478(99)00012-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, J. (2010). Az intracerebrális vérzést követő gyulladás preklinikai és klinikai kutatása. Prog. Neurobiol. 92, 463-477. doi: 10.1016/j.pneurobio.2010.08.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, J., and Dore, S. (2007). Gyulladás intracerebrális vérzést követően. J. Cereb. Blood Flow Metab. 27, 894-908.
Google Scholar
Weng, X., Tan, Y., Chu, X., Wu, X. F., Liu, R., Tian, Y., et al. (2015). Az N-metil-D-aszparaginsav receptor 1 (NMDAR1) súlyosbítja a hemin-NLRP3 útvonal által indukált másodlagos gyulladásos károsodást az intracerebrális vérzést követően. Chin. J. Traumatol. 18, 254-258. doi: 10.1016/j.cjtee.2015.11.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Yamaoka, K., Mishima, K., Nagashima, Y., Asai, A., Sanai, Y., and Kirino, T. (2000). A galektin-1 mRNS expressziója korrelál a humán gliómák malignus potenciáljával, és az antisense galektin-1 expressziója gátolja 9 glióma sejt növekedését. J. Neurosci. Res. 59, 722-730. doi: 10.1002/(sici)1097-4547(20000315)59:6<722::aid-jnr4>3.0.co;2-h
PubMed Abstract | CrossRef Full Text | Google Scholar
Yan, X. J., Yu, G. F., Jie, Y. Q., Fan, X. F., Huang, Q. és Dai, W. M. (2016). A galektin-3 szerepe a plazmában, mint a kimenetel előrejelző biomarkere akut intracerebrális vérzést követően. J. Neurol. Sci. 368, 121-127. doi: 10.1016/j.jns.2016.06.071
PubMed Abstract | CrossRef Full Text | Google Scholar
Yan, Y. P., Lang, B. T., Vemuganti, R., and Dempsey, R. J. (2009). A galektin-3 közvetíti az iszkémiát követő szöveti remodellinget. Brain Res. 1288, 116-124. doi: 10.1016/j.brainres.2009.06.073
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, R. Y., Hsu, D. K., and Liu, F. T. (1996). A galektin-3 expressziója modulálja a T-sejtek növekedését és apoptózisát. Proc. Natl. Acad. Sci. U.S.A. 93, 6737-6742. doi: 10.1073/pnas.93.13.6737
PubMed Abstract | Ref Full Text | Google Scholar
Yip, P. K., Carrillo-Jimenez, A., King, P., Vilalta, A., Nomura, K., Chau, C. C., et al. (2017). A traumás agysérülésre válaszul felszabaduló galektin-3 az agyi immunválaszt hangszerelő és a neurodegenerációt elősegítő alarminként működik. Sci. Rep. 7:41689.
PubMed Abstract | Google Scholar
Zhao, X., Zhang, Y., Strong, R., Zhang, J., Grotta, J. C., and Aronowski, J. (2007). Az intracerebrális vérzés által kiváltott változások eltérő mintázatai az NF-kappaB alegység, az iNOS és a COX-2 expressziójában. J. Neurochem. 101, 652-663. doi: 10.1111/j.1471-4159.2006.04414.x
PubMed Abstract | CrossRef Full Text | Google Scholar
.