- Introduction
- anyagok és módszerek
- állatok és tartás
- Gaboxadol kezelés és kísérleti menetrend
- A nyílt mező teszt (OFT)
- Soros sikátorok tesztje (SAT)
- Fény-sötét felfedező teszt (LDT)
- Szociális interakció (SI), agresszív viselkedés
- Sztereotípia
- Self-grooming
- Statisztikai elemzés
- Eredmények
- A gaboxadol normalizálja az Fmr1 KO2 egerekben megfigyelt hiperaktivitást
- Az Fmr1 KO2 egerek szorongásszerű viselkedését a gaboxadol normalizálja
- Az Fmr1 KO2 egerek ingerlékenységét és agresszív viselkedését normalizálja a gaboxadol
- Gaboxadol normalizálja az ismétlődő viselkedést Fmr1 KO2 egerekben
- Diszkusszió
- Etikai nyilatkozat
- A szerzők hozzájárulása
- Finanszírozás
- Interdekütközési nyilatkozat
Introduction
A törékeny X-szindróma (FXS) az értelmi fogyatékosság és az autizmus leggyakoribb öröklött formája, melynek becsült gyakorisága 1:4000-5000, és világszerte minden etnikai csoportot érint (Gross et al., 2015). Az FXS-szindrómában szenvedő egyéneknél fokozott a kockázata egy sor társuló viselkedési problémának, többek között: figyelemzavarok, hiperaktivitás, szorongás és számos, az autizmushoz társuló jellemző, beleértve a motoros sztereotípiákat, a szociális kerülést, az önkárosító viselkedést és az agressziót (Hagerman et al., 2010). Emellett az FXS-ben szenvedő egyének hajlamosak a társbetegségként jelentkező orvosi problémákra, beleértve a rohamokat, alvászavarokat, gyomor-bélrendszeri nehézségeket és kötőszöveti problémákat. Az FXS-ben szenvedő egyéneknek viselkedési beavatkozásokat és a diszkrét tünetek farmakológiai kezelését kínálják, de jelenleg nincsenek FDA által jóváhagyott terápiák a szindróma egészének kezelésére.
Az FXS az FMR1 gén mutációinak eredménye, amelyek blokkolják a törékeny X mentális retardációs fehérje (FMRP) expresszióját. Az FMRP egy ubiquitikusan expresszálódó mRNS-kötő fehérje, amely a szinaptikus fehérjék 4-8%-ának szállításához és transzlációjához szükséges, és így számos szinaptikus funkciót szabályoz (Bassell és Warren, 2008). Az FMRP szerepét az FXS-ben és a terápiás jelöltek értékelését nagyrészt az Fmr1 knockout (KO) egérmodell alkalmazásával tanulmányozták, amelyet először a Holland-Belga Törékeny X Konzorcium jellemzett (Bakker és mtsai., 1994). Az Fmr1 KO-t egy neomicin kazetta célzott beillesztésével hozták létre az FMR1 gén 5. exonjába, ami olyan egeret eredményezett, amelynek FMRP fehérje szintje nem volt kimutatható, és alacsony volt a maradék Fmr1 mRNS szintje (Bakker et al., 1994). Az Fmr1 KO2 egér az Fmr1 promóterének és első exonjának deléciójával létrehozott új null allélt célozza meg az Fmr1-ben (Mientjes és mtsai., 2006). Ez mind fehérje-, mind mRNS-null. Ezt a modellt széles körben használták gyógyszerkísérletekhez (Deacon et al., 2015; Cheng et al., 2017; Gaudissard et al., 2017; Dahlhaus, 2018; Leboucher et al., 2019; Tranfaglia et al., 2019), és a viselkedési tesztek akkumulátora nagyrészt a hiperaktivitásra, a hallási ingerekre való fokozott érzékenységre, a sztereotípiákra és a tanulási és emlékezeti hiányosságokra összpontosított (Olmos-Serrano et al., 2011). Sejt- és áramköri szinten az FXS egerekkel végzett vizsgálatok nagyrészt a metabotróp glutamát receptor 5 (mGluR5) túlműködő jelátvitelére (Dölen et al., 2007), a fokozott fehérjeszintézisre (Osterweil et al., 2010) és a fokozott hosszú távú potenciációra (LTP; Auerbach és Bear, 2010).
Az FXS egy γ-aminovajsav (GABA)ergikus hipotézise is felmerült az FXS-ben szenvedő egyének és az Fmr1 gén egy aktív példányát hiányzó egerek megfigyelései alapján. A GABA az elsődleges gátló neurotranszmitter az agyban, és posztszinaptikusan gyors ionotróp (GABAA) vagy lassú metabotróp (GABAB) receptorokon keresztül jelez. A GABAA-receptor-populáción belül további különbséget tesznek szinaptikus és extrasinaptikus receptorok között, amelyek a fázisos és a tónusos gátlást közvetítik (Olmos-Serrano és mtsai., 2010; Meera és mtsai., 2011). A GABAerg hipotézis alátámasztására az FXS-ben szenvedő egyének csökkent GABAA receptor elérhetőséget mutatnak (D’Hulst et al., 2015). Az FXS-ben szenvedő egyének ezen eredménye szépen párhuzamba állítható a betegség egérmodelljének eredményeivel.
A molekuláris vizsgálatok a GABAerg gépezet csökkenését mutatták ki, beleértve a GABA-receptor alegységek, a GABA-transzporter (Rotschafer et al., 2015) és a glutaminsavdekarboxiláz (GAD; D’Hulst és Kooy, 2007; Olmos-Serrano et al., 2010) változásait. Pontosabban, a GABAA receptor alegység delta alegységét kódoló gén mRNS-szintjének – amely a receptorok extrasinaptikus populációjára jellemző – csökkenéséről számoltak be (Gantois és mtsai., 2006). A GABAerg funkciót tekintve a szinaptikus GABA felszabadulása csökkent, és a fázisos és tónusos gátlás csökkent az amygdalában (Olmos-Serrano és mtsai., 2010).
A viselkedés tekintetében az FX egerekben megfigyelt hiperaktivitás, auditív riasztás, valamint tanulás és memória összefüggésbe hozható a kisagyba és az amygdalába érkező GABAerg bemenetekből származó gátló tónus csökkenésével (Olmos-Serrano és mtsai, 2010), két olyan agyi régióval, amely az emberi FXS-hez is kapcsolódik (Lightbody és Reiss, 2009; Hall et al, 2013).
Még kritikusabb, hogy a delta-alegységet tartalmazó extrasinaptikus GABAA-receptorok (dSEGA-k) szelektív potenciálása gaboxadollal, más néven OV101 és 4,5,6,7-tetrahidroizoxazolo(5,4-c)piridin-3-ollal (THIP) normalizálta az Fmr1 KO egerekben az aberrált hiperaktivitást és a hallási riasztó válaszokat (Olmos-Serrano et al., 2010). Fontos, hogy ezeket az eredményeket olyan expozíciók mellett figyelték meg, amelyek megegyeznek azokkal, amelyeknél a gaboxadol jól tolerálható az emberekben (Meera és mtsai., 2011).
Mivel a kezdeti klinikai vizsgálatok még nem mutatták ki az mGluR5-gátlók terápiás előnyeit (Scharf és mtsai., 2015), a jelen vizsgálatban olyan megközelítéseket kerestünk, amelyek közvetlenebbül tájékoztathatnak egy klinikai tervről, beleértve az FXS fenotípus szélesebb, korábban nem közölt aspektusait. Konkrétan itt a gaboxadol különböző dózisainak a hiperaktivitásra, a szorongásra, az agresszióra és a repetitív viselkedésre gyakorolt hatását vizsgáltuk az FXS Fmr1 KO2 modelljében, bizonyítva a gaboxadol hatékonysági potenciálját az említett FXS-tünetek kezelésében.
anyagok és módszerek
állatok és tartás
Fmr1 KO2 egerek, amelyeket korábban az Fmr1 promóterének és első exonjának deléciójával hoztak létre, ami mRNS és fehérje null egereket eredményezett (Mientjes et al, 2006), minden kísérlethez felhasználtuk. A floxált Fmr1 egereket egy korai, ubikvitálisan expresszálódó Cre-rekombinázt expresszáló egerekkel párosítottuk, ami az Fmr1 eliminációját eredményezte minden sejtből. A KO egereket legalább nyolc generáción keresztül visszakeresztezték C57BL/6J egerekkel, és kontrollként vad típusú (WT) alomtestvéreket használtak. Minden egyes kezelési csoportban tíz egeret (hímek, 2 hónapos korúak) használtunk az összes viselkedési kísérletben. Heterozigóta tenyészpárokat használtunk WT és KO alomtestvérek létrehozására minden vizsgálathoz. A hímeket a születés után eltávolítottuk a tenyészketrecekből, a nőstényeket selejteztük az alomból, és a genotipizálást a TransnetXY Automated Genotyping (Transnetyx, Inc., Cordova, TN, USA) segítségével végeztük a bevált primerek és protokoll segítségével. Az ugyanabban a ketrecben lévő egereknek ugyanazt a gaboxadol- vagy hordozóanyag-dózist adtuk be, és a mutánsokat és a kontrollokat külön helyeztük el. Minden egeret műanyag ketrecekben (35 × 30 × 12 cm) helyeztek el csoportosan, ketrecenként ötöt, és a vizsgálat előtt legalább egy hétig szoktatták őket az állattartó létesítményhez. A helyiség hőmérsékletét (21 ± 2°C), a relatív páratartalmat (55 ± 5%), a 12 órás fény-sötét ciklust (világítás reggel 7-től este 7-ig) és a légcserét (óránként 16-szor) automatikusan szabályozták. Minden egér ad libitum jutott táplálékhoz és vízhez. Minden vizsgálatot világos fázisban végzett egy, a genotípusra és a gyógyszeres kezelésre vak vizsgáló. A tartás és a kísérletek a GeN DDI Limited (London, Egyesült Királyság) telephelyén történtek az Egyesült Királyság 1986. évi Állatokról (Tudományos eljárásokról) szóló törvényének követelményei szerint.
Gaboxadol kezelés és kísérleti menetrend
Fmr1 KO2 egerekbe vivőanyagot (0.9%-os steril sóoldatot) vagy gaboxadolt (0,5, 1, 1,5, 2, 3, 4 vagy 5 mg/kg, i.p.) 30 perccel a viselkedési vizsgálat előtt minden vizsgálati napon, az egyes vizsgálatok között háromnapos szünettel, hogy elkerüljük a gyógyszer beadásának kumulatív hatását. A vad típusú egereket, amelyeknek ugyanebben az időpontban vivőanyagot adtak be, szintén bevonták minden kísérletbe. Az egerek viselkedési szűrését (csoportonként n = 10) a következő sorrendben végeztük el, 2-3 nap különbséggel az egyes tesztek között: Nyílt mező teszt (OFT; 1. nap), egymást követő sikátorok (4. nap), világos/sötét doboz (7. nap), szociális tesztek és agresszió (10. nap), valamint önápolás és sztereotípia (12. nap).
A nyílt mező teszt (OFT)
Az 1. vizsgálati napon az OFT-t egy VersaMax aktivitásmérő kamrában (AccuScan Instruments, Columbus, OH, USA) végeztük. A lokomotoros aktivitást 30 percig rögzítették egy nagy plexikamrában (40 × 40 cm), amelyet 40 lux fényerővel világítottak meg. Az aktivitást infravörös sugárszünetekkel követtük nyomon, amelyeket 1 perces bázisokká kombináltunk és a VersaDat szoftver (AccuScan Instruments, Columbus, OH, USA) segítségével dekódoltunk, hogy meghatározzuk a megtett távolságot (cm), a megtett középtávolságot (cm), az óramutató járásával megegyező és ellentétes irányú fordulatokat (legalább 5.08 cm átmérőjű), valamint az ismétlődő gerendatöréseket.
Soros sikátorok tesztje (SAT)
A 4. vizsgálati napon az egereket az egymást követő sikátorok tesztjének (SAT) vetették alá. A SAT előnye az emelt plusz labirintussal szemben, hogy a szorongásszintek szélesebb skáláját zárja be (Deacon, 2013). A tesztkamra négy egymást követő, lineárisan elrendezett, egyre inkább anxiogén (világosabb színű, alacsonyabb falú, keskenyebb) sikátorból állt, amelyek 25 cm hosszúak és 50 cm magasan voltak a talajtól. Az egereket 5 percig figyelték a készülék felett elhelyezett 60 W-os vörös fény alatt. Az egyes sikátorokba való belépések számát rögzítettük.
Fény-sötét felfedező teszt (LDT)
A 7. vizsgálati napon az egerek fény-sötét felfedező tesztet (LDT) végeztek. Az LDT-t széles körben használják az egerek szorongásszerű viselkedésének mérésére, amely a világos, nyitott terektől való veleszületett félelmükön alapul (Prut és Belzung, 2003). A polipropilén vizsgálati kamrát (44 × 21 × 21 cm) egy kisebb, sötét, fedett rekeszre (14 cm) és egy nagyobb, világos megvilágítású, nyitott rekeszre (28 cm) osztottuk egy kis nyílású (13 × 5 cm) sötét válaszfallal. A rekeszek közötti átmeneteket a válaszfal nyílásában elhelyezett fotocellák rögzítették. Minden egeret a válaszfaltól elfordított világos oldalra helyeztek, 10 percig szabadon felfedezhették a kamrát, majd a kamrák közötti átmeneteket rögzítették.
Szociális interakció (SI), agresszív viselkedés
A 10. vizsgálati napon a szociális interakció (SI) és az agresszió vizsgálatát az otthoni ketrechez hasonló méretű (40 × 23 × 12 cm), az egerek megtekintését megkönnyítő plexiüveg fedéllel ellátott ketrecben végezték. Az egereket 25 percig szoktattuk a vizsgálati helyiséghez. Ezután két alany, egy kísérleti egér és egy vad típusú “teszt” egér egyszerre került a vizsgálati ketrecbe. A szociális vizsgálódások teljes időtartamát és számát, a farokcsörgést, a harapások számát és a felcsatolások számát felülről rögzítettük és 3 percig mértük.
Sztereotípia
A 12. vizsgálati napon a spontán sztereotípiák (fejmozgások) arányát egy módosított, automatizált fotocellás készülékkel (Columbus Instruments, Columbus, OH, USA) mértük. A vizsgálati protokoll szerint az egereket kivették az otthoni ketrecükből, és egyenként plexiüveg tesztketrecekbe (22 × 25 × 28 cm) helyezték őket. Az egereket 2 percig hagyták háborítatlanul, hogy hozzászokjanak a vizsgálati kamrához. Ezután minden egeret 3 percig figyeltünk, hogy sztereotípiás pontszámot kapjunk, amely megfelel az óránkénti átlagos sztereotípiás gyakoriságnak. A vizsgálati időszak alatt élelmet és vizet biztosítottunk. A sztereotípiaszám annak a számszerűsítése, hogy egy egér hányszor zavarja meg ugyanazt az infravörös sugarat a vizsgálóberendezés által mért sztereotip tevékenység során.
Self-grooming
A 12. vizsgálati napon szintén megfigyelték az öngondoskodást. Minden egyes egeret külön-külön helyeztek el egy standard egérketrecben (46 × 23,5 × 20 cm), amelyet 40 lux fényerővel világítottak meg. A tesztketrecben töltött 5 perces szoktatási időszak után 3 percen keresztül rögzítettük a bármely testrész ápolására fordított kumulatív időt, hogy meghatározzuk a bármely testrész ápolására fordított kumulatív időt (másodpercben).
Statisztikai elemzés
Mivel az Fmr1 KO2 egereket gaboxadollal vagy hordozóval kezelték, de a WT egereket csak hordozóval kezelték, a parametrikus adatokat egyirányú varianciaelemzéssel (ANOVA) és Tukey post hoc teszttel elemeztük. Minden adatot GraphPad Prism v7.0 (GraphPad Software, San Diego, CA, USA) segítségével elemeztünk. A statisztikai szignifikanciát P < 0,05-nél állapítottuk meg.
Eredmények
A gaboxadol normalizálja az Fmr1 KO2 egerekben megfigyelt hiperaktivitást
A hiperaktivitás az emberi FXS egyik kiemelkedő jellemzője (Bailey et al, 2008; Wheeler et al., 2014; Hagerman et al., 2017), és megbízhatóan reprodukálható a korábban jellemzett holland-belga Fmr1 KO egérben (Olmos-Serrano et al., 2010; Kazdoba et al., 2014). Annak tesztelésére, hogy az Fmr1 KO2 egerek mozgásszervi hiperaktivitást mutatnak-e, és hogy a gaboxadol normalizálhatja-e ezt az aberrált viselkedést, az Fmr1 KO2 egerekbe vivőanyagot vagy gaboxadolt (0,5-5 mg/kg, i.p.), a WT alomtestvérekbe pedig vivőanyagot fecskendeztünk 30 perccel az OFT-ben végzett vizsgálat előtt. Az OFT-ben megtett teljes távolságot (cm) 30 percen keresztül rögzítettük. Az eredmények azt mutatták, hogy az Fmr1 KO2 egerek által megtett távolság szignifikánsan megnövekedett a WT alomtestvér kontrollokhoz képest (1. ábra, F(8,81) = 21,27, p < 0,0001), összhangban az FXS más modelljeiből származó eredményekkel. A gaboxadollal (0,5 mg/kg) történő kezelés normalizálta az Fmr1 KO2 egerek által megtett távolságot a WT aktivitási szintre (1. ábra). A gaboxadol nagyobb dózisai (1-5 mg/kg, i.p.) nem voltak hatással az Fmr1 KO2 egerek mozgásszervi aktivitására (1. ábra). Ezek az eredmények nem a gaboxadol szedatív hatásának voltak tulajdoníthatók, mivel WT C57Bl/6 vagy BALB/c egerekben a gaboxadol dózisok akár 2,0 mg/kg, i.p. nem voltak hatással a lokomotoros aktivitásra 60 perces OFT-ben (az adatok nem láthatóak), összhangban a korábbi munkákkal, amelyek szerint a gaboxadolnak nincs hatása a lokomócióra WT egerekben (Olmos-Serrano et al., 2011) vagy patkányoknál (Silverman et al., 2016).
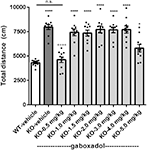
1. ábra. A gaboxadol normalizálja a hiperaktivitást az Fmr1 KO2 egerekben. A 30 perc alatt megtett teljes távolság a vad típusú alomtestvér (WT) egereknél, amelyeket járművel kezeltek (fehér sáv), a járművel kezelt Fmr1 KO2 egereknél (knockout, KO sötétszürke sáv) és a gaboxadollal kezelt Fmr1 KO2 egereknél (KO-0,5-5,0 mg/kg, világosszürke sávok). A sávok átlagok ± SEM, a pontok egyedi egerek nyers adatai. *p < 0,05, ****p < 0,0001 vs. WT-jármű csoport; ns, nem szignifikáns vs. WT-jármű csoport; ++++p < 0,0001 vs. Fmr1 KO2-jármű csoport. N = 10 csoportonként.
Az Fmr1 KO2 egerek szorongásszerű viselkedését a gaboxadol normalizálja
A gaboxadol hatásának felmérésére az Fmr1 KO2 egerek szorongásszerű viselkedésére három különböző viselkedési tesztet alkalmaztunk: az OFT-ben megtett középső távolság, az LDT és a SAT. A középpontban megtett nagyobb távolságot csökkent szorongásként értelmezik, és kihasználják az egerek eredendő preferenciáját, hogy új környezetbe való bevezetéskor a kerületben maradjanak. Az Fmr1 KO2 egereknek gaboxadolt adtunk (0,5-5 mg/kg, i.p.), a WT egereknek pedig 30 perccel azelőtt, hogy 30 percre az OFT-be helyeztük őket, vivőanyagot adtunk. A központban megtett teljes távolság szignifikánsan megnőtt az Fmr1 KO2 egerekben a WT kontrollokhoz képest (2A ábra, F(8,81) = 21,32, p < 0,0001). A gaboxadollal (0,5 mg/kg, i.p.) történő kezelés normalizálta az Fmr1 KO2 hatását a központban megtett távolságra a WT kontrollokhoz hasonló szintre (2A ábra). A gaboxadol nagyobb dózisai (1-5 mg/kg) nem voltak hatással az Fmr1 KO2 egerekre ebben a tesztben (2A ábra).
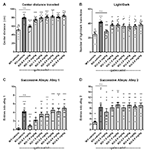
2. ábra. A gaboxadol normalizálja a szorongással kapcsolatos viselkedést Fmr1 KO2 egerekben. A járművel kezelt WT egereket (fehér sáv), a járművel kezelt Fmr1 KO2 egereket (KO, sötétszürke sáv) vagy a gaboxadollal kezelt Fmr1 KO2 egereket (KO-0,5-5,0 mg/kg, világosszürke sávok) a nyílt mező tesztnek (OFT), a fény/sötét explorációs tesztnek (LDT) és a szukcesszív alley tesztnek (SAT) vetették alá. (A) Az OFT közepén megtett teljes távolság. (B) A világos és sötét rekeszek közötti átmenetek száma az LDT-ben. (C) Az 1. sikátorba való belépések száma a SAT során. (D) A 2-es sikátorba való belépések száma a SAT alatt. A sávok átlagok ± SEM, a pontok egyedi egerek nyers adatai. ****p < 0,0001, ***p < 0,001, **p < 0,01, *p < 0,05 vs. WT-jármű csoport; ns, nem szignifikáns vs. WT-jármű csoport; ++++p < 0,0001, +++p < 0,001, ++p < 0,01 vs. Fmr1 KO2 jármű csoport. N = 10 csoportonként.
A következőkben az LDT-t, amely kihasználja az egerek sötét, védett környezet iránti természetes preferenciáját, a szorongás másik viselkedési próbájaként használtuk. A kamra világos rekeszének felfedezésére való hajlandóság, amelyet a rekeszek közötti átmenetek számával mérnek, szorongásoldó viselkedésként értelmezhető, és érzékeny a szorongásoldó szerekkel való kezelésre (Bourin és Hascoët, 2003). Az Fmr1 KO2 egerek az LDT-ben a kamrák közötti átmenetek számának szignifikánsan megnövekedett számát mutatták a WT egerekhez képest (2B ábra, F(8,81) = 5,819, p < 0,0001). A gaboxadol (0,5 mg/kg, i.p.) normalizálta az Fmr1 KO2 egerek viselkedési fenotípusát a WT szintre (2B ábra). A gaboxadol nagyobb dózisai nem voltak hatással az Fmr1 KO2 egerek világos/sötét átmeneteire (2B ábra).
Végezetül a SAT eredményei megerősítették, hogy az Fmr1 KO2 egereknél megfigyelt szorongással kapcsolatos fenotípus normalizálható gaboxadol kezeléssel. Ezt a tesztet az Elevated Plus Maze érzékenyebb változataként használják, és négy lineáris, egymást követő, egyre inkább anxiogén sikátorból áll (Deacon, 2013). A 2-4. sikátorokba való belépések száma a szorongásos viselkedést értékeli (Deacon, 2013), míg az 1. sikátorba való fokozott belépések általános hiperaktivitással vannak összhangban (Deacon, 2013). Fontos, hogy korábbi munkák kimutatták, hogy a mozgásszervi hiperaktivitás nem vezet hamis pozitív eredményekhez ebben a tesztben (áttekintve: Deacon, 2013). Az Fmr1 KO2 egerek megnövekedett számú belépést mutattak az 1. sikátorba (2C ábra, F(8,81) = 11,50, p < 0,0001), ami összhangban van a fokozott mozgásszervi aktivitással és az 1. ábrán látható hiperaktivitás fenotípussal. Az Fmr1 KO2 egerek szignifikánsan megnövekedett számú belépést mutattak a 2. sikátorba a WT kontrollokhoz képest (2D ábra, F(8,81) = 4,925, p < 0,0001), ami alátámasztja a szorongással kapcsolatos fenotípust. Gaboxadol (0,5 mg/kg) beadása az Fmr1 KO2 egerekbe 30 perccel a vizsgálat előtt normalizálta az 1. és 2. sikátorba való belépéseket a WT kontrollok szintjére (2C,D ábra). A gaboxadol nagyobb dózisai nem voltak hatással az Fmr1 KO2 egerekre a SAT-ban (2C,D ábra). A 3. és 4. sikátorokba való belépések szignifikánsan megnövekedtek az Fmr1 KO2 egerekben a WT kontrollokhoz képest, de a gaboxadolnak semmilyen vizsgált dózisban nem volt nyilvánvaló előnye (nem látható).
Az Fmr1 KO2 egerek ingerlékenységét és agresszív viselkedését normalizálja a gaboxadol
Az FXS-szindrómás autizmus más formáihoz hasonlóan az egyének nagy hányada mutat irritabilitást, szociális szorongást és agressziót. Ezek az aberrált viselkedések rágcsálókban modellezhetők a tesztegér és egy új ketrectárs közötti SI-k jellemzésével. Annak a hipotézisnek a tesztelésére, hogy az Fmr1 KO2 mutánsokban megnövekedett az ingerlékenység és az agresszió, számszerűsítettük a farokcsörgés, a harapós viselkedés, a szerelési viselkedés és a támadásra való késleltetés eseteit. Az egereknek 30 perccel a tesztketrecbe helyezés előtt vivőanyagot vagy gaboxadolt (0,5-5 mg/kg, i.p.) adtunk.
A farokcsörgés, vagyis a farok gyors rezgése agresszivitást és harci hajlamot tükröz. Az Fmr1 KO2 egerek szignifikánsan megnövekedett farokcsörgési gyakoriságot mutattak a WT kontrollokhoz képest (3A ábra, F(8,81) = 16,03, p < 0,0001). A gaboxadol (0,5, 1,5 és 5,0 mg/kg) normalizálta a hatást az Fmr1 KO2 egerekben a WT kontrollokhoz hasonló szintre (3A ábra).
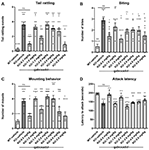
3. ábra. A gaboxadol normalizálja az Fmr1 KO2 egerek ingerlékenységét és agresszív viselkedését. A farokcsörgést (A), a harapási viselkedést (B), a szerelési viselkedést (C) és az új ketrec-társ megtámadásának latenciáját (D) mértük WT egereknél, amelyeket járművel (fehér sáv), Fmr1 KO2 egereknél, amelyeket járművel (KO, sötétszürke sáv), vagy Fmr1 KO2 egereknél, amelyeket gaboxadollal (KO-0,5-5,0 mg/kg, világosszürke sáv) kezeltünk. A sávok átlagok ± SEM, a pontok az egyes egerek nyers adatai. ****p < 0,0001,***p < 0,001,**p < 0,01, *p < 0,05 vs. WT-jármű csoport; ns, nem szignifikáns vs. WT-jármű csoport; ++++p < 0,0001, +++p < 0,001, ++p < 0,01, +p < 0,05 vs. Fmr1 KO2 jármű csoport. N = 10 csoportonként.
A farkcsóváláshoz hasonlóan a harapás is az agresszió mérőszáma az egereknél. Az Fmr1 KO2 egerek szignifikánsan megnövekedett harapások számát mutatták a WT kontrollokhoz képest (3B ábra, F(8,81) = 5,446, p < 0,0001). A gaboxadol (0,5, 1,5 és 5,0 mg/kg) szignifikánsan csökkentette az Fmr1 KO2 egerek harapásainak számát (3B ábra). Néhány vizsgált dózisban (1,0, 3,0 és 4,0 mg/kg) azonban a harapós viselkedés szignifikánsan megnövekedett maradt a WT-egércsoportokhoz képest, és nem változott szignifikánsan a KO-egér kontrollokhoz képest (3B ábra).
A hím egerekben a szerelési viselkedés a szociális dominancia agresszív érvényesítése. Az Fmr1 KO2 egerek a WT kontrollokhoz képest szignifikánsan megnövekedett számú mountot mutattak (3C ábra, F(8,81) = 9,008, p < 0,001). A gaboxadollal való kezelés (0,5, 1,5, 4,0 és 5,0 mg/kg) szignifikánsan csökkentette a szerelési viselkedést az Fmr1 KO2 egerekben, és a 0,5 és 5,0 mg/kg dózisok hatása statisztikailag szignifikáns volt a KO-vérrel kezelt kontrollokhoz képest (3C ábra). Az 1,5 és 4,0 mg/kg gaboxadollal kezelt Fmr1 KO2 egereknél a szerelési viselkedés nem különbözött szignifikánsan a WT-vezetékkel kezelt egerektől, ami arra utal, hogy ezeknél az adagoknál tendenciaszerűen van hatás, bár a KO-vezetékkel kezelt csoporttal való összehasonlításuk nem érte el a statisztikai szignifikanciát (3C ábra).
Végül az agresszió másik mérőszámaként az újonnan találkozó egér megtámadásának latenciáját rögzítettük. Az Fmr1 KO2 egerek szignifikánsan csökkent latenciát mutattak a támadáshoz a WT alomtestvérekhez képest (3D ábra, F(8,81) = 17,22, p < 0,0001). A csökkent támadási latencia normalizálódott a gaboxadollal (0,5, 1,5 mg/kg; 3D ábra) kezelt Fmr1 KO2 egerekben.
Gaboxadol normalizálja az ismétlődő viselkedést Fmr1 KO2 egerekben
A perzeveráció és az ismétlődő viselkedés gyakori az FXS-ben szenvedő egyéneknél, és rendkívül zavaró (Arron et al., 2011; Leekam et al., 2011; Hall et al., 2016). Annak a hipotézisnek a tesztelésére, hogy az Fmr1 KO2 állatokban megfigyelhetők-e ilyen jellemzők, számszerűsítettük a körözést, az önápolás és a sztereotípiákat WT és Fmr1 KO2 mutáns egerekben. Az óramutató járásával ellentétes irányú (CCW) fordulatokat mértük a tesztkamrában, miután az egereknek vivőanyagot vagy gaboxadolt (0,5-5 mg/kg, i.p.) adtunk be. Az Fmr1 KO2 egerek szignifikánsan megnövekedett CCW fordulatszámot mutattak az 5 perces teszt során a WT kontrollokhoz képest (4A ábra, F(8,81) = 25,46, p < 0,0001). A gaboxadol (0,5, 1,0 mg/kg) beadása az Fmr1 KO2 egerekbe visszaállította a CCW forgások számát a WT szintre (4A ábra). A genotípusnak nem volt hatása az óramutató járásával megegyező irányú körözésre (p = 0,386, az adatok nem láthatóak).

4. ábra. A gaboxadol normalizálja a repetitív viselkedést Fmr1 KO2 egerekben. A járművel kezelt WT egereket (fehér sáv), a járművel kezelt Fmr1 KO2 egereket (KO, sötétszürke sáv) vagy a gaboxadollal kezelt Fmr1 KO2 egereket (KO-0,5-5,0 mg/kg, világosszürke sávok) négy, repetitív viselkedést mérő tesztnek vetették alá. (A) Az óramutató járásával ellentétes irányú (CCW) fordulatokat infravörös sugár megszakításokkal mértük a nyílt mezőn végzett 5 perces teszt során. (B) A tesztketrechez való 5 perces szoktatás után a 3 percig tartó ápolásra fordított idő látható. (C) A sztereotípiák (fejbillegési események) száma egy 3 perces tesztidőszak alatt látható. A sávok átlagok ± SEM, a pontok egyedi egerek nyers adatai. ****p < 0,0001 vs. WT-jármű csoport; ns, nem szignifikáns vs. WT-jármű csoport; ++++p < 0,0001 vs. Fmr1 KO2 jármű csoport. N = 10 csoportonként.
Az ápolással töltött idő szignifikánsan megnőtt az Fmr1 KO2 egerekben a WT kontrollhoz képest (4B ábra, F(8,81) = 41,99, p < 0,0001). Az Fmr1 KO2 egereknél a gaboxadol injekció (0,5 mg/kg) normalizálta az ápolással töltött időt a WT szintre (4B ábra).
A sztereotípiát ismétlődő és rituális mozgásokként definiálják, és gyakori az autizmusban és az FXS-ben. Egerekben a sztereotip tevékenységek, mint például a fejbiccentés, mérhetők a tesztketrecben lévő infravörös sugárzás megszakításainak számszerűsítésével. A sztereotípiák száma szignifikánsan megnövekedett az Fmr1 KO2 egerekben a WT kontrollokhoz képest (4C ábra, F(8,81) = 19,93, p < 0,0001). A gaboxadollal (0,5 mg/kg) injektált Fmr1 KO2 egereknél a sztereotip viselkedés normalizálódott vissza a WT szintre (4C ábra).
Diszkusszió
Az FXS klinikai tünetei közé tartozhat a hiperaktivitás, a szorongás, a memória- és tanulási hiányosságok, a szociális rendellenességek, az agresszió és a repetitív viselkedés. A 0,5 mg/kg gaboxadollal történő kezelés minden esetben visszaállította az Fmr1 KO2 egerek viselkedését a WT szintre (összefoglalva az 5. ábrán). Ezek az adatok további támogatást nyújtanak a dSEGA-aktivitás és a tónusos gátlás gaboxadollal történő fokozására, mint olyan terápiás stratégiára, amely további vizsgálatot igényel FXS-ben szenvedő egyéneknél.

5. ábra. A gaboxadol általános viselkedési hatásai Fmr1 KO2 egerekben. A vivőanyaggal vagy gaboxadollal (0,5-5,0 mg/kg) kezelt Fmr1 KO2 egerek viselkedéses értékelésének eredményeinek összefoglalása a WT alomtestvér kontrollokhoz képest. Az Fmr1 KO2 egerek jelentős fenotípust mutattak a mozgásszervi aktivitás, a szorongással kapcsolatos viselkedés, az ingerlékenység és agresszió, valamint a repetitív viselkedés terén. Mindezek a fenotípusok következetesen normalizálódtak a WT szintre a gaboxadol 0,5 mg/kg dózisú kezelés hatására. A “normális” viselkedés (zöld négyzetek) megegyezik a WT járművel kezelt egerekkel, és statisztikailag különbözik az Fmr1 KO2 (KO) járművel kezelt egerektől. Az “abnormális” viselkedés (piros négyzetek) összhangban van az Fmr1 KO2 (KO) járművel kezelt egerekkel, és statisztikailag különbözik a WT járművel kezelt egerektől. A sárga négyzetek olyan eltérést jeleznek, amely vagy nem különbözik szignifikánsan a WT egerektől, vagy statisztikailag különbözik az Fmr1 KO2 (KO) járművel kezelt egerektől.
A lokomotoros hiperaktivitás az emberi FXS egyik jellemzője (Bailey et al., 2008; Wheeler et al., 2014; Hagerman et al., 2017). A jelenlegi vizsgálatban az Fmr1 KO2 egerek fokozott mozgásszervi aktivitást mutattak, amelyet gaboxadol normalizált. A holland-belga Fmr1 KO egereken végzett korábbi munkák szintén következetes hiperaktivitási fenotípust mutattak, amelyet gaboxadol-kezeléssel visszafordítottak, azonban magasabb dózisban (Olmos-Serrano és mtsai., 2011). A különbség lehetséges magyarázatai közé tartoznak: a Gabrd mRNS eltérő szabályozása (D’Hulst et al., 2006; Curia et al., 2009), az extrasinaptikus GABA-receptorok megváltozott felületi kifejeződése (Zhang et al., 2017), az agy szerkezetére gyakorolt hatások (Lai et al., 2016), vagy a mutáció viselkedési megnyilvánulásaiban mutatkozó különbségek (Pietropaolo et al., 2011; Spencer et al., 2011). Mindegyiket közvetítheti a genetikai háttér eredménye, mivel a korábbi munkákat FVB egerekkel végezték, míg az itt vizsgált állatok C57BL/6J egerek voltak. A laboratóriumi berendezések, az állatok kezelése és még a tartási körülmények finom különbségei is hozzájárulhatnak, amelyek az egér viselkedésének jól ismert módosítói (Crabbe et al., 1999; Wahlsten et al., 2006).
A három szorongásos teszt, a középtávolság az OFT-ben, a fény/sötét doboz és a SAT eredményei az Fmr1 KO2 egérben robusztus fenotípust mutatnak, amelyet a gaboxadollal való kezelés visszafordít. Meg kell jegyezni, hogy a hiperaktivitás megzavarhatja az OFT és a fény/sötét doboz eredményeit. A SAT-ban megfigyelt szorongással kapcsolatos viselkedés azonban a mozgásszervi aktivitás változásától függetlenül jelentkezik (áttekintve: Deacon, 2013); és bár a KO-ban a szorongás hatása ellentétes irányú, mint amit FXS-es betegeknél megfigyeltek (Bailey et al., 2008), eredményeink összhangban vannak az FXS egér fenotípusát leíró korábbi jelentésekkel (áttekintve: Kazdoba et al., 2014). Mindazonáltal fontos lesz, hogy a jövőbeli vizsgálatok célja a szorongásos hatás további tisztázása legyen ezekben az egerekben. Ennek ellenére, és ami a legfontosabb, adataink azt mutatják, hogy a gaboxadol normalizálja az FXS egérmodellben megfigyelt aberrált szorongásos viselkedést, valamint az összes többi, az elemzéseinkben vizsgált viselkedést.
Az Fmr1 KO2 egerekben az ingerlékenység és az agresszív viselkedés, amelyet az új ketrectárssal való SI mérésével modelleztünk, szintén megnőtt, és a gaboxadol visszafordította. Egy nemrégiben végzett vizsgálat arról számolt be, hogy szinte minden (>90%) megkérdezett FXS-es hím és nőstény tanúsított valamilyen agressziót az előző 12 hónapban. Közülük a férfiak 33%-a és a nők 20%-a mutatott súlyos agressziót, ami elég volt ahhoz, hogy sérülést okozzon a gondozóknak (Wheeler és mtsai., 2016). Az önsértés és az impulzív viselkedés is gyakoribb az FXS-ben szenvedő egyéneknél (Arron és mtsai., 2011).
A repetitív viselkedés és a sztereotípia következetesen fokozódott az Fmr1 KO2 egerekben, és gaboxadol-kezeléssel enyhült. Az ismétlődő viselkedések komoly problémákat okozhatnak a mindennapi működésben, és a tanulás és az SI akadályává válhatnak (Leekam és mtsai., 2011). A sztereotip viselkedést és a szocioemocionális hiányosságokat felmérő paradigmák így hasznosak lehetnek az új gyógyszerek hatékonyságának értékeléséhez az FXS autisztikus fenotípusainak javítására.
A gaboxadol 0,5 mg/kg dózisban normalizálta az Fmr1 KO2 egerek összes vizsgált viselkedési hiányosságát. Míg a magasabb dózisok normalizálták az ingerlékenységet és az agresszív viselkedést is, ez nem volt megfigyelhető más vizsgált viselkedési területeken. Az itt megfigyelt némileg szűk hatásossági ablak egyik magyarázata abból a korábbi munkából származhat, amely az információfeldolgozás károsodását mutatta ki az elégtelen vagy túlzott tónusos gátlás miatt, amely fiziológiai folyamatot a gaboxadol potenciálja. Ebben a modellben a nagy dózisú gyógyszer viselkedési előnyét ellensúlyoznák a farmakológiailag bevezetett FXS-független hiányosságok (Duguid et al., 2012).
Eredményeink szilárd bizonyítékot szolgáltatnak a gaboxadol lehetséges előnyeire az ASD-vel kapcsolatos viselkedés, az agresszió és a szociabilitás visszafordításában. Összességében ezek az eredmények alátámasztják azt a hipotézist, hogy az extraszinaptikus GABAA-receptorok gaboxadol általi potenciálása előnyös lehet az FXS-ben szenvedő egyéneknél. Összefoglalva, ezek az adatok támogatják a gaboxadol jövőbeli értékelését FXS-ben szenvedő egyéneknél, különösen a hiperaktivitás, a szorongás, az ASD-vel kapcsolatos sztereotípiák, a szociabilitás, az ingerlékenység, az agresszió és a kogníció tünetei tekintetében.
Etikai nyilatkozat
Minden kísérletet a Chilei Egyetem Ökológiai és Biodiverzitási Intézet Etikai Bizottságának jóváhagyásával végeztünk, Santiago, Chile.
A szerzők hozzájárulása
BA és MD kezdeményezte ezt a munkát, és PC-vel és RD-vel együtt dolgozott a kísérleti terv kidolgozásán. PC és RD az eredményeket összefoglaló technikai jelentést írt, amelyet JW-S felhasznált a publikálásra kész kézirat elkészítéséhez. MvS a többi szerzőhöz hasonlóan hozzájárult az eredmények értelmezéséhez. Minden szerző visszajelzést adott a kéziratról a benyújtás előtt.
Finanszírozás
Ezt a tanulmányt az Ovid Therapeutics Inc. (New York, NY, USA) szponzorálta és fizette ki teljes egészében.
Interdekütközési nyilatkozat
PC és RD a Gen. DDI Limited alapítója/vezérigazgatója és gazdasági igazgatója, amelyet az Ovid Therapeutics az itt leírt kísérleti munka elvégzésére szerződött. PC és RD jelenleg a FRAXA-DVI vezetője és csapattagja. JW-S a NeuroJenic Consulting, LLC-n keresztül kapott szerződést e kézirat közzétételre történő megszerkesztésére. MvS, BA és MD az Ovid Therapeutics teljes munkaidős alkalmazottai, és vagy részvényekkel vagy részvényopciókkal is rendelkeznek.
Arron, K., Oliver, C., Moss, J., Berg, K., and Burbidge, C. (2011). Az önkárosító és agresszív viselkedés prevalenciája és fenomenológiája genetikai szindrómákban. J. Intellect. Disabil. Res. 55, 109-120. doi: 10.1111/j.1365-2788.2010.01337.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Auerbach, B. D., and Bear, M. F. (2010). A törékeny X mentális retardációs fehérje elvesztése szétkapcsolja a hosszú távú potenciáció metabotróp glutamátreceptor-függő primerizálását a fehérjeszintézistől. J. Neurophysiol. 104, 1047-1051. doi: 10.1152/jn.00449.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Bailey, D. B. Jr., Raspa, M., Olmsted, M., and Holiday, D. B. (2008). Az FMR1 génváltozatokkal összefüggő társbetegségek: egy országos szülői felmérés eredményei. Am. J. Med. Genet. A 146A, 2060-2069. doi: 10.1002/ajmg.a.32439
PubMed Abstract | CrossRef Full Text | Google Scholar
Bassell, G. J., and Warren, S. T. (2008). Törékeny X-szindróma: a helyi mRNS-szabályozás elvesztése megváltoztatja a szinaptikus fejlődést és funkciót. Neuron 60, 201-214. doi: 10.1016/j.neuron.2008.10.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Bourin, M., and Hascoët, M. (2003). Az egér fény/sötét doboz teszt. Eur. J. Pharmacol. 463, 55-65. doi: 10.1016/s0014-2999(03)01274-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Cheng, G. R., Li, X. Y., Xiang, Y. D., Liu, D., McClintock, S. M., and Zeng, Y. (2017). Az AMPA-receptor szerepe a szinaptikus plaszticitás károsodásában és az értelmi fogyatékosságban a törékeny X-szindrómában. Physiol. Res. 66, 715-727.
PubMed Abstract | Google Scholar
Crabbe, J. C., Wahlsten, D., and Dudek, B. C. (1999). Az egér viselkedésének genetikája: kölcsönhatások a laboratóriumi környezettel. Science 284, 1670-1672. doi: 10.1126/science.284.5420.1670
PubMed Abstract | CrossRef Full Text | Google Scholar
Curia, G., Papouin, T., Séguéla, P., and Avoli, M. (2009). A tónusos GABAerg gátlás downregulációja a törékeny X-szindróma egérmodelljében. Cereb. Cortex 19, 1515-1520. doi: 10.1093/cercor/bhn159
PubMed Abstract | CrossRef Full Text | Google Scholar
Dahlhaus, R. (2018). Emberekről és egerekről: a törékeny X-szindróma modellezése. Front. Mol. Neurosci. 11:41. doi: 10.3389/fnmol.2018.00041
PubMed Abstract | CrossRef Full Text | Google Scholar
Deacon, R. M. (2013). A szorongás egymást követő sikátoros tesztje egerekben és patkányokban. J. Vis. Exp. 76:e2705. doi: 10.3791/2705
PubMed Abstract | CrossRef Full Text | Google Scholar
Deacon, R. M., Glass, L., Snape, M., Hurley, M. J., Altimiras, F. J., Biekofsky, R. R., et al. (2015). Az NNZ-2566, az (1-3) IGF-1 új analógja, mint a törékeny X-szindróma potenciális terápiás hatóanyaga. Neuromolecular Med. 17, 71-82. doi: 10.1007/s12017-015-8341-2
PubMed Abstract | CrossRef Full Text | Google Scholar
D’Hulst, C., De Geest, N., Reeve, S. P., Van Dam, D., De De Deyn, P. P., Hassan, B. A., et al. (2006). A GABAA-receptor csökkent expressziója a törékeny X-szindrómában. Brain Res. 1121, 238-245. doi: 10.1016/j.brainres.2006.08.115
PubMed Abstract | CrossRef Full Text | Google Scholar
D’Hulst, C., Heulens, I., Van der Aa, N., Goffin, K., Koole, M., Porke, K., et al. (2015). A GABAA-receptorok pozitronemissziós tomográfiás (PET) kvantitatív meghatározása törékeny X betegek agyában. PLoS One 10:e0131486. doi: 10.1371/journal.pone.0131486
PubMed Abstract | CrossRef Full Text | Google Scholar
D’Hulst, C., and Kooy, R. F. (2007). A GABAA-receptor: a törékeny X kezelésének új célpontja? Trends Neurosci. 30, 425-431. doi: 10.1016/j.tins.2007.06.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Dölen, G., Osterweil, E., Rao, B. S., Smith, G. B., Auerbach, B. D., Chattarji, S., et al. (2007). A törékeny X szindróma korrekciója egerekben. Neuron 56, 955-962. doi: 10.1016/j.neuron.2007.12.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Duguid, I., Branco, T., London, M., Chadderton, P., and Hausser, M. (2012). A tónusos gátlás fokozza az érzékszervi információátvitel hűségét a kisagykéregben. J. Neurosci. 32, 11132-11143. doi: 10.1523/jneurosci.0460-12.2012
PubMed Abstract | CrossRef Full Text | Google Scholar
Gantois, I., Vandesompele, J., Speleman, F., Reyniers, E., D’Hooge, R., Severijnen, L. A., et al. (2006). Az expressziós profilalkotás a GABAA receptor delta alegységének alulreprezentáltságára utal a fragilis X knockout egérmodellben. Neurobiol. Dis. 21, 346-357. doi: 10.1016/j.nbd.2005.07.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Gaudissard, J., Ginger, M., Premoli, M., Memo, M., Frick, A., and Pietropaolo, S. (2017). Viselkedési rendellenességek a törékeny X-szindróma Fmr1-KO2 egérmodelljében: a korai életszakaszok jelentősége. Autism Res. 10, 1584-1596. doi: 10.1002/aur.1814
PubMed Abstract | CrossRef Full Text | Google Scholar
Gross, C., Hoffmann, A., Bassell, G. J., and Berry-Kravis, E. M. (2015). Terápiás stratégiák a törékeny X-szindrómában: a padról az ágy mellé és vissza. Neurotherapeutics 12, 584-608. doi: 10.1007/s13311-015-0355-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Hagerman, R. J., Berry-Kravis, E., Hazlett, H. C., Bailey, D. B. Jr., Moine, H., Kooy, R. F., et al. (2017). Törékeny X-szindróma. Nat. Rev. Dis. Primers 3:17065. doi: 10.1038/nrdp.2017.65
PubMed Abstract | CrossRef Full Text | Google Scholar
Hagerman, R., Hoem, G., and Hagerman, P. (2010). Törékeny X és autizmus: összefonódás molekuláris szinten, ami célzott kezelésekhez vezet. Mol. Autism 1:12. doi: 10.1186/2040-2392-1-12
PubMed Abstract | CrossRef Full Text | Google Scholar
Hall, S. S., Barnett, R. P., and Hustyi, K. M. (2016). Problémás viselkedés serdülő fiúknál törékeny X-szindrómával: relatív gyakoriság, gyakoriság és súlyosság. J. Intellect. Disabil. Res. 60, 1189-1199. doi: 10.1111/jir.12341
PubMed Abstract | CrossRef Full Text | Google Scholar
Hall, S. S., Jiang, H., Reiss, A. L., and Greicius, M. D. (2013). Nagyméretű agyi hálózatok azonosítása törékeny X-szindrómában. JAMA Psychiatry 70, 1215-1223. doi: 10.1001/jamapsychiatry.2013.247
PubMed Abstract | CrossRef Full Text | Google Scholar
Kazdoba, T. M., Leach, P. T., Silverman, J. L., and Crawley, J. N. (2014). A törékeny X szindróma modellezése az Fmr1 knockout egérben. Intractable Rare Dis. Res. 3, 118-133. doi: 10.5582/irdr.2014.01024
PubMed Abstract | CrossRef Full Text | Google Scholar
Lai, J. K., Lerch, J. P., Doering, L. C., Foster, J. A., and Ellegood, J. (2016). Regionális agyi térfogatváltozások felnőtt hím FMR1-KO egérben az FVB törzsben. Neuroscience 318, 12-21. doi: 10.1016/j.neuroscience.2016.01.021
PubMed Abstract | CrossRef Full Text | Google Scholar
Leboucher, A., Pisani, D. F., Martinez-Gili, L., Chilloux, J., Bermudez-Martin, P., Van Dijck, A., et al. (2019). A transzlációs szabályozó FMRP szabályozza a lipid- és glükózanyagcserét egerekben és emberekben. Mol. Metab. 21, 22-35. doi: 10.1016/j.molmet.2019.01.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Leekam, S. R., Prior, M. R., and Uljarevic, M. (2011). Korlátozott és ismétlődő viselkedések autizmus spektrumzavarokban: az elmúlt évtized kutatásainak áttekintése. Psychol. Bull. 137, 562-593. doi: 10.1037/a0023341
PubMed Abstract | CrossRef Full Text | Google Scholar
Lightbody, A. A., and Reiss, A. L. (2009). Gén, agy és viselkedés összefüggései a törékeny X-szindrómában: bizonyítékok neuroimaging vizsgálatokból. Dev. Disabil. Res. Rev. 15, 343-352. doi: 10.1002/ddrr.77
PubMed Abstract | CrossRef Full Text | Google Scholar
Meera, P., Wallner, M., and Otis, T. S. (2011). Az extrasinaptikus GABAA receptorok magas THIP / gaboxadol érzékenységének molekuláris alapja. J. Neurophysiol. 106, 2057-2064. doi: 10.1152/jn.00450.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Mientjes, E. J., Nieuwenhuizen, I., Kirkpatrick, L., Zu, T., Hoogeveen-Westerveld, M., Severijnen, L., et al. (2006). Egy feltételes Fmr1 knock out egérmodell létrehozása az Fmrp funkció in vivo tanulmányozására. Neurobiol. Dis. 21, 549-555. doi: 10.1016/j.nbd.2005.08.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Olmos-Serrano, J. L., Corbin, J. G., and Burns, M. P. (2011). A GABAA-receptor agonista THIP javítja a specifikus viselkedési hiányosságokat a törékeny X-szindróma egérmodelljében. Dev. Neurosci. 33, 395-403. doi: 10.1159/000332884
PubMed Abstract | CrossRef Full Text | Google Scholar
Olmos-Serrano, J. L., Paluszkiewicz, S. M., Martin, B. S., Kaufmann, W. E., Corbin, J. G., and Huntsman, M. M. (2010). Hibás GABAerg neurotranszmisszió és a neuronális hiperexcitabilitás farmakológiai mentése az amygdalában a fragilis X-szindróma egérmodelljében. J. Neurosci. 30, 9929-9938. doi: 10.1523/JNEUROSCI.1714-10.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Osterweil, E. K., Krueger, D. D., Reinhold, K., and Bear, M. F. (2010). Az mGluR5 és az ERK1/2 túlérzékenysége túlzott fehérjeszintézishez vezet a törékeny X-szindróma egérmodelljének hippokampuszában. J. Neurosci. 30, 15616-15627. doi: 10.1523/JNEUROSCI.3888-10.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Pietropaolo, S., Guilleminot, A., Martin, B., D’Amato, F. R., and Crusio, W. E. (2011). A központi és változó autizmus-szerű tünetek genetikai-háttérbeli modulációja Fmr1 knock-out egerekben. PLoS One 6:e17073. doi: 10.1371/journal.pone.0017073
PubMed Abstract | CrossRef Full Text | Google Scholar
Prut, L., and Belzung, C. (2003). A nyílt terep mint paradigma a gyógyszerek szorongásszerű viselkedésre gyakorolt hatásának mérésére: áttekintés. Eur. J. Pharmacol. 463, 3-33. doi: 10.1016/s0014-2999(03)01272-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Rotschafer, S. E., Marshak, S., and Cramer, K. S. (2015). Az Fmr1 deléciója megváltoztatja a funkciót és a szinaptikus bemeneteket a halló agytörzsben. PLoS One 10:e0117266. doi: 10.1371/journal.pone.0117266
PubMed Abstract | CrossRef Full Text | Google Scholar
Scharf, S. H., Jaeschke, G., Wettstein, J. G., and Lindemann, L. (2015). Az 5. metabotróp glutamátreceptor mint gyógyszercélpont a törékeny X-szindróma esetében. Curr. Opin. Pharmacol. 20, 124-134. doi: 10.1016/j.coph.2014.11.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Silverman, N. S., Popp, S., Vialou, V., Astafurov, K., Nestler, E. J., and Dow-Edwards, D. (2016). A gaboxadol hatása a kokainszenzitizáció kifejeződésére patkányokban. Exp. Clin. Psychopharmacol. 24, 131-141. doi: 10.1037/pha0000069
PubMed Abstract | CrossRef Full Text | Google Scholar
Spencer, C. M., Alekseyenko, O., Hamilton, S. M., Thomas, A. M., Serysheva, E., Yuva-Paylor, L. A., et al. (2011). Viselkedési fenotípusok módosítása Fmr1KO egerekben: a genetikai háttérbeli különbségek autista jellegű válaszokat mutatnak. Autism Res. 4, 40-56. doi: 10.1002/aur.168
PubMed Abstract | CrossRef Full Text | Google Scholar
The Dutch-Belgian Fragile X Consortium, Bakker, C. E., Verheij, C., Willemsen, R., van der Helm, R., Oerlemans, F., et al. (1994). Fmr1 knockout egerek: modell a törékeny X mentális retardáció tanulmányozására. Cell 78, 23-33. doi: 10.1016/0092-8674(94)90569-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Tranfaglia, M. R., Thibodeaux, C., Mason, D. J., Brown, D., Roberts, I., Smith, R., et al. (2019). A rendelkezésre álló gyógyszerek újrafelhasználása idegrendszeri fejlődési rendellenességek kezelésére: a törékeny X tapasztalatai. Neuropharmacology 147, 74-86. doi: 10.1016/j.neuropharm.2018.05.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Wahlsten, D., Bachmanov, A., Finn, D. A., and Crabbe, J. C. (2006). A beltenyésztett egértörzsek viselkedésbeli és agyméretbeli különbségeinek stabilitása laboratóriumok és évtizedek között. Proc. Natl. Acad. Sci. U S A 103, 16364-16369. doi: 10.1073/pnas.0605342103
PubMed Abstract | CrossRef Full Text | Google Scholar
Wheeler, A., Raspa, M., Bann, C., Bishop, E., Hessl, D., Sacco, P., et al. (2014). Szorongás, figyelemzavarok, hiperaktivitás és az aberrált viselkedés ellenőrző listája a törékeny X-szindrómában. Am. J. Med. Genet. A 164A, 141-155. doi: 10.1002/ajmg.a.36232
PubMed Abstract | CrossRef Full Text | Google Scholar
Wheeler, A. C., Raspa, M., Bishop, E., and Bailey, D. B. Jr. (2016). Agresszió a törékeny X-szindrómában. J. Intellect. Disabil. Res. 60, 113-125. doi: 10.1111/jir.12238
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, N., Peng, Z., Tong, X., Lindemeyer, A. K., Cetina, Y., Huang, C. S., et al. (2017). A GABAA-receptor delta alegységének csökkent felszíni expressziója hozzájárul a csökkent tónusos gátláshoz a dentát szemcsesejtekben a törékeny X-szindróma egérmodelljében. Exp. Neurol. 297, 168-178. doi: 10.1016/j.expneurol.2017.08.008
PubMed Abstract | CrossRef Full Text | Google Scholar
.