Az immunfluoreszcencia (IF) egy gyakori morfológiai megközelítés, amelyet a szubcelluláris komponensek eloszlásának meghatározására használnak. Az IF vizsgálathoz fluoreszcens festékkel konjugált antitestekre van szükség. Az antitest a célpont epitópjához kötődve specifikusan felismeri az antigént, és a fluorofór fluoreszcens mikroszkóp alatt detektálható. Így a szubcelluláris komponensek sötét háttérben is láthatóvá válnak. Az IF alternatív félkvantitatív elemzési módszerként is használható az érdeklődésre számot tartó expresszió nyomon követésére.
Az IF-nek három típusa van: közvetlen IF, közvetett IF és kombinált IF.
A közvetlen IF egyetlen, fluoreszcens festékkel konjugált primer antitestet használ.
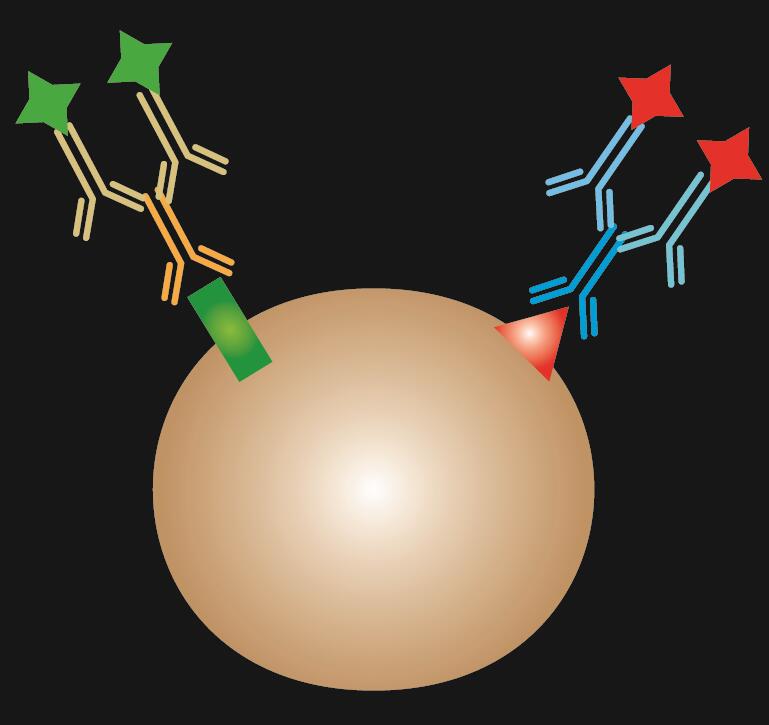
A közvetett IF két antitestet használ a festéshez: az epitóphoz specifikusan kötődő primer antitestet és egy hozzá illő, fluoreszcens festékkel konjugált másodlagos antitestet.
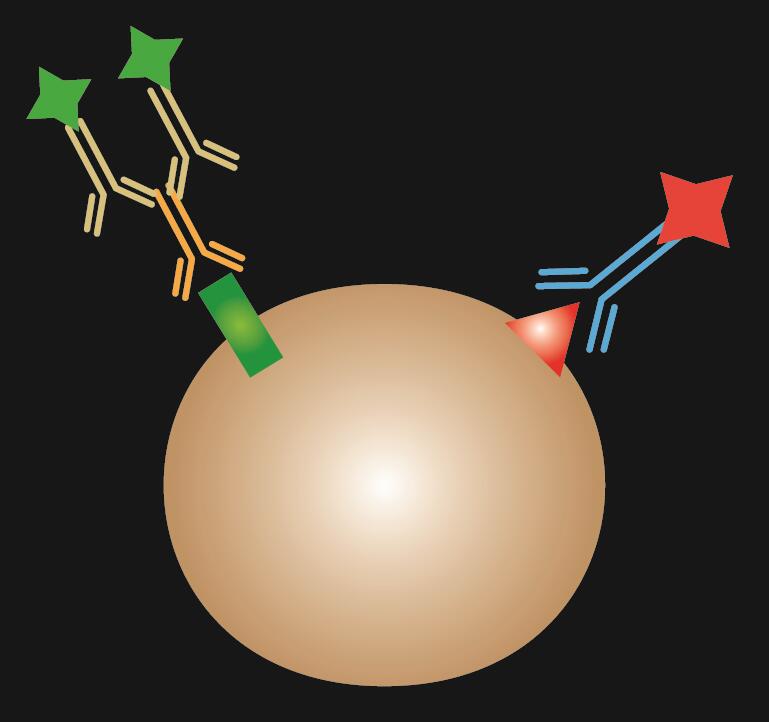
A kombinált IF a direkt és az indirekt IF festés kombinációja.
1. táblázat. A közvetlen, az indirekt és a kombinált IF összehasonlítása.
| IF típusa | Direkt | Indirekt | Kombinált | |
|---|---|---|---|---|
| Sémadiagram | 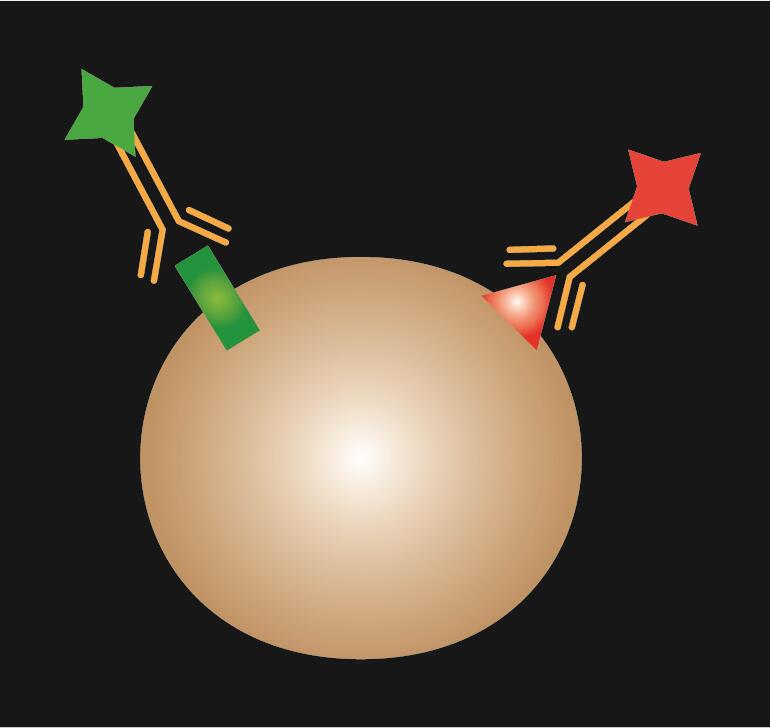 |
 |
 |
|
| Előnyei |
|
|
|
|
| Hátrányok |
|
|
|
Az IF három típusa közül, az indirekt IF módszer a legnépszerűbb.
Az IF megközelítés alkalmazható szöveti metszeteken, tenyésztett sejtvonalakon és egyedi sejteken. Az IF folyamata hasonló az immunhisztokémiához (IHC).
- Mintagyűjtés és fixálás
A mintákat a szövetek eltávolítása után gyorsan kell fixálni, és jobb, ha az előfixálást szívinfúzió útján, 4%-os formaldehiddel vagy paraformaldehiddel végezzük kis állatoknál, például rágcsálóknál. Ajánlott, hogy a szövetek ne legyenek 10 mm-nél vastagabbak, és a fixálószer térfogata legalább 15-20-szor nagyobb legyen, mint a szövet térfogata. A fixálás nagyon fontos a sejtek morfológiájának és szerkezetének, valamint az antigén integritásának megőrzése szempontjából. Ezért a fixáló oldatokat gondosan kell kiválasztani a különböző antigéneknek és szövetmintáknak megfelelően.
2. táblázat. Fixálási stratégia részleges antigénekhez.
| Antigén | Fixáló oldat | Fixálási feltétel |
|---|---|---|
| A legtöbb fehérje | 95~100%. alkohol 4% paraformaldehid |
3~10 perc 37℃-on 4~24 óra 4℃-on |
| Enzim | Aceton | 15 perc RT-n |
| Hormon | 95% alkohol plusz 1~5% jégecetsav | 30 perc 4℃-on |
| Immunglobulin | 95% alkohol Carbon tetraklorid |
10 perc 37℃-on, majd 15 perc 4℃-on |
| Szálas fehérje | 95% alkohol plus 1~5% jégecetsav | 10 perc 37℃-on, majd 15 perc 4℃-on |
| Vírus | Aceton Szén-tetraklorid Alkohol |
5~10 perc RT-nél, majd 30~60 percig 4℃ |
| Poliszacharid és baktériumok | Aceton 10% formaldehid metanol |
3~10 perc RT-n, majd 30~60 perc 4℃-on |
| Lipoid | 10%-os formaldehid | 3~10 perc RT-n |
| Kultúrasejt | Melegített 4%-os paraformaldehid | 15~20 perc RT-n |
- Dehidratálás és beágyazás
A szövetmetszetek készítése során a következő okokból van szükség a dehidratálásra:
1. Paraffinos metszet: A paraffin nem keverhető a vízzel.
2. Fagyasztott metszet: A fagyasztott-felolvasztott jégkristályok tönkretennék a sejtek morfológiáját.
A dehidratálás mindig úgy történik, hogy a szövetet komoly, növekvő gradiens etanololdatba vagy szacharózoldatba merítjük.
A szövetmintákat ezt követően paraffinmetszetekhez olvasztott paraffinviasz, fagyasztott metszetekhez pedig OCT vegyület hozzáadásával lehet beágyazni. Ez a lépés megfelelő keménységet biztosít a lágy szövetmintáknak, és lehetővé teszi a szövetek könnyű vágását.
- Szeletelés és festés
A beágyazott szöveteket mikrotóm vagy fagyasztóm segítségével vékony szeletekre lehet szeletelni. A szeletek vastagságát a sejtátmérő és az IF-vizsgálat célja szerint kell eldönteni. A vékonyabb szeleteket (≤10 μm) a festés előtt javasolt közvetlenül ragasztós tárgylemezre rögzíteni, mivel a többszöri mosási lépések során könnyen megmaradnak. A vastagabb szeletek (10~30 μm) jobb képeket eredményeznek a szabadon lebegő módszerrel, mivel az elsődleges antitest a szelet mindkét oldalán át tud hatolni. A szabadon lebegő metszeteket pedig festés után rögzítjük a tárgylemezekre. A kis szövetek, például az egér dorsalis gangliongyökér (DRG) szabadon lebegő metszetei nehezen kivitelezhetőek, és könnyen elveszik a minta. Ezért néhány kisméretű szövetmintánál a pálcikás metszetmódszer ajánlott. A festési lépéseket sötétben kell elvégezni, ha fluoreszcens festékkel konjugált antitestről van szó.
Elérhető IF protokollok:
- Pálcikás metszet
- Szabadon lebegő metszet
- Kultúrált sejtek
- Képalkotás és elemzés
A pozitív jelzést fluoreszcens mikroszkóp alatt, sötét háttérben virtualizáljuk. Az érdeklődés helyét általában egy olyan fehérje együttes festésével határozzák meg, amelynek a helye ismert. Alternatívaként a pozitív sejtek mennyisége vagy a pozitív jelátvitel fluoreszcencia-intenzitása is mérhető a kvantitatív elemzéshez. Például az erősebb fluoreszcencia-intenzitás a célfehérje relatív magas expressziójára utal.
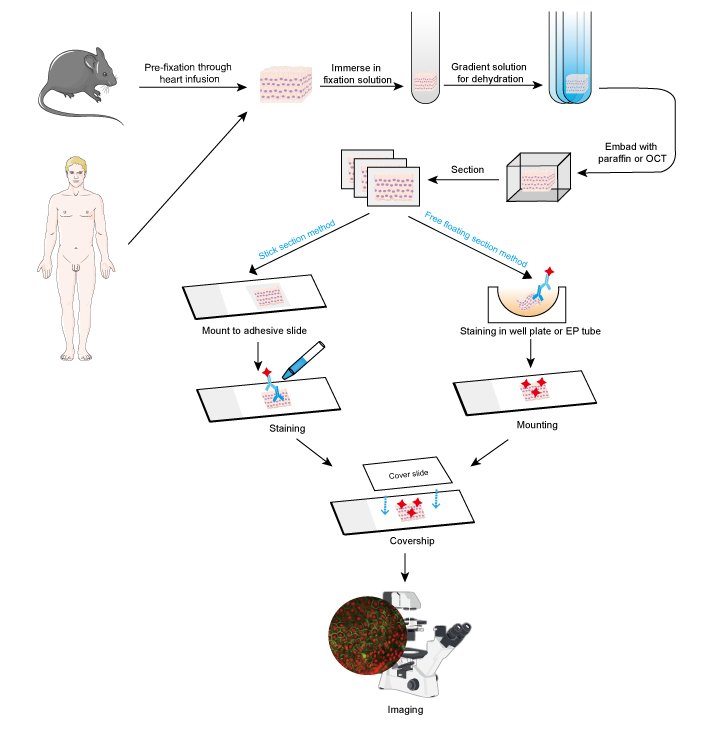
1. ábra. Az IF munkafolyamata szöveti metszeteken.
Az IF és az IHC egyaránt hatékony megközelítés a morfológiai elemzéshez, fontos diagnosztikai és prognosztikai alkalmazásokkal. Számos különbséggel kell foglalkozni a kutatás során:
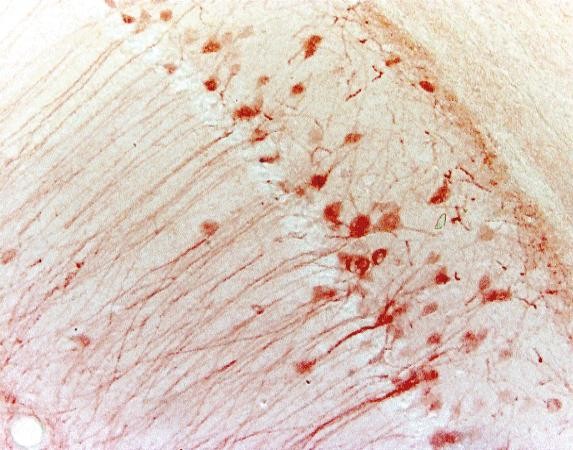
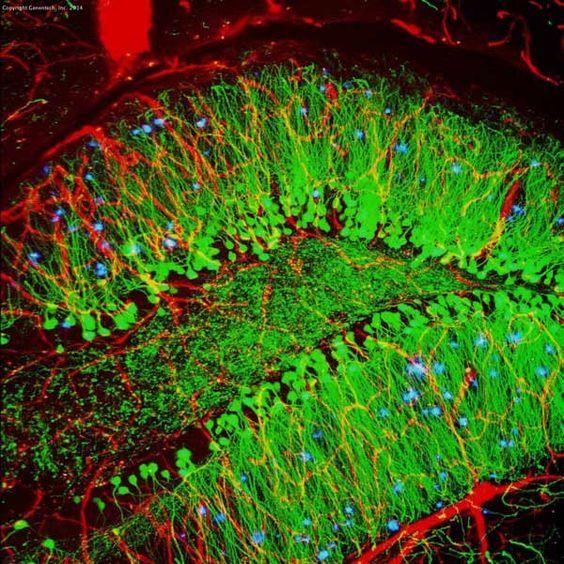
3. táblázat. Az IHC és az IF összehasonlítása
| IHC | IF | ||
|---|---|---|---|
| Megjelölési módszer | Kromogén | Fluoreszcens | |
| Feldolgozási lépés | több, mint szükséges szubsztrát | kevesebb | |
| Kép |
|
|
|
| Mikroszkóp | Fénymikroszkóp | Fluoreszcens mikroszkóp | |
| Szabályozhatóság | Szabályozhatóság | Szabályozható a következő ideig évekig | Kevésbé stabil a fotobleaching miatt |
| Példa (egér hippokampusz) |
 |
 |