A perforin/gránzim apoptózis útvonal a citotoxikus limfociták által a vírusfertőzött és/vagy transzformált sejtek eliminálására használt elsődleges jelátviteli útvonal. Génhibás egereken végzett vizsgálatok azt mutatják, hogy a perforin a granzimmal kombinálva képes apoptózist indukálni. A perforin létfontosságú a citotoxikus effektorok működéséhez, és nélkülözhetetlen, de meghatározatlan szerepe van a granzim által közvetített apoptózisban.
Perforin és a granzim
A perforin egy pórusképző fehérje, és citoplazmatikus granuláris toxinokként is ismert. A granzim a citotoxikus limfociták (CL) citotoxikus granulumaiban tárolt, szerkezetileg rokon szerin proteázok családja. A perforin és a granzim kooperatív módon indukálja a célsejtek apoptózisát (1. ábra). A granzim szükséges a célsejtek apoptózisának kiváltásához, de függ attól, hogy a perforin megfelelően szállítja-e őket. Mind a perforin, mind a granzim egyetlen makromolekuláris komplex részeként kötődik a célsejt felszínéhez, amelyhez szerglicin társul, ami tovább csökkenti a granzim passzív diffúziójának valószínűségét.
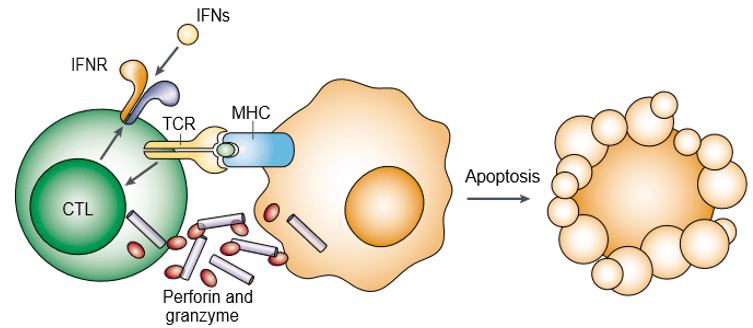
1. ábra. A perforin és a granzim kooperatív módon indukálja a célsejt apoptózist.
Az emberben a granzim A, B, H, K és M, míg az egerekben a granzim A, B, C, D, E, F, G, K, L, M és N. A granzim A (GrA) és a granzim B (GrB) a legnagyobb mennyiségben előforduló és a legtöbbet vizsgált granzimek. Az A és B granzimek funkcióit a célsejtek apoptózisának kiváltásában in vitro alaposan vizsgálták, és molekuláris szinten jobban megértették őket, mint a perforin szerepét.
A perforin/granzim apoptózis útvonalának folyamata és szabályozása
A citotoxikus limfociták által szekretálva a granzimek bejutnak a célsejtekbe, ami a sejthalál egyik létfontosságú lépése. A granulumokba csomagolt fő lítikus fehérjék a különböző granzimek és a pórusképző fehérje, a perforin, amely megkönnyíti a granzimek sejtek általi internalizációját.
A granzim B elsősorban közvetett módon, nem pedig közvetlen kaszpázfeldolgozással váltja ki a kaszpáz aktivációt. Ezt úgy éri el, hogy közvetlenül aktiválja a BCL-2 család pro-apoptotikus “BH3-only” tagjait, mint például a BH3-interakciós domén halál agonistát (Bid). A Bid a pro-apoptotikus BCL-2 családba tartozó Bax és/vagy Bak fehérjékkel együtt a pro-apoptotikus mitokondriális mediátorok, például a citokróm c, citoszolba történő szivárgását eredményezi. A citokróm c felszabadulása aktiválja a pro-kaszpáz-9-et, és az apoptotikus proteáz aktiváló faktor 1 (Apaf-1) kötődésével a pro-kaszpáz-9 érett kaszpáz-9-é válik, amely folytatja az apoptoszóma kialakítását és aktiválja a downstream kaszpáz-3-at. Az aktivált kaszpáz-3 képes specifikus szubsztrátokat, például az ICAD-ot (a kaszpáz-aktivált DNáz inhibitora, CAD) hasítani, lehetővé téve a CAD számára, hogy a DNS fragmentálása céljából transzlokálódjon a sejtmagba. A Bid mellett a granzim B képes inaktiválni az Mcl-1-et, amely az anti-apoptotikus Bcl-2 család tagja, hogy felszabadítsa a pro-anti-apoptotikus Bcl-2 család Bim fehérjét a külső mitokondriális membránon. És a granzim B közvetítheti az effektor kaszpáz-3 és az iniciátor kaszpáz-8 működését is, hogy szabályozza az apoptózis útját.
A granzim B-vel ellentétben a granzim M nem függ a mitokondriumtól a szabályozáshoz, de a granzim M aktiválhatja a granzim B-t a proteináz inhibitor 9 (PI-9) hasításával, amely a granzim B inhibitor. A granzim M közvetlenül is hasíthatja az ICAD-ot, hogy a granzim B-hez hasonlóan felszabadítsa a CAD-et.
A granzim A a mitokondriumok belső membránpotenciáljának csökkenését és reaktív oxigénfajok (ROS) felszabadulását idézi elő. Egyszálú DNS-szegeket hoz létre, nem pedig oligonukleoszómális DNS-fragmentumokat. A ROS hatására az ER-asszociált SET-komplex, beleértve a SET-et, az Ape1-et, a pp32-t, a HMG2-t, az NM23-H1-et és a TREX1-et, transzlokálódik a sejtmagba, ahol a granzim A a SET-komplex három tagját hasítja, amelyek részt vesznek a DNS-javításban: HMG2, Ape1 és SET.
Perforin/Granzim Apoptosis Pathway in Disease
A génhibás egereken végzett vizsgálatok egyértelműen jelzik, hogy a perforin útvonal szorosan részt vesz a vírusos kórokozók és a transzformált sejtek elleni védekezésben. De a perforinnak mint a spontán transzformált sejtek immunfelügyeletének döntő közvetítőjének, valamint a B-sejt homeosztázis és a T-sejt memória szabályozásában játszott, eddig nem sejtett szerepét is kimutatták in vivo. Paradox módon a perforin fontos szerepet játszik bizonyos autoimmun betegségmodellek patogenezisében, mint például az inzulinfüggő cukorbetegség a nem obez cukorbeteg (NOD) egerekben, de elnyomhat más autoimmun betegségeket, beleértve a kísérletes autoimmun encephalomyelitist (EAE).
A perforin/granzin apoptózis útvonalakat, amelyek szabályozzák a szemcsék polarizációját és exocitózisát, meghatározzák, és ezeket az útvonalakat megzavarhatja a rákos sejteknek egyes citotoxikus limfocitákkal való kölcsönhatása. A közelmúltbeli felfedezések, miszerint a granzim célsejtekbe való bejutása specifikus membránreceptorokhoz való kötődéssel jár, és hogy egyes tumorok olyan szerin proteáz inhibitorokat szintetizálnak, amelyek képesek semlegesíteni a granzimeket, olyan lehetséges új utakat jeleztek, amelyeken a tumorok elkerülhetik az immunrendszer támadását.