Beteg gyomor szubepithelialis elváltozással
Martín Gómez Zuleta, MD (1)
(1) Gasztroenterológiai egység, Belgyógyászati Tanszék, Kolumbiai Nemzeti Egyetem. Tunal kórház. Bogotá, Kolumbia..
Elhangzott: Elfogadva: 05-10-10 Elfogadva: 25-11-10
Abstract
Noha a felső gasztrointesztinális traktusban ritkán fordulnak elő szubepithelialis elváltozások, bizonytalanságot okozhatnak a diagnosztikai megközelítésben és a kezelésben. Az endoszonográfiás leletek ismertetése és a jelenlegi ajánlások áttekintése egy eset fényében lehetővé teszi ezen elváltozások racionális megközelítését.
Kulcsszavak
Submucosalis tumorok, endoszkópos ultrahang, GIST.
Klinikai eset
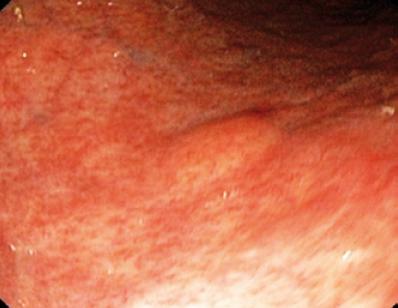
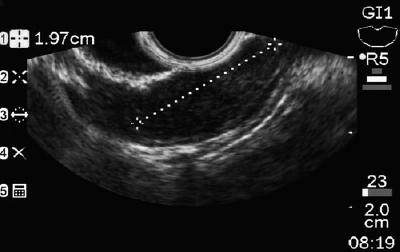
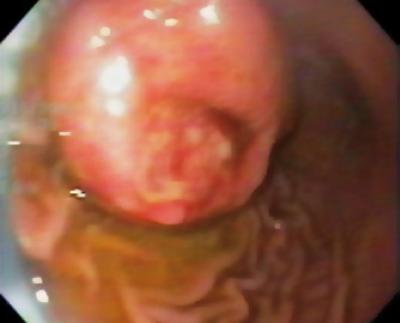
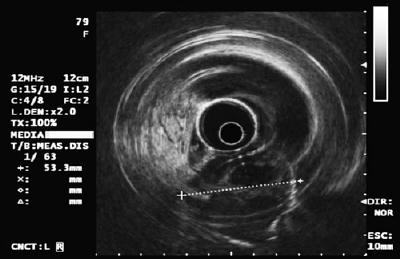
Egy 50 éves, dyspepsiás férfit felső endoszkópiára küldtek, amely a gyomortestben 9 mm-es subepithelialis léziót talált (1. ábra). A fedő nyálkahártya biopsziája normális volt. A betegnek nem volt kórtörténete, és fizikális vizsgálata normális volt.
1. ábra. A gyomor szubepithelialis elváltozása.
Előzetes megközelítés: Mit tehetünk akkor?
A normális hámmal fedett szerv lumenében lévő tömeget vagy kiemelkedést szubepithelialis léziónak nevezzük. Ezek nem gyakori elváltozások, amelyek 300 endoszkópiából várhatóan 1 esetben fordulnak elő (1, 2). Okai lehetnek a gasztrointesztinális traktus falának intrinzikális jó- vagy rosszindulatú elváltozásai vagy a normális vagy kóros szomszédos struktúrák által okozott extrinsic kompresszió (3).
Ezeket az elváltozásokat általában véletlenszerűen találják, és gyakran nincs kapcsolatuk a tünetekkel, ahogyan a mi betegünk esetében is. Ez arra késztetheti az orvost, hogy kétségbe vonja, hogy specifikusabb vizsgálatot végezzen-e, és további vizsgálatokat végezzen-e (4). Véleményünk szerint minden ilyen elváltozást ki kell értékelni eredetük tisztázása érdekében. Mindig biopsziát kell vennünk a fedő nyálkahártyából (kivéve, ha vaszkuláris vagy cisztás eredetre gyanakszunk), mert sok ilyen elváltozás eredete a lamina propria vagy a muscularis mucosa lehet. Ezekben az esetekben csipesszel elérhetők, és pontos diagnózist lehet felállítani. Ha a biopsziák normálisak, itt kell meghatározni, hogy abba kell-e hagyni vagy folytatni kell a vizsgálatot.
Mihelyt az endoszkópiát elvégeztük, és szubepithelialis elváltozást észleltünk, azonnal hozzáfoghatunk a kiértékeléséhez. Kezdetben le kell írnunk a méretét, alakját, színét és mozgékonyságát, valamint azt, hogy pulzál-e vagy sem. Végül zárt biopsziás csipesszel értékelhetjük az állagát, így megállapíthatjuk, hogy cisztás, szilárd vagy puha, nyomható és párnaszerű (lassan gyógyuló elváltozás). A sárga halóval rendelkező párnaszerű elváltozások erősen lipómára utalnak. Ha az elváltozás a nyálkahártya enyhén szabálytalan, és központi mélyedése van, az ektopikus hasnyálmirigyre utal. Általában a ciszták vagy varixok sima, szimmetrikus nyálkahártyával rendelkeznek. A GIST-ek (gastrointestinalis strómatumorok) enyhén fekélyesek lehetnek, de szilárdak és mobilisak (9). Hasznos a beteg helyzetének megváltoztatása is, hogy kizárjuk az extrinsikus elváltozás lehetőségét, amelynek endoszkópos megjelenése megváltozik, ha a beteg változtatja a helyzetét, inhalál, vagy ha a beteg gyomra levegővel van tele (10-12).
Mi a differenciáldiagnózis?
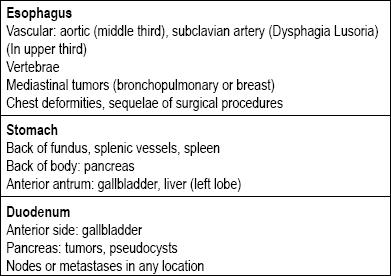
A gyomor-bél traktusban számos típusú elváltozás létezik, amelyek a szubepithelialis kategóriába sorolhatók. Okuk általában attól függ, hogy az elváltozás a nyelőcsőben, a gyomorban, a nyombélben vagy a végbélben található. A következő megfontolandó szempont, hogy valóban a fal elváltozásáról van-e szó, vagy pedig extrinsic kompresszióról, mivel az egész gasztrointesztinális traktus körül vannak olyan struktúrák, amelyek kompresszióhoz vezethetnek (1. táblázat) (5-8) (5-8).
1. táblázat. A felső emésztőrendszeri traktus extraluminális kompresszióinak elsődleges okai.
Minden elváltozást endoszkópos ultrahanggal (EUS) kell értékelni?
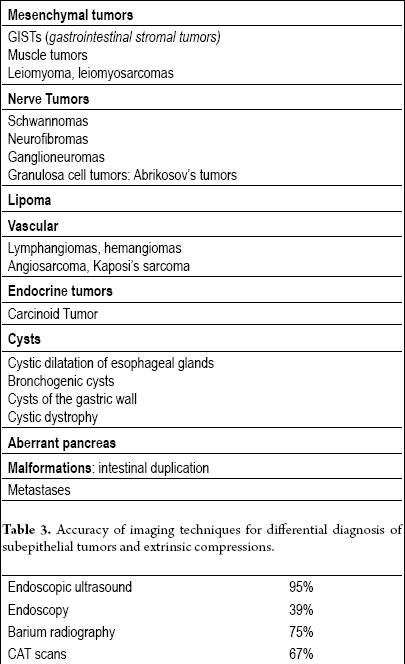
Ténylegesen minden subepithelialis elváltozást (2. táblázat) további képalkotó eljárásokkal kell értékelni, de ha az elváltozás átmérője egy centiméternél kisebb (különösen, ha sárga), nem szükséges az értékelés, mert nagy valószínűséggel lipomáról van szó.
2. táblázat. A gasztrointesztinális traktus szubepithelialis tumorai.
Az endoluminális vagy endoszkópos ultrahang (EUS) a választandó technika (13, 14). Az EUS pontossága az extraluminális kompressziónak a subepithelialis tumortól való megkülönböztetésében 95% feletti. Ez sokkal jobb, mint más képalkotó technikák, például a hagyományos ultrahang vagy a CAT-vizsgálat (15-17) (3. táblázat).
3. táblázat. A képalkotó eljárások pontossága a szubepithelialis tumorok és az extrinsic kompressziók differenciáldiagnózisában.
Mihelyt megállapítottuk, hogy az elváltozás a falon belülről ered, és nem extrinsic kompresszió, meg kell vizsgálnunk, hogy melyik falrétegnek felel meg. Normális esetben a gyomorfal nyálkahártyára, submucosára, muscularis propria-ra és serosára oszlik. A nyálkahártya réteg epitheliumra, bazálmembránra, lamina propria-ra és musculosa mucosa-ra oszlik. Az EUS és a rádiókészülékkel a fal 5 rétegre osztható (18):
Az első hiperechoikus réteg a gyomornyálkahártya legfelületesebb részének felel meg.
A második hiperechoikus réteg a nyálkahártya legmélyebb részének felel meg, amely az izmos nyálkahártyával hozható összefüggésbe.
A harmadik hiperechós réteg a submucosus rétegnek felel meg.
A negyedik hiperechós réteg magának az izomnak felel meg.
Az ötödik hiperechós réteg a serosának vagy adventitiának felel meg.
Normális esetben az első és ötödik rétegben nincsenek elváltozások (19), így ezek három rétegre korlátozódnak. Ezek általában hypoechoikusak, anechoikusak vagy hyperechoikusak.
Diagnózis endoszkópos ultrahanggal
Az egyes megjelenési formákat a rétegek szerint ismertetjük.
A második réteg
A nyálkahártya legmélyebb részének vagy a lamina propria és a muscularis mucosa felel meg. Az ebben a rétegben keletkező elváltozások ritkák és általában hipoechoikusak.
Hypoechoikus elváltozások: Az ebben a rétegben keletkező daganatok többsége izmos, általában leiomyomák. Lehetnek meszesedések, és a nagyméretűek heterogének lehetnek és csomókat mutatnak, ellentétben a kis elváltozásokkal, amelyek homogének. (20).
Ebben a rétegben Abrikosovs-tumorokat vagy granuláris sejteket is találunk. Ezek általában kicsik, és a leiomyomával ellentétben keménységük miatt deformálják az endoszkóp gömbjét (2. és 3. ábra). A karcinoidok is eredhetnek ebből a rétegből, általában a fundusból vagy a végbélből (4. ábra).
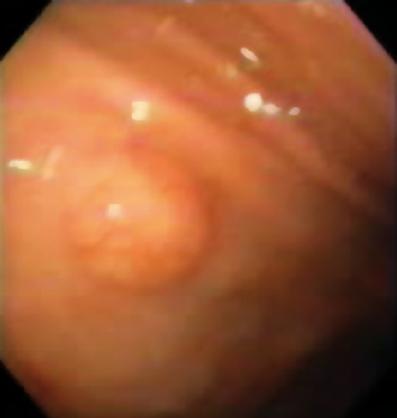
2. ábra. Sárga színű szubepithelialis elváltozás a disztális nyelőcsőben.
3. ábra. Az EUS a harmadik visszhangrétegben a golyót deformáló izoechoikus elváltozást mutat, ami 2 cm-es granuláris sejtes daganatra utal
4. ábra. Neuroendokrin tumorra utaló szubepithelialis elváltozás retikuláris mintázattal a középpontban
Anechós elváltozás: Általában azt láthatjuk, hogy inklúziós vagy retentiós ciszták eredhetnek ebből a rétegből.
Harmadik echoréteg
Ez egy szövetsáv, amely az EUS-ben hiperechósnak tűnik. Számos daganat eredhet ebből a rétegből.
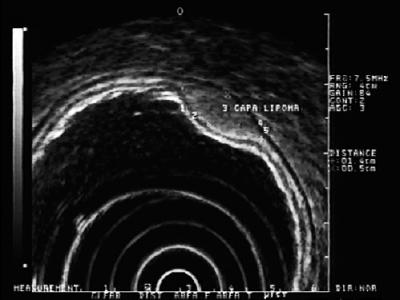
Hyperechoikus elváltozások: Az ebben a rétegben leggyakrabban előforduló elváltozások a lipómák. Ezek homogén hiperechós elváltozásokként jellemezhetők. Általában párnaszerűek, ha endoszkópos fogóval nyomjuk őket (5. ábra) (9).
5. ábra. EUS: hiperechós elváltozás a 3. szubmukózus rétegben, amely összeegyeztethető a lipomával.
A neurofibromák általában hiperechósak. A submucosából vagy muscularis propria-ból erednek.
Az ebben a rétegben található hipoechoikus elváltozások megfelelhetnek ektopikus vagy aberráns hasnyálmirigynek. Ezek az elváltozások általában heterogének, és esetenként középen anechoikus ductus struktúrák láthatók, amelyek megfelelhetnek a csatornáknak. Az endoszkópiában egy depressziós középponttal rendelkező elváltozás látható (21).
A hipoechoikus elváltozások megfelelhetnek a carcinoid tumoroknak is. Bár ezek nem szubepithelialis tumorok, mivel inkább neuroendokrin, mint mesenchymalis, az emésztőfalban helyezkedhetnek el, és ugyanolyan típusú gócokat eredményezhetnek. Általában kicsik (egy cm-nél kisebbek), hipoechoikusak (de inkább echogén, mint izmosak) és a nyálkahártyában telepednek meg. A szövettani vizsgálat általában biopsziából lehetséges (22, 23).
A gyomornyálkahártya-limfómák a submucosa hipoechoikus vagy hiperechoikus elváltozásaként is jelen lehetnek (24).
Az ebben a rétegben megfigyelt nechoikus elváltozások valószínűleg érstruktúrák vagy ciszták (25).
Echo négyes réteg
Az izomrétegnek felel meg. Ezért az ebben a rétegben található daganatok többsége izmos eredetű.
A hiperechoikus elváltozások nagyon ritkák, de limfómákhoz, neurogén daganatokhoz vagy áttétekhez köthetők (26).
Hypoechoikus elváltozások: Az ebbe a rétegbe tartozó daganatok többsége hipoechoikus, főként a gyomorban elhelyezkedő strómatumorok (GIST). Ha azonban a nyelőcsőben helyezkednek el, általában leiomyomának nevezik őket. Más elváltozások, amelyek ilyen megjelenésűek lehetnek, a tüdőből vagy a mellekből kiinduló áttétek és a glomus tumor (27). A limfómák is veszélyeztethetik ezt a réteget, de általában a felsőbb rétegek elköteleződésével járnak együtt.
GIST (gastrointestinalis strómatumor) a neve annak az elváltozásnak, amellyel kapcsolatos ismereteink az utóbbi években nagymértékben javultak (28-30). Úgy tűnik, hogy ezek a daganatok totipotenciális sejtekből indulnak ki, amelyek egyben az úgynevezett Cajal interstitialis sejtek kiindulópontjai is. Csoportokra oszthatók: túlnyomórészt izmos, túlnyomórészt idegi, vagy a kettő kombinációja. A diagnózis felállítása a CD-117 fehérje (más néven c-kit fehérje) immunhisztokémiai azonosításával történik, amely egy tirozin-kináz aktivitással rendelkező membránreceptor (31).
Ezeknek az elváltozásoknak az a jelentősége, hogy 30%-uk malignus viselkedésű lehet és áttéteket adhat. Csak az Egyesült Államokban évente 5000-6000 esetet jelentenek (32). Megoszlásuk a gyomor-bél traktusban a következő: gyomor (40-70%), vékonybél (20-40%), vastagbél és végbél (5-15%) és nyelőcső (<5%) (33). Ez azt jelenti, hogy ha a nyelőcsőben negyedik rétegű hypoechoás elváltozást találunk, akkor az valószínűleg leiomyoma, de ha a gyomorban van, akkor általában GIST (6., 7. y 8. ábra). A legtöbb beteg az ötödik vagy hatodik életévtizedben van. Általában a negyedik rétegben vagy a muscularis propria-ban elhelyezkedő elváltozásuk van, bár a muscularis mucosa-ban is lehet (34). A legtöbb beteg tünetmentes, amíg a daganat elég nagy nem lesz ahhoz, hogy kifekélyesedjen, vérezzen vagy áttétet adjon.
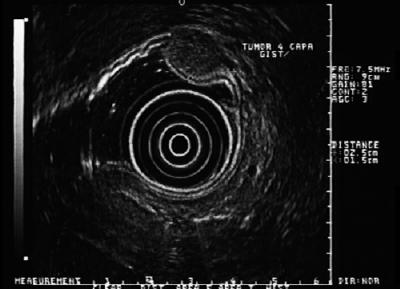
6. ábra. Az EUS a negyedik réteg hipoechoikus elváltozását mutatja, amely összeegyeztethető a GIST-tel.
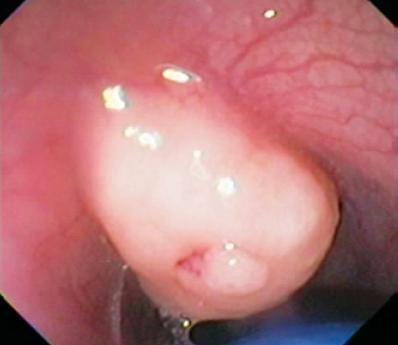
7. ábra. GIST-re utaló fekélyes elváltozás.
8. ábra. A 7. ábra EUS-je a negyedik visszhangréteg hipoechoikus lézióját mutatja, amely erősen GIST-re utal, több mint 5 cm.
Ezért, ha 3 cm-nél nagyobb GIST-et azonosítunk, az még tünetmentesség esetén is műtéti indikációt jelent (más szerzők 4 cm-es határt javasolnak). (35). A 3 cm-nél kisebb elváltozások azonban kihívást jelentenek a kezelés szempontjából, mivel többségük jóindulatú. Mindazonáltal tisztázni kell, hogy minden GIST potenciálisan rosszindulatú, és beszámoltak olyan kis GIST-ekről, amelyek áttétet adtak, különösen az alsó gasztrointesztinális traktusban. Jelenleg nem tudjuk endoszkópos ultrahanggal megjósolni a GIST rosszindulatú potenciálját. Mindazonáltal tudjuk, hogy a 4 cm-nél nagyobb, szabálytalan határokkal és/vagy cisztás terekkel rendelkező, illetve echogén fókuszokkal rendelkező léziók nagy valószínűséggel malignusak (36).
Másrészt az endoszkópos ultrahangvezérelt finom tűszúrás (EUS-FNA) nemcsak a CD-117 azonosításával diagnosztizálhatja a GIST-et, hanem a proliferációt jelző és malignus viselkedésre utaló Ki-67 fehérje jelenlétét is (37). Nagyon fontos hangsúlyozni, hogy a GIST elváltozások nagyon veszélyesek. Folyamatosan nyomon kell követnünk őket, a megállapított kockázatoknak megfelelően értékelve a tumor méretét és a proliferáció mértékét. Még a teljes reszekció után is kiújulhatnak ezek az elváltozások, különösen a kiindulási helyen, de a hashártyában vagy a májban is. Az elváltozások 40-90%-a a teljes reszekció ellenére is kiújul. A kiújulások 50%-a a májat érinti. A GIST-eknél 4-szer nagyobb a kiújulás kockázata, ha az elsődleges hely a bél, mint ha a gyomorban van (38).
Milyen pontosságú az endoszkópos ultrahangvizsgálat?
Már több tanulmány is kimutatta, hogy az EUS nagyon pontos annak meghatározásában, hogy az elváltozás a falon van-e vagy sem, és annak megállapításában, hogy az elváltozás melyik falrétegből származik. Ez lehetővé teszi a legjobb diagnosztikai megközelítés kiválasztását. Az egyik vizsgálat 50 betegből 48 esetben (96%) állapította meg a forrásréteget műtéti megerősítéssel (39). A megfigyelők közötti egyezés nagyon jó, különösen az olyan elváltozások, mint a leiomyomák és az érrendszeri elváltozások azonosításakor. Fontos megjegyezni, hogy az elváltozások szonográfiás megjelenése nem teszi lehetővé az okok 100%-os biztonsággal történő meghatározását. Karaca és munkatársai (40) tanulmánya 22 olyan betegről, akiknél EUS-t követően mucosectomiát végeztek, azt mutatta, hogy az EUS pontossága mindössze 45%-os volt. Az elváltozások azonban többnyire 20 mm-nél kisebbek voltak, és az ultrahang pontossága 66%-ra nőtt a rosszindulatú és jóindulatú daganatok megkülönböztetésében. Mivel a szonográfiás kritériumok pontatlanok lehetnek, ésszerűnek tűnik, hogy lehetőség szerint törekedjünk a specifikus diagnózis felállítására. Ez EUS-FNA-val vagy az elváltozás nyálkahártya reszekciójával érhető el, ahogyan azt ebben a munkában bemutattuk. Mekky és munkatársai 141 olyan beteget vizsgáltak, akiket EUS-FNA-n műtétileg ellenőriztek. Végeredményük 95,6%-os pontosságot találtak (41).
Monitorozás, punkciós biopszia vagy reszekció?
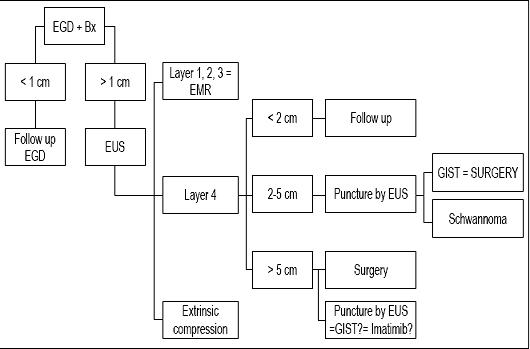
A monitorozásra, alkalmazásra vagy reszekcióra vonatkozó döntés több tényezőtől függ, beleértve az elváltozás méretét, endoszkópos megjelenését, a kiindulási réteget és az echogén jellemzőit. Ha 1 cm-nél kisebb szubepithelialis lézióval állunk szemben, több vizsgálat nem indokolt, de utólagos endoszkópiát kell végezni. Ha az elváltozás nagyobb, mint 1 cm, az EUS kötelező. Ha az elváltozás kicsi és az első, második vagy harmadik echorétegtől függ, diagnosztikus nyálkahártya-rezekciót lehet végezni, amely egyben terápiás is. Ha azonban az elváltozás a negyedik rétegben van és 2 cm-nél kisebb, kizárólag endoszkópiás megfigyelés javasolt. Ha 2 cm és 5 cm között van, akkor az EUS-FNA az ideális. Ha megállapítást nyer, hogy jóindulatú elváltozásról van szó, 6 hónap múlva utóvizsgálatot lehet végezni. Ha nem nőtt, nincs szükség további ellenőrzésre. Ha rosszindulatú, rosszindulatú potenciállal rendelkezik, vagy 5 cm-nél nagyobb, kezelés javasolt (42).
Végeredményben, mivel betegünknél 1 cm-nél kisebb volt az elváltozás, úgy véljük, hogy az elváltozása csak utóvizsgálatot érdemelt (lásd az algoritmust, 9. ábra). Egy év múlva újabb követéses vizsgálatot javasoltunk. Ha az elváltozás nem nőtt, további követéses vizsgálatokat tervezünk 2-3 évente, de ha növekszik, EUS-FNA-t és immunhisztokémiai vizsgálatot fogunk javasolni.
9. ábra. Kezelési algoritmus subepithelialis elváltozások esetén. EGD: felső endoszkópia. Bx: Biopszia. EUS: endoszkópos ultrahangvizsgálat. EMR: endoszkópos nyálkahártya-rezekció.
1. Polkowski M, Butruk E. Submucosalis elváltozások. Gastrointest Endosc Clin N Am 2005; 15: 33-55.
2. Nickl N. A gasztrointesztinális strómatumorok endoszkópos megközelítése. Gastrointest Endosc Clin N Am 2005; 15: 455-66.
3. Chak A. EUS a szubmukózális tumorokban. Gastrointest Endosc 2002; 56(4 Suppl.): S43-8.
4. Polkowski M. Endoszkópos ultrahang és endoszkópos ultrahangvezérelt finom tűs aspiráció a rosszindulatú submucosalis tumorok diagnózisában. Endoscopy 2005; 37: 635-45.
5. Hwang JH, Rulyak SD, Kimmey MB. Az Amerikai Gasztroenterológiai Társaság intézeti technikai áttekintése a gyomor szubepithelialis tömegeinek kezeléséről. Gastroenterology 2006; 130: 2217-28.
6. Rosch T, Kapfer B, Will U, et al. Az endoszkópos ultrahangvizsgálat pontossága a felső gasztrointesztinális szubmucosális elváltozásokban: prospektív multicentrikus vizsgálat. Scand J Gastroenterol 2002; 37: 856-62.
7. Kim JH, Lim JS, Lee YC, et al. Endosonográfiás jellemzők a gyomor ektópiás pancreaseinek a mesenchymális tumoroktól megkülönböztethetők. J Gastroenterol Hepatol 2008; 23: 301-7.
8. Palazzo L, Landi B, Cellier C, et al. A nyelőcső granuláris sejtes daganatainak endoszonográfiás jellemzői. Endoscopy 1997; 29: 850-3.
9. Souquet JC, Bobichon R. Az endoszkópos ultrahang szerepe a nyelőcső és a gyomor szubmukózus tumorainak kezelésében. Acta Endoscop 1996; 26: 307-12.
10. Ponder TB. Collins BT. A gyomor duplikációs cisztáinak finom tűs aspirációs biopsziája endoszkópos ultrahangos irányítással. Acta cytol 2003; 47: 571-4.
11. Farell J, Brugge W. Endoszkópos nyálkahártya reszekció a gyomor neoplazmáknál. Techniques in Gastrointestinal Endoscopy 2002; 4:34-39.
12. Soetikno RM, Gotoda T, Nakanishi Y, Soehendra N. Endoszkópos nyálkahártya reszekció. Gastrointest Endosc 2003; 57: 567-79.
13. Ginès A, Bordas JM, Llach J, Mondelo F, Evia A, Vázquez E, et al. Endoscopic ultrasonography in gastrointestinal stromal tumors (GIST). Gastrointest Endosc 1999; 49: AB209.
14. Palazzo L, Roseau G. Endosonografia digestiva. Barcelona: Ed. Masson 1998. 21-27. p.
15. Yamada Y, Kida M, Sakaguchi. A felső gasztrointesztinális traktus myogenikus tumorainak vizsgálata endoszkópos ultrahangvizsgálattal, különös tekintettel a jó- és rosszindulatú elváltozások differenciáldiagnózisára. Dig Endosc 1992; 4: 396-408.
16. Boyce GA, Sivak Jr. MV, Rosch T, et al. A felső gasztrointesztinális traktus szubmucosális elváltozásainak értékelése endoszkópos ultrahanggal. Gastrointest Endosc 1991; 37: 449-54.
17. Gress F, Schmitt C, Savides T, et al. Interobserver agreement for EUS in the evaluation and diagnosis of submucosal masses. Gastrointest Endosc 2001; 53: 71-6.
18. Caletti G, Zani L, Bolondi L, et al. Endoszkópos ultrahangvizsgálat a gyomor szubmukózus daganatának diagnosztikájában. Gastrointest Endosc 1989; 35: 413-8.
19. Kimmey MB, Martin RW, Haggitt RC, et al. A gasztrointesztinális ultrahangképek szövettani korrelátumai. Gastroenterology 1989; 96: 433-41.
20. Chak A, Isenberg G, Kobayashi K, et al. Egy dróton keresztüli katéteres US-szonda prospektív értékelése. Gastrointest Endosc 2000; 51: 202-5.
21. Tio TL, Tytgat GN, den Hartog Jager FC. Endoszkópos ultrahangvizsgálat a felső gasztrointesztinális traktus simaizomdaganatainak értékelésére: 42 eset tapasztalatai. Gastrointest Endosc1990; 36: 342-50.
22. Fusaroli P, Caletti G. Endoszkópos ultrahangvizsgálat. Endoscopy 2003; 35: 127-35
23. Byrne MF, Jowell PS. Gyomor-bélrendszeri képalkotás: endoszkópos ultrahang. Gastroenterology 2002; 122: 1631-48.
24. Hunt GC, Smith PP, Faigel DO. Az EUS-szel értékelt szubmukózális elváltozások szövetmintavételének hozama. Gastrointest Endosc 2004; 56: 202-5.
25. Levy M, Hammel P, Lamarque D, et al. Endoszkópos ultrahangvizsgálat a kezdeti stádiumbeosztás és a nyomon követés során a nyálkahártyához kapcsolódó nyirokszövet alacsony fokú gyomor-limfómában szenvedő, gyógyszeresen kezelt betegeknél. Gastrointest Endosc 1997; 46: 328-33.
26. Geller A, Wang KK, DiMagno EP. Az előbél duplikációs ciszták diagnózisa endoszkópos ultrahangvizsgálattal. Gastroenterology 1995; 109: 838-84.
27. Chak A, Canto MI, Rosch T, Dittler HJ, Hawes RH, Lok Tio T, Lightdale CJ, Boyce HW, Schieman J, Carpenter SL, Van Dam J, Kochman ML, Sivak MV Jr. A jó- és rosszindulatú stromasejtes daganatok endoszonográfiás differenciálása. Gastrointest Endosc 1997; 45: 468473.
28. Palazzo L, Landi B, Cellier C, Cuillerier E, Roseau G, Barbier JP. A jó- és rosszindulatú gastrointestinalis stromasejtes tumorok előrejelző endoszonográfiás jellemzői. Gut 2000; 46: 88-102.
29. Miettinen M, Majidi M, Lasota J. A gastrointestinalis stromalis tumorok (GIST) patológiája és diagnosztikai kritériumai: A review. Eur J Cancer 2002; 38(suppl 5): S39-S51.
30. Demetri GD, von Mehren M, Blanke CD, et al. Az imatinib-mezilát hatékonysága és biztonságossága előrehaladott gasztrointesztinális stromális tumorokban. N Engl J Med 2002; 347: 472-480.
31. Greenson JK. A gasztrointesztinális strómatumorok és a bél egyéb mesenchymális elváltozásai. Mod Pathol 2003; 16: 366-375.
32. Rossi CR, Mocelin S, Mencarelli R, et al. Gastrointestinalis strómatumorok: A sebészeti megközelítéstől a molekuláris megközelítésig. Int J Cancer 2003; 107: 171176.
33. Joensuu H, Fletcher C, Dimitrijevic S, et al. A rosszindulatú gasztrointesztinális strómatumorok kezelése. Lancet Oncol 2002; 3: 655-664.
34. Davila RE, Faigel DO. GI stromális tumorok. Gastrointest Endosc 2003; 58: 80-88.
35. Vakil N. Az elváltozások mérése endoszkópiával: áttekintés. Endoscopy 1995; 27: 694-697.
36. Roberts PJ, Eisenberg B. A gasztrointesztinális strómatumorok klinikai megjelenése és az operálható betegség kezelése. Eur J Cancer 2002; 38(suppl 5): S37-S38.
37. Yamada Y, Kida M, Sakaguchi. A felső gasztrointesztinális traktus myogenikus tumorainak vizsgálata endoszkópos ultrahangvizsgálattal, különös tekintettel a jó- és rosszindulatú elváltozások differenciáldiagnózisára. Dig Endosc 1992; 4: 396-408.
38. Yan H, Marchettini P, Acherman YI, et al. A gastrointestinalis strómatumor prognosztikai értékelése. Am J Clin Oncol 2003, 26: 221-228.
39. Trupiano JK, Stewart RE, Misick C, Appleman HD, Goldblum JR. Gyomor stromális tumorok. Klinikai-patológiai tanulmány 77 esetről, a jellemzők korrelációjával a nem agresszív és agresszív klinikai viselkedéssel. Am J Surg Pathol 2002; 26: 705-714.
40. Mallery S. Submucosalis tumorok és vastag gyomorszájfoltok. ASGE- 2002. 77-81. p.
41. Karaca C, Turner B, Cizginer S, Forcione D, Brugge W. Az EUS pontossága a kis gyomor szubepithelialis elváltozások értékelésében. Gastrointest Endosc 2010; 71: 722-7.
42. Mekky M, Yamao K, Sawaki A, MD, Mizuno N, Hara K, Nafeh M, Osman A, Koshikawa T, Yatabe Y, Bhatia V. Diagnostic utility of EUS-guided FNA in patients with gastric submucosal tumors. Gastrointest Endosc 2010; 71: 913-9.
1. Polkowski M, Butruk E. Submucosalis elváltozások. Gastrointest Endosc Clin N Am 2005; 15: 33-55.
2. Nickl N. Endoscopic approach to gastrointestinal stromal tumors. Gastrointest Endosc Clin N Am 2005; 15: 455-66.
3. Chak A. EUS a szubmukózus tumorokban. Gastrointest Endosc 2002; 56(4 Suppl.): S43-8.
4. Polkowski M. Endoszkópos ultrahang és endoszkópos ultrahangvezérelt finom tűs aspiráció a malignus submucosalis tumorok diagnosztikájában. Endoscopy 2005; 37: 635-45.
5. Hwang JH, Rulyak SD, Kimmey MB. Az Amerikai Gasztroenterológiai Társaság intézeti technikai áttekintése a gyomor szubepithelialis tömegeinek kezeléséről. Gastroenterology 2006; 130: 2217-28.
6. Rosch T, Kapfer B, Will U, et al. Az endoszkópos ultrahangvizsgálat pontossága a felső gasztrointesztinális szubmucosális elváltozásokban: prospektív multicentrikus vizsgálat. Scand J Gastroenterol 2002; 37: 856-62.
7. Kim JH, Lim JS, Lee YC, et al. A gyomor ektópiás hasnyálmirigyének endoszonográfiás jellemzői, amelyek megkülönböztethetők a mesenchymális tumoroktól. J Gastroenterol Hepatol 2008; 23: 301-7.
8. Palazzo L, Landi B, Cellier C, et al. A nyelőcső granuláris sejtes daganatainak endoszonográfiás jellemzői. Endoscopy 1997; 29: 850-3.
9. Souquet JC, Bobichon R. Az endoszkópos ultrahang szerepe a nyelőcső és a gyomor szubmukózus tumorainak kezelésében. Acta Endoscop 1996; 26: 307-12.
10. Ponder TB. Collins BT. A gyomor duplikációs cisztáinak finom tűs aspirációs biopsziája endoszkópos ultrahangos irányítással. Acta cytol 2003; 47: 571-4.
11. Farell J, Brugge W. Endoszkópos nyálkahártya reszekció a gyomor neoplazmáknál. Techniques in Gastrointestinal Endoscopy 2002; 4:34-39.
12. Soetikno RM, Gotoda T, Nakanishi Y, Soehendra N. Endoszkópos nyálkahártya reszekció. Gastrointest Endosc 2003; 57: 567-79.
13. Ginès A, Bordas JM, Llach J, Mondelo F, Evia A, Vázquez E, et al. Endoscopic ultrasonography in gastrointestinal stromal tumors (GIST). Gastrointest Endosc 1999; 49: AB209.
14. Palazzo L, Roseau G. Endosonografia digestiva. Barcelona: Ed. Masson 1998. 21-27. p.
15. Yamada Y, Kida M, Sakaguchi. A felső gasztrointesztinális traktus myogenikus tumorainak vizsgálata endoszkópos ultrahangvizsgálattal, különös tekintettel a jó- és rosszindulatú elváltozások differenciáldiagnózisára. Dig Endosc 1992; 4: 396-408.
16. Boyce GA, Sivak Jr. MV, Rosch T, et al. A felső gasztrointesztinális traktus szubmukózális elváltozásainak értékelése endoszkópos ultrahanggal. Gastrointest Endosc 1991; 37: 449-54.
17. Gress F, Schmitt C, Savides T, et al. Interobserver agreement for EUS in the evaluation and diagnosis of submucosal masses. Gastrointest Endosc 2001; 53: 71-6.
18. Caletti G, Zani L, Bolondi L, et al. Endoszkópos ultrahangvizsgálat a gyomor szubmukózus daganatának diagnosztikájában. Gastrointest Endosc 1989; 35: 413-8.
19. Kimmey MB, Martin RW, Haggitt RC, et al. A gasztrointesztinális ultrahangképek szövettani korrelátumai. Gastroenterology 1989; 96: 433-41.
20. Chak A, Isenberg G, Kobayashi K, et al. Egy dróton keresztüli katéteres US-szonda prospektív értékelése. Gastrointest Endosc 2000; 51: 202-5.
21. Tio TL, Tytgat GN, den Hartog Jager FC. Endoszkópos ultrahangvizsgálat a felső gasztrointesztinális traktus simaizomdaganatainak értékelésére: 42 eset tapasztalatai. Gastrointest Endosc1990; 36: 342-50.
22. Fusaroli P, Caletti G. Endoszkópos ultrahangvizsgálat. Endoscopy 2003; 35: 127-35
23. Byrne MF, Jowell PS. Gyomor-bélrendszeri képalkotás: endoszkópos ultrahang. Gastroenterology 2002; 122: 1631-48.
24. Hunt GC, Smith PP, Faigel DO. Az EUS-szel értékelt szubmukózális elváltozások szövetmintavételének hozama. Gastrointest Endosc 2004; 56: 202-5.
25. Levy M, Hammel P, Lamarque D, et al. Endoszkópos ultrahangvizsgálat a kezdeti stádiumbeosztás és a nyomon követés során a nyálkahártyához kapcsolódó nyirokszövet alacsony fokú gyomor-limfómájában szenvedő, gyógyszeresen kezelt betegeknél. Gastrointest Endosc 1997; 46: 328-33.
26. Geller A, Wang KK, DiMagno EP. Az előbél duplikációs ciszták diagnózisa endoszkópos ultrahangvizsgálattal. Gastroenterology 1995; 109: 838-84.
27. Chak A, Canto MI, Rosch T, Dittler HJ, Hawes RH, Lok Tio T, Lightdale CJ, Boyce HW, Schieman J, Carpenter SL, Van Dam J, Kochman ML, Sivak MV Jr. A jó- és rosszindulatú stromasejtes daganatok endoszonográfiás differenciálása. Gastrointest Endosc 1997; 45: 468473.
28. Palazzo L, Landi B, Cellier C, Cuillerier E, Roseau G, Barbier JP. A benignus és malignus gastrointestinalis stromasejtes tumorok előrejelző endoszonográfiás jellemzői. Gut 2000; 46: 88-102.
29. Miettinen M, Majidi M, Lasota J. A gastrointestinalis stromalis tumorok (GIST) patológiája és diagnosztikai kritériumai: A review. Eur J Cancer 2002; 38(suppl 5): S39-S51.
30. Demetri GD, von Mehren M, Blanke CD, et al. Az imatinib-mezilát hatékonysága és biztonságossága előrehaladott gasztrointesztinális stromális tumorokban. N Engl J Med 2002; 347: 472-480.
31, Greenson JK. A gasztrointesztinális strómatumorok és a bél egyéb mesenchymális elváltozásai. Mod Pathol 2003; 16: 366-375.
32. Rossi CR, Mocelin S, Mencarelli R, et al. Gastrointestinalis strómatumorok: A sebészeti megközelítéstől a molekuláris megközelítésig. Int J Cancer 2003; 107: 171176.
33. Joensuu H, Fletcher C, Dimitrijevic S, et al. A rosszindulatú gasztrointesztinális strómatumorok kezelése. Lancet Oncol 2002; 3: 655-664.
34. Davila RE, Faigel DO. GI stromális tumorok. Gastrointest Endosc 2003; 58: 80-88.
35. Vakil N. Az elváltozások mérése endoszkópiával: áttekintés. Endoscopy 1995; 27: 694-697.
36. Roberts PJ, Eisenberg B. A gastrointestinalis strómatumorok klinikai megjelenése és az operálható betegség kezelése. Eur J Cancer 2002; 38(suppl 5): S37-S38.
37. Yamada Y, Kida M, Sakaguchi. A felső gasztrointesztinális traktus myogenikus tumorainak vizsgálata endoszkópos ultrahangvizsgálattal, különös tekintettel a jó- és rosszindulatú elváltozások differenciáldiagnózisára. Dig Endosc 1992; 4: 396-408.
38. Yan H, Marchettini P, Acherman YI, et al. A gastrointestinalis strómatumor prognosztikai értékelése. Am J Clin Oncol 2003, 26: 221-228.
39. Trupiano JK, Stewart RE, Misick C, Appleman HD, Goldblum JR. Gyomorsztróma tumorok. Klinikai-patológiai tanulmány 77 esetről, a jellemzők korrelációjával a nem agresszív és agresszív klinikai viselkedéssel. Am J Surg Pathol 2002; 26: 705-714.
40. Mallery S. Submucosalis tumorok és vastag gyomorszöveti fols. ASGE- 2002. p. 77-81.
41. Karaca C, Turner B, Cizginer S, Forcione D, Brugge W. Az EUS pontossága a kis gyomor szubepithelialis elváltozások értékelésében. Gastrointest Endosc 2010; 71: 722-7.
42. Mekky M, Yamao K, Sawaki A, MD, Mizuno N, Hara K, Nafeh M, Osman A, Koshikawa T, Yatabe Y, Bhatia V. Diagnostic utility of EUS-guided FNA in patients with gastric submucosal tumors. Gastrointest Endosc 2010; 71: 913-9.