Bevezetés
A 60 ml/perc/1,73 m2-nél alacsonyabb becsült glomeruláris filtrációs ráta (eGFR) az általános és a magas kockázatú populációkban a teljes és kardiovaszkuláris halálozás fokozott kockázatával jár együtt.1,2. A csökkent eGFR-rel rendelkező egyének nagyobb valószínűséggel halnak meg szív- és érrendszeri okok miatt, mint veseelégtelenségben.1,3 A
ml/perc/1,73 m2 eGFR prevalenciája az életkor előrehaladtával fokozatosan nő, és a 80 évnél idősebbeknél eléri az 50%-ot.4,5 A világ népességének öregedése miatt a vesefunkciónak az elkövetkező években várhatóan egyre nagyobb hatása lesz a szív- és érrendszeri betegségekre.
Egyes tanulmányok arról számoltak be, hogy az eGFR és a halálozás közötti kapcsolat az életkorral csökken.1,6 Ezenkívül folyamatos vita folyik a mérsékelten csökkent vesefunkció (eGFR 45-59ml/min/1,73 m2) klinikai jelentőségéről a 65 évnél idősebbeknél.7,8 A halálozás szignifikánsan magasabbnak bizonyult eGFR 6,9, de csak eGFR 4 esetén,10-12 A kardiovaszkuláris események (CVE) tekintetében az eredmények még ellentmondásosabbak.12,13 Ez a forgatókönyv néhány szerzőt arra késztetett, hogy életkorral kalibrált küszöbértéket, azaz eGFR 8-at javasoljon, ami azért érdekes, mert az idősebbeknél az enyhébb csökkenések nagy gyakorisággal fordulnak elő.
Az eredmények közötti eltérések egy része a kreatinin mérésére használt módszerek, az eGFR becslő egyenletek vagy a vizsgált populációk jellemzői közötti különbségeknek tudható be. Ráadásul a koszorúér-betegség (CHD) alacsony előfordulási gyakoriságával rendelkező területeken végzett vizsgálatok nem vontak be 74 évnél idősebb egyéneket14,15 vagy nem szolgáltattak részletes információkat az egyes korcsoportokra vonatkozóan.16,17
A vizsgálat célja az eGFR és a teljes halálozás (ACM), valamint a szív- és érrendszeri betegségek előfordulása közötti életkori összefüggés értékelése volt 60 évnél idősebb egyének körében egy olyan dél-európai populációban, ahol alacsony a CHD előfordulása.18
MódszerekTervezés és vizsgálati populáció
Retrospektív kohorszvizsgálatot végeztünk, amelybe bevontunk minden 1950-ben vagy azelőtt született egyént, akiket az északkelet-spanyolországi Costa de Ponent alapellátási szolgálat részét képező 40 központosított laboratóriummal rendelkező egészségügyi alapellátó központ egyikében regisztráltak (873 549 fős lakosságot szolgálva ki), és akiknek a kreatininszintjét 2010. január 1. és 2011. december 31. között mérték. Kizártuk az 5. stádiumú vesebetegségben szenvedő betegeket (eGFR
Adatforrások
A klinikai alapadatokat az alapellátás elektronikus orvosi nyilvántartásából nyertük; a kardiovaszkuláris alapbetegségek esetében a 2005 óta szív- és érrendszeri betegség vagy revaszkularizációs beavatkozások miatti korábbi kórházi felvételeket is figyelembe vettük. Az indexdátumot úgy határoztuk meg, mint amikor az első kreatininmérés történt a felvételi időszakban; a kiindulási állapotot az indexdátumot megelőző 1 év és az azt követő 1 hónap között regisztrált jellemzők alapján határoztuk meg.
Vesefunkció értékelése
A szérum kreatininszintet egyetlen laboratórium mérte a standardizált Jaffe-kompenzált kinetikus módszerrel, amely izotóphígításos tömegspektrofotometriás referenciamódszerre vezethető vissza. Az eGFR-t a Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) kreatinin egyenlet19 segítségével becsülték, a faji hovatartozásra vonatkozó korrekció nélkül, amely nem állt rendelkezésre.
A KDIGO 2012-es klinikai gyakorlati útmutatója szerint klinikai kategóriákba soroltuk az eGFR-t: 15-29, 30-44, 45-59, 60-89 és 90-119.20
Kovariánsok
Adatokat gyűjtöttünk az életkorról, a nemről, a dohányzási státuszról (soha nem dohányzó, aktív dohányos és volt dohányos), a hiperkoleszterinémiáról (szérumkoleszterin > 6.4 mmol/l vagy statinkezelés), kardiovaszkuláris kockázati tényezők (magas vérnyomás, cukorbetegség) és korábbi kardiovaszkuláris betegség diagnózisa (CHD, cerebrovaszkuláris betegség, perifériás artériás betegség és szívelégtelenség).
Eredmények
A halál időpontjára vonatkozó adatokat kórházi vagy adminisztratív nyilvántartásokból nyertük, az ok meghatározása nélkül; a CVE valamennyi végpontját kórházi nyilvántartásokból nyertük, amelyek Katalónia, Spanyolország északkeleti régiójának valamennyi kórházából tartalmaznak adatokat. Az elsődleges végpont az ACM volt, a másodlagos végpont pedig bármely CVE, beleértve a CHD-t (akut szívinfarktus , instabil angina pectoris vagy angina pectoris ) és a stroke-ot (nem vérzéses stroke , vagy tranziens ischaemiás attak ). Külön elemeztük a kemény CVE-t (akut myocardialis infarctus és nem vérzéses stroke), a CHD-t és a stroke-ot.
A résztvevőket az indexdátumot követő 1 hónaptól követtük nyomon halálukig, másik egészségügyi rendszerbe való áthelyezésükig vagy a vizsgálat végéig (2013. december 31.).
A vizsgálati protokollt a helyi klinikai kutatási etikai bizottság (IDIAP Jordi Gol P11/43) hagyta jóvá. A résztvevőktől nem kértünk tájékozott beleegyezést, mivel a kutatási etikai bizottság ezt nem tartotta szükségesnek.
Statisztikai elemzés
Minden változót korcsoportonként (60-74 év és ≥ 75 év) elemeztünk. Ezeket a korcsoportokat azért használtuk, mert egybeesnek a szív- és érrendszeri betegségek kockázatának becslésére szolgáló legtöbb jelenlegi rendszerrel.18 A folytonos változókat átlag ± standard eltérés vagy medián (nem normális eloszlás esetén), a kategorikus változókat pedig abszolút és relatív gyakoriságként írtuk le. A Student t-tesztet és a Kruskall-Wallis-tesztet használtuk a normális és a nem normális eloszlású folytonos változók csoportjai közötti különbségek értékelésére. A kategorikus változók esetében a khi-négyzet tesztet használtuk, és az eGFR-kategóriák közötti lineáris tendenciát is vizsgáltuk. Az incidenseket Kaplan-Meier-görbék segítségével számoltuk ki 3 év alatt.
Az egyes csoportokon belül Cox-féle arányos veszélyességi modelleket használtunk az eGFR mint folyamatos változó és az ACM kockázata közötti összefüggés becslésére szolgáló kockázati arányok (HR) becslésére. Az eGFR-hatás linearitását a Cox-modellekben 4 szabadsági fokú lineáris spline-ok segítségével ellenőriztük. A ≥ 120-as eGFR-rel rendelkező egyének kis száma (n = 14) és az e pont feletti becslések csökkent pontossága miatt ezeket az egyéneket kizártuk a további elemzésekből. A KDIGO 2012 klinikai határértékek által meghatározott kategorikus eGFR és az ACM közötti összefüggés vizsgálatára is Cox arányos veszélyességi modelleket használtunk. Minden CVE esetében az elemzést versengő kockázatú túlélési technikákkal végeztük (Fine-Gray arányos szubdisztributív hazard regresszió), hogy figyelembe vegyük a véletlen halálozás lehetséges hatását a becslésekre.
A veszély időbeli arányosságának feltételezését grafikusan (Schönfeld reziduumok) értékeltük az expozíciós változó (eGFR) esetében.
A folyamatos és a kategorikus eGFR-re vonatkozó Cox-féle arányos veszélyességi modelleket az életkor, a nem, a dohányzási státusz, a hiperkoleszterinémia, a cukorbetegség, a magas vérnyomás és a korábbi kardiovaszkuláris betegség (ischaemiás szív-, cerebrovaszkuláris, perifériás artériás betegség vagy szívelégtelenség) figyelembevételével igazították ki. A modelleket tovább igazították a rendelkezésre álló adatokkal rendelkező kezelésekhez (sztatinok és a renin-angiotenzin rendszerhez tartozó gyógyszerek).
Noha a CKD-EPI-t széles életkorú (18-97 éves) minta felhasználásával dolgozták ki, kevés 80 éves és idősebb egyén volt jelen. Ezért érzékenységi elemzést végeztünk a Berlin Initiative Study-1 egyenlet segítségével,21 amelyet kifejezetten egy ≥ 70 éves egyénekből álló közösségi mintán fejlesztettek ki.
A végleges modelleket a Hosmer-Lemeshow-teszt és a receiver operating characteristic curve alatti terület segítségével validáltuk. Mindkét módszer esetében figyelembe vettük a cenzorálást és a konkurens eseményeket.
Minden statisztikai elemzést az R 3.2.3 verziójával (R: a language and environment for statistical computing R Foundation for Statistical Computing, Bécs, Ausztria) végeztünk, 2 oldalú tesztekkel és P
Eredmények
A 138 040 alkalmas személy (73.a teljes, ≥ 60 éves korú lakosság 1%-a ezen a területen) 6797 személyt kizártak, mert otthoni ápolásban részesültek, 509 személynek 5. stádiumú vesebetegsége volt, és 501 személyt követtek nyomon a kiegészítő anyag 1. ábrája). A bevont és kizárt személyek között nem volt klinikailag szignifikáns különbség az életkor (P = .374) vagy a nem (56,1% és 55,1% nő, illetve; P
A teljes minta medián életkora 70 év volt , és a résztvevők 56,1%-a nő volt. Az eGFR mediánja 82,42 volt ; a résztvevők 13,5%-ának volt eGFR 1. táblázat), az eGFR P
P mL/min/1,73 m2 kategória prevalenciája.
A vizsgált populáció kiindulási jellemzői, Életkor és becsült glomeruláris filtrációs ráta kategória szerint rétegezve
| ALL | 90-119 mL | 60-89 mL | 45-59 mL | 30-44 mL | 15-29 mL | P összességében | P tendencia | ||
|---|---|---|---|---|---|---|---|---|---|
| 60- 74 évesek-idősek | |||||||||
| Betegek | 88 356 | 34 546 | 48 354 | 4257 | 986 | 213 | |||
| Életkor, y | 66.0 | 64.0 | 68.0 | 70.0 | 70.0 | 70.0 | |||
| Nem, nő | 47 549 (53.8) | 19 927 (57.7) | 24 863 (51.4) | 2173 (51.0) | 489 (49.6) | 97 (45.5) | |||
| Dohányzás | |||||||||
| Soha nem dohányzott | 54 452 (61.6) | 21 525 (62.3) | 29 713 (61.4) | 2572 (60.4) | 532 (54.0) | 110 (51.6) | |||
| Aktív dohányos | 10 458 (11.8) | 4714 (13.6) | 5189 (10.7) | 422 (9.91) | 107 (10.9) | 26 (12.2) | |||
| Volt dohányos | 23 446 (26.5) | 8307 (24.0) | 13 452 (27.8) | 1263 (29.7) | 347 (35.2) | 77 (36.2) | |||
| Hypercholesterinaemia | 44 990 (50.9) | 16 710 (48.4) | 24 994 (51.7) | 2529 (59.4) | 613 (62.2) | 144 (67.6) | |||
| Cukorbetegség | 19 998 (22.6) | 7950 (23.0) | 10 226 (21.1) | 1296 (30.4) | 431 (43.7) | 95 (44.6) | |||
| Hipertónia | 49 781 (56.3) | 17 167 (49.7) | 28 226 (58.4) | 3346 (78.6) | 857 (86.9) | 185 (86.9) | |||
| Koszorúér-betegség | 6200 (7.02) | 1825 (5.28) | 3629 (7.51) | 527 (12.4) | 173 (17.5) | 46 (21.6) | |||
| Cerebrovaszkuláris betegség | 4231 (4.79) | 1286 (3.72) | 2428 (5.02) | 361 (8.48) | 120 (12.2) | 36 (16.9) | |||
| PAD | 1686 (1.91) | 510 (1.48) | 906 (1.87) | 171 (4.02) | 76 (7.71) | 23 (10.8) | |||
| Szívelégtelenség | 1891 (2.14) | 453 (1.31) | 1011 (2.09) | 259 (6.08) | 132 (13.4) | 36 (16.9) | |||
| Korábbi CVD* | 12 012 (13.6) | 3628 (10.5) | 6854 (14.2) | 1080 (25.4) | 361 (36.6) | 89 (41.8) | |||
| sztatinok | 39 392 (44.6) | 14 307 (41.4) | 22 025 (45.5) | 2341 (55.0) | 581 (58.9) | 138 (64.8) | |||
| RASD | 40 619 (46.0) | 13 468 (39.0) | 23 203 (48.0) | 3009 (70.7) | 787 (79.8) | 152 (71.4) | |||
| ≥ 75 éves…idősek | |||||||||
| betegek | 41 877 | 1768 | 27 971 | 8005 | 3449 | 684 | |||
| kor, y | 79.0 | 77.0 | 79.0 | 81.0 | 82.0 | 83.0 | |||
| Nem, nő | 25 482 (60.8) | 1004 (56.8) | 16 706 (59.7) | 5056 (63.2) | 2273 (65.9) | 443 (64.8) | |||
| Dohányzás | |||||||||
| Soha nem dohányzott | 30 251 (72.2) | 1202 (68.0) | 20 086 (71.8) | 5836 (72.9) | 2616 (75.8) | 511 (74.7) | |||
| Aktív dohányos | 1866 (4.46) | 126 (7.13) | 1278 (4.57) | 325 (4.06) | 113 (3.28) | 24 (3.51) | |||
| Volt dohányos | 9760 (23.3) | 440 (24.9) | 6607 (23.6) | 1844 (23.0) | 720 (20.9) | 149 (21.8) | |||
| Hypercholesterinaemia | 20 705 (49.4) | 798 (45.1) | 13 621 (48.7) | 4115 (51.4) | 1823 (52.9) | 348 (50.9) | |||
| Diabetes mellitus | 11 889 (28.4) | 586 (33.1) | 7587 (27.1) | 2309 (28.8) | 1161 (33.7) | 246 (36.0) | |||
| Hipertónia | 30 563 (73.0) | 1078 (61.0) | 19 310 (69.0) | 6562 (82.0) | 3018 (87.5) | 595 (87.0) | |||
| Koszorúér-betegség | 5074 (12.1) | 146 (8.26) | 3037 (10.9) | 1150 (14.4) | 603 (17.5) | 138 (20.2) | |||
| Cerebrovaszkuláris betegség | 4567 (10.9) | 171 (9.67) | 2781 (9.94) | 1034 (12.9) | 486 (14.1) | 95 (13.9) | |||
| PAD | 2904 (6.93) | 49 (2.77) | 807 (2.89) | 327 (4.08) | 185 (5.36) | 49 (7.16) | |||
| Szívelégtelenség | 3275 (7.82) | 90 (5.09) | 1648 (5.89) | 822 (10.3) | 551 (16.0) | 164 (24.0) | |||
| Korábbi CVD* | 11 691 (27.9) | 389 (22.0) | 6900 (24.7) | 2657 (33.2) | 1419 (41.1) | 326 (47.7) | |||
| sztatinok | 19 029 (45.4) | 747 (42.3) | 12 460 (44.5) | 3789 (47.3) | 1698 (49.2) | 335 (49.0) | |||
| RASD | 25 247 (60.3) | 824 (46.6) | 15 632 (55.9) | 5649 (70.6) | 2644 (76.7) | 498 (72,8) | |||
CVD, szív- és érrendszeri betegség; PAD, perifériás artériás betegség; RASD, renin-angiotenzin rendszer gyógyszerek.
Az adatok – eltérő megjelölés hiányában – szám (%) vagy medián .
Beleértve a cerebrovaszkuláris, PAD és szívelégtelenséget.
A Cox-modellekben az eGFR összefüggéseinek vizsgálatához mindkét csoportban az eGFR = 80-at határoztuk meg referenciaként (a CKD-Prognostic Consortium metaanalízisében is használták)6 , mivel ez volt a populációban az eGFR mediánja, a 60-90-et pedig klinikai kategóriaként, mivel ez tartalmazta a legtöbb egyént és klinikailag szignifikáns volt.
A medián követési idő 38,2 hónap volt . Összesen 6474 halálesetet, 1573 CHD eseményt és 2236 cerebrovaszkuláris eseményt regisztráltak. Minden kimenetel szignifikánsan gyakoribb volt az idősebb korcsoportban (P 2. táblázat), kivéve a stroke-eseményeket, amelyek kissé ritkábban fordultak elő a 15-29 eGFR-rel rendelkező egyéneknél.
A vizsgálati populáció eredményei életkor és becsült glomeruláris filtrációs ráta szerint rétegezve a Kaplan-Meier becslések szerint 3 év alatt. Log Rank teszt (P Összességében), Lineáris trend Wald-teszt (P Trend)
| Minden | 90-119 mL | 60-89 mL | 45-59 mL | 30-44 mL | 15-29 mL | P összes | P trend | ||
|---|---|---|---|---|---|---|---|---|---|
| 60- 74 évesek | |||||||||
| Betegek | 88 356 | 34 546 | 48 354 | 4257 | 986 | 213 | |||
| Összes-halálozás, % | 2.08 | 1.79 | 1.93 | 3.91 | 8.20 | 18.6 | |||
| Bármilyen CVE, % | 2.09 | 1.51 | 2.26 | 3.78 | 5.60 | 7.94 | |||
| Kemény CVE, % | 1.46 | 1.06 | 1.56 | 2.76 | 4.05 | 4.78 | |||
| CHD, % | 0.96 | 0.74 | 1.02 | 1.38 | 2.83 | 4.80 | |||
| Stroke, % | 1.16 | 0.79 | 1.27 | 2.44 | 2.88 | 3.17 | |||
| ≥ 75 éves…idősek | |||||||||
| Betegek | 41 877 | 1768 | 27 971 | 8005 | 3449 | 684 | |||
| Összes halálozási ok, % | 9.88 | 10.5 | 7.89 | 11.7 | 17.8 | 28.5 | |||
| Bármilyen CVE, % | 4.34 | 3.31 | 3.90 | 4.80 | 6.77 | 8.35 | |||
| Kemény CVE, % | 3.24 | 2.22 | 2.90 | 3.75 | 4.90 | 5.93 | |||
| CHD, % | 1.69 | 1.30 | 1.48 | 1.77 | 2.86 | 5.41 | |||
| Stroke, % | 2.74 | 2.13 | 2.49 | 3.17 | 4.00 | 3.34 | |||
CHD, coronary heart disease; CVE, cardiovascular event.
Mindkét modell, az ACM és bármely CVE esetében, az expozíciós változó (eGFR; az adatok nem láthatóak) időbeli arányosságát mutatta a veszélynek.
Az eGFR és az ACM kockázata közötti összefüggés mindkét korcsoportban U alakú mintázatot követett, de az idősebb csoportban enyhébb volt (1. ábra). Ezzel szemben a bármely CVE-re vonatkozó HR-ek lineáris eloszlást mutattak, a kockázat progresszív növekedésével a magasabb eGFR-től az alacsonyabb felé; ez a mintázat mindkét korcsoportban hasonló volt, és más kardiovaszkuláris végpontok esetében is (a kiegészítő anyag 2. ábrája). Az összes végpont esetében a HR-ek az ≥ 75 éveseknél eGFR = 60 alatt váltak szignifikánssá (1. ábra), az ACM esetében eGFR = 55 és eGFR = 60 között, bármely CVE esetében pedig eGFR ∼ 50-nél.
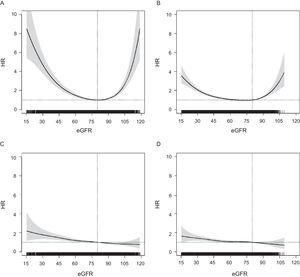
Az eGFR (folytonos változó) és az ACM kockázata közötti összefüggés a P-érték
Az eGFR klinikai kategóriáit tekintve az ACM és bármely CVE kockázata mindkét korcsoportban fokozatosan nőtt a 60 és 89 év közötti eGFR kategóriákban (2. ábra). Az ACM kockázatának növekedése sokkal nagyobb és meredekebb volt a 60-74 éveseknél, mint a ≥ 75 éveseknél, míg a bármely CVE kockázata mindkét korcsoportban hasonlóbb volt, és az eGFR = 45-59 kategóriában ≥ 75 éveseknél határesetben szignifikáns volt. A sztatinokkal és a renin-angiotenzin rendszer gyógyszerekkel történő kezelés további korrekciója nem módosította a HR-értékeket (az adatok nem láthatóak). Azt is megállapítottuk, hogy a 90 és 119 közötti eGFR-rel rendelkező egyéneknél a legidősebb csoportban magasabb volt a halálozás kockázata, és csak a legfiatalabb csoportban volt szignifikánsan alacsonyabb bármely CVE kockázata. A CHD-re, a stroke-ra és a kemény CVE-re vonatkozó modellek eredményei hasonlóak voltak a bármilyen CVE-re vonatkozó modellekhez (a kiegészítő anyag 3. ábrája). Az eGFR kiszámításához a Berlin Initiative Study-1 egyenletet használó érzékenységi elemzés nem mutatott különbséget (a kiegészítő anyag 4. ábrája).

Az eGFR-kategóriák és a teljes halálozás és bármely kardiovaszkuláris esemény kockázata közötti összefüggés, a halálozást a kardiovaszkuláris események konkurens eseményeként figyelembe vevő, kiigazított Cox-féle arányos kockázati modellekkel értékelve (általános P-érték
A végleges modellek jó kalibrációt és megkülönböztetést mutattak (a kiegészítő anyag 5. ábrája és a kiegészítő anyag táblázata).
MEGJEGYZÉS
Egy alacsony kardiovaszkuláris kockázatú országban élő ≥ 60 évesek populációjában az ACM és bármely CVE kockázata fokozatosan nőtt az eGFR csökkenésével, mind a 60-74 évesek, mind az ≥ 75 évesek körében, függetlenül az egyéb kockázati tényezőktől és a kardiovaszkuláris betegségektől. Az idősebb korcsoportban azonban a HR-ek alacsonyabb eGFR-nél (eGFR = 60 alatt) szignifikánssá váltak, és az eGFR = 45-59 kategóriában bármely CVE esetében határesetben szignifikánsak voltak. A halálozási kockázat eGFR-rel összefüggő növekedése magasabb volt a 60-74 éveseknél, mint az ≥ 75 éveseknél, de hasonló volt a CVE-kockázat tekintetében. Ezenkívül az eGFR és a halálozás közötti összefüggés U-alakú mintázatot követett, a 90-119 kategóriában a halálozás növekedett, és ≥ 75 éveseknél volt magasabb.
Ebben a vizsgálati populációban a korcsoportok 2 jól differenciált csoportot határoztak meg, amelyekben az eGFR-rel rendelkező egyének száma
Amint az várható volt, a kardiovaszkuláris kimenetelek előfordulása alacsonyabb volt, mint a nem mediterrán országokban az idős egyénekről beszámoltak,22 de magasabb volt, mint a fiatalabbaké a mi területünkön.23 Az incidens cerebrovascularis események gyakoribbak voltak, mint a coronariaesemények, amit szintén leírtak idősek vizsgálataiban.22
A korábbi jelentésekkel összhangban,1,6,14,22,24 U alakú kapcsolatot figyeltünk meg az eGFR mint folyamatos változó és az ACM között mindkét korcsoportban. Figyelemre méltó, hogy az eGFR = 90-119 kategóriában megfigyelt ACM többletkockázat magasabb volt az idősebb betegeknél. Ez a kockázatnövekedés tükrözheti a halálhoz vezető egyéb betegségek következtében fellépő izomsorvadás okozta zavaró hatásokat; ez a kreatinin alapú becslési formulák ismert korlátja.19 Ezzel szemben azt találtuk, hogy az új CVE kockázata a magasabb eGFR-től az alacsonyabb eGFR felé haladva nőtt. Ez összhangban van néhány korábbi jelentéssel,13,23,25 bár mások a kardiovaszkuláris mortalitás6,12 és a szív- és érrendszeri betegségek esetében kevésbé kifejezett U alakú összefüggésről számoltak be.15 Így az incidens CVE, amelyet a kreatinin alapú becslési képletek korlátai kevésbé befolyásolnak, megbízhatóbb mutatója lehet az eGFR kardiovaszkuláris kockázatra gyakorolt prognosztikai hatásának.
Ezeknek az időseknél mérsékelten csökkent eGFR klinikai jelentőségéről ellentmondásos bizonyítékok állnak rendelkezésre. Kevés tanulmány használta a jelenleg ajánlott egyenletet az eGFR-rel összefüggő kockázat értékelésére és az eredmények korcsoportonkénti összehasonlítására. Tudomásunk szerint a miénk az első olyan vizsgálat, amely ezt egy olyan idős populációban végezte el, amely olyan régióban lakik, ahol a CHD előfordulása alacsony.
A CKD-PC meta-analízis6 az ACM esetében szignifikáns korrigált HR-ről számolt be eGFR 9 esetén, és hasonló eredményt tett 60-69, 70-79 és ≥ 80 éveseknél. Ezzel szemben a nyolcvanéveseknél a Cardiovascular Health Study12 csak ≤ 43 eGFR mellett talált szignifikáns HR-t. Dél-Európában azt találták, hogy a 65 évnél idősebbeknél eGFR 16 és a 60-74 éveseknél eGFR 15 esetén a halálozás emelkedik. 35-74 éves, szív- és érrendszeri betegséggel nem rendelkező személyeknél az eGFR az ACM határesetben szignifikáns előrejelzőjének bizonyult14 , és eGFR = 45-59 esetén szignifikánsan nagyobb kockázatot mutatott.
A kardiovaszkuláris mortalitás tekintetében a 65-74 és ≥ 75 évesek csoportjában a HR-ek szignifikánsak voltak az eGFR 6 esetében, míg a kreatinin alapú egyenleteket használó Cardiovascular Health Study nem talált hasonló összefüggést a nyolcvanéveseknél.12 Az incidens CVE kockázatát illetően a PREVEND vizsgálat a 60 évnél fiatalabbaknál összefüggést talált az eGFR-rel, de az ≥ 60 éveseknél nem.13 Dél-Európában eGFR 16 esetén a kardiovaszkuláris halálozás, eGFR 15 és eGFR 23
esetén pedig az incidens kardiovaszkuláris betegség (marginálisan szignifikáns) kockázatának növekedéséről számoltak be
A mi vizsgálatunkban az ACM és bármely CVE HR-je folyamatosan nőtt az eGFR csökkenésével a 60-89 éves kategória alatt, mind a 60-74 éves, mind az ≥ 75 éves csoportokban. A korábbi jelentésekhez hasonlóan a HR-értékek és a kockázati gradiens alacsonyabbak voltak a legidősebb csoportban,6,9 és a folyamatos eGFR elemzése során a HR-értékek szignifikánssá váltak eGFR 6
A legtöbb jelenlegi nemzetközi irányelv az összes eGFR 18,20,26 A jelen vizsgálatban az ≥ 75 éves résztvevők 20%-ának volt eGFR = 45-59, közülük 74%-nak ≥ 50 eGFR volt. Így a 45-59 év közötti kategóriába tartozó összes idősebb személyt magasabb kockázatúnak tekintve sok olyan személyt tennénk ki a kardiovaszkuláris rizikófaktorok agresszívebb célértékeinek és kezelésének, akiknek “nincs jelentős hozzáadott kockázata”. Ezenkívül a CHD-események 11%-kal megnövekedett relatív kockázata a 60-74 éveseknél nem biztos, hogy elegendő ahhoz, hogy az eGFR = 45-59 kategória CHD-kockázati egyenértéknek minősüljön azokban az országokban, ahol a CHD előfordulása alacsony.
Erősségek és korlátozások
Vizsgálatunk fő erőssége a bevont egyének igen nagy száma, valamint az, hogy reprezentatív lakossági mintából kerültek ki, ami tükrözi az alapellátásban kezelt betegek valós helyzetét. Majdnem minden > 60 éves korú egyén (93%) a katalán alapellátási rendszerben kezelt, és nagy százalékuknál volt kreatininmérés, valószínűleg azért, mert ez része az alapvető megelőző egészségügyi szűrésnek és az egyéb gyakori krónikus állapotok rutinszerű követésének ebben a populációban. Ezen túlmenően a kreatininmérési vizsgálatokat az ajánlásnak megfelelően izotóphígításos tömegspektrofotometriával kalibrálták egy referencia-módszerrel, és egy központosított laboratóriumban végezték, ami tovább csökkenti a variabilitást.
A vizsgálat eredményeit a különböző korlátozások fényében is értelmezni kell. Először is, az eGFR-értékeket és kategóriákat egyetlen mérés alapján osztották ki, ami a prognózissal kapcsolatos epidemiológiai vizsgálatokban szokásos. A regressziós hígítási torzítás miatt ez alábecsülheti az eGFR és az érdeklődésre számot tartó kimenetelek közötti valódi összefüggést. Ugyanakkor az ambuláns laboratóriumi adatbázisokból származó alacsony eGFR-mérésekről kimutatták, hogy idősebb egyéneknél viszonylag stabilak.27 Másodszor, nem vettük figyelembe néhány olyan tényező hatását, amelyek módosíthatják a vesefunkciót, mint például a daganatok, nefrotoxikus gyógyszerek, fertőzések vagy klinikailag interkurrens események. Úgy véljük, hogy ezeket a hatásokat minimalizálja a bevont betegek nagy száma. Harmadszor, az eGFR-t szérumkreatinin-mérésekből becsültük a CKD-EPI képlet segítségével, és elfogadjuk a kreatinin alapú becslési képletek korlátait, amelyek nagyobb hatással vannak a magasabb eGFR esetén.19 Nem korrigáltuk a faji hovatartozást, bár a mi populációnkban a kaukázusi etnikum túlsúlyban van, különösen ebben a korcsoportban. Továbbá, bár a CKD-EPI diagnosztikai és prognosztikai alkalmazása idősebb egyéneknél vita tárgyát képezi, és új képleteket fejlesztettek ki, a CKD-EPI jelenleg az ajánlott megközelítés20 , és széles körben használják az alapellátásban. Ezenkívül a Berlin Initiative Study-1 egyenlet szerint számított eGFR-rel végzett érzékenységi elemzés hasonló eredményeket hozott. Negyedszer, nem tudtuk értékelni a vizelet albumin hatását, mivel ezek az adatok nem álltak rendelkezésre; bár az eGFR és az albumin egyaránt ajánlott a CKD értékelésére, ezek független prognosztikai jelentőséget mutattak,1 és az itt bemutatott eredmények értékes információkkal egészítik ki az eGFR kardiovaszkuláris kockázatra gyakorolt hatását és a határértékeket idősebb egyéneknél. Ötödször, az adatok elektronikus egészségügyi nyilvántartásokból származnak, és nem zárható ki a téves adatfelvétel. Az alapellátásban a szív- és érrendszeri betegségekre vonatkozó adatokról bebizonyosodott, hogy jobb minőségűek, mint más betegségek esetében, és alkalmasak a mi populációnkban végzett epidemiológiai vizsgálatokra.28,29 A kórházon kívüli halálos kimenetelű CVE-t nem vettük figyelembe. Különösen az előrehaladott vesebetegségben szenvedő, nem kórházba felvett betegeknél bekövetkezett stroke-eseményeket észlelhettük alul, és ezek valószínűleg súlyosabbak és nagyobb társbetegséggel járó, halálhoz vezető események voltak. A 45 és 80 közötti eGFR-rel rendelkező egyéneknél a stroke-események mintázata hasonló volt a többi CVE esetében tapasztaltakhoz; nem gondoljuk, hogy ez érvényteleníti eredményeinket, mivel az enyhe CKD-re összpontosítottunk. Hatodszor, a modelleket kiigazítottuk a kardiovaszkuláris kockázati tényezők és betegségek, valamint a sztatinterápia és a renin-angiotenzin rendszerhez tartozó gyógyszerek tekintetében, de nem vettük figyelembe az egyéb társbetegségeket, gyógyszereket vagy társadalmi-gazdasági tényezőket, amelyek befolyásolhatják a CVE előfordulását. Végül, nem álltak rendelkezésünkre a halál okára vonatkozó adatok. Az összhalálozás számos olyan etiológiát foglal magában, amelyek nem a vesefunkcióval, hanem más, az életkorral összefüggő betegségekkel, cukorbetegséggel vagy szívelégtelenséggel kapcsolatosak, mint például fertőzések vagy esések. Bár kiigazítottunk néhány ilyen társbetegséget, nem zárhatjuk ki más zavaró tényezők, például a gyengeség jelenlétét.30
KÖVETKEZTETÉSEK
Összefoglalva, a CHD alacsony előfordulási gyakoriságú országban lakó ≥ 60 éveseknél az ACM és bármely CVE kockázatának növekedését figyeltük meg az eGFR csökkenésével mind a 60-74 éves, mind az ≥ 75 éves csoportoknál. A HR-ek azonban szignifikánssá váltak eGFR
FORRÁS
A projektet a Gazdasági és Versenyképességi Minisztérium (Spanyolország) Carlos III Egészségügyi Intézete által a Társadalmi Kihívásokra orientált Nemzeti Kutatási Program keretében az Egészségügyi Stratégiai Akció 2011. évi felhívása keretében elnyert kutatási támogatás támogatta. Ez a program a 2008-2011-es műszaki, tudományos és innovációs kutatási nemzeti terv részét képezi, amelyet az Európai Unió ERFA (Európai Regionális Fejlesztési Alap) forrásaiból társfinanszíroznak (PI11/02220). Gazdasági és Versenyképességi Minisztérium a Carlos III Egészségügyi Intézeten keresztül (Red RedIAPP RD12/0007) és ERFA források Generalitat de Catalunya az AGAUR (A for Management of Universities and Research Grants) (2014 SGR 1225) (2014 SGR 902). M. Grau egy Miguel Servet-ösztöndíj (Carlos III Egészségügyi Intézet, Gazdasági és Versenyképességi Minisztérium, Spanyolország) (PI12/03287) támogatásával készült.
Érdekütközések
L. Pascual-Benito előadási díjat kapott az Altertől. A. Martínez-Castelao a Boëhringer-Ingelheimtől tanácsadási/fizetett tanácsadói díjat kapott, valamint előadási díjat a és Boëhringer-Ingelheimtől.
- –
A
mL/min/1,73 m2 eGFR-rel rendelkező egyének fokozott kardiovaszkuláris kockázatnak vannak kitéve. A csökkent eGFR prevalenciája az életkor előrehaladtával fokozatosan nő, a 80 évesnél idősebbeknél akár az 50%-ot is elérheti. Folyamatos vita folyik az időseknél gyakrabban előforduló enyhébb csökkenések (eGFR 45-59mL/min/1,73 m2) klinikai jelentőségéről. Ráadásul a CHD alacsony előfordulási gyakoriságú területeken végzett vizsgálatok nem vontak be 74 évnél idősebb személyeket, vagy nem szolgáltattak részletes információkat a különböző korcsoportokra vonatkozóan.
- –
Az alacsony kardiovaszkuláris kockázatú országban lakó ≥ 60 éves egyének populációjában az ACM és bármely CVE kockázata fokozatosan nőtt az eGFR csökkenésével, mind a 60-74 évesek, mind a ≥ 75 évesek körében, függetlenül az egyéb kockázati tényezőktől és a kardiovaszkuláris betegségektől. Az idősebb korcsoportban azonban a HR-ek 60 alatti eGFR esetén szignifikánssá váltak. Az eGFR-rel összefüggő halálozási kockázatnövekedés a 60-74 évesek csoportjában magasabb volt, mint a ≥ 75 évesek csoportjában, de a CVE-kockázat tekintetében hasonló volt.