Az izocitrát-dehidrogenáz a következő kémiai reakciókat katalizálja:
Izocitrát + NAD+ ⇌ {\displaystyle \rightleftharpoons }

2-oxoglutarát + CO2 + NADH + H+ Izocitrát + NADP+ ⇌ {\displaystyle \rightleftharpoons }

2-oxoglutarát + CO2 + NADPH + H+
A reakció teljes szabad energiája -8,4 kJ/mol.
LépésekSzerkesztés
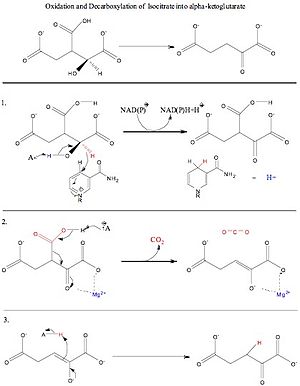
A citromsavciklusban a citrát izomerizációjából keletkező izocitrát oxidáción és dekarboxiláción is átesik. Az izocitrát-dehidrogenáz (IDH) enzim segítségével az izocitrátot a környező arginin, tirozin, aszparagin, szerin, treonin és aszparaginsav aminosavak tartják aktív helyén belül. Az első doboz az izocitrát-dehidrogenáz általános reakcióját mutatja. Az enzimmechanizmus működéséhez szükséges reaktánsok az izocitrát, a NAD+/NADP+ és a Mn2+ vagy Mg2+. A reakció termékei az alfa-ketoglutarát, szén-dioxid és NADH + H+/NADPH + H+. A vízmolekulák segítenek az izocitrát oxigénjeinek (O3) deprotonálásában.
A második doboz az 1. lépés, amely az alfa-C (C#2) oxidációját jelenti. Az oxidáció az első lépés, amelyen az izocitrát keresztülmegy. Ebben a folyamatban az alfa-szén (C#2) alkoholcsoportja deprotonálódik, és az elektronok az alfa-C-hez áramlanak, ketoncsoportot képezve és egy hidridet eltávolítva a C#2-ről, a NAD+/NADP+ mint elektronelfogadó kofaktort használva. Az alfa-C oxidációja lehetővé teszi egy olyan pozíciót, ahol az elektronok (a következő lépésben) a karboxilcsoportról lefelé jönnek, és az elektronokat (a kettős kötésű oxigént létrehozva) visszatolják az oxigénre, vagy egy közeli proton megragadását egy közeli lizin aminosavról.
A harmadik doboz a 2. lépés, amely az oxalosuccinát dekarboxilációja. Ebben a lépésben a karboxilcsoport oxigénjét egy közeli tirozin aminosav deprotonálja, és ezek az elektronok leáramlanak a 2-es szénatomra. A szén-dioxid elhagyja az izocitrát béta-szénjét, mint távozó csoportot, miközben az elektronok az alfa-C keton oxigénjéhez áramlanak, negatív töltést helyezve az alfa-C oxigénjére, és alfa-béta telítetlen kettős kötést képezve a 2. és 3. szénatom között. Az alfa-C oxigén magányos párja felvesz egy protont egy közeli lizin aminosavból.
A negyedik doboz a 3. lépés, amely a 2. és 3. szénatom közötti alfa-béta telítetlen kettős kötés telítését jelenti. A reakciónak ebben a lépésében a lizin deprotonálja az oxigént az alfa-szénről, és az alfa-szén oxigénjén lévő magányos elektronpár lejön, megreformálja a keton kettős kötést, és a magányos párt (az alfa- és béta-szén közötti kettős kötést alkotva) lelöki, felvéve egy protont a közeli tirozin aminosavból. Ez a reakció alfa-ketoglutarát, NADH + H+/NADPH + H+ és CO2 képződését eredményezi.
Részletes mechanizmusSzerkesztés
A Mn2+ izocitrát sertés IDH komplexben két aszpartát aminosavmaradék (balra lent) kölcsönhatásba lép két szomszédos vízmolekulával (w6 és w8), hogy az alkoholt az alfa-szénatomról deprotonálja. Az alfa-C oxidációja is megtörténik ezen a képen, ahol a NAD+ egy hidridet fogad el, ami oxalosuccinátot eredményez. Az alfa-C körüli sp3-ról sp2-re történő sztereokémiai változással együtt az alkoholcsoportból egy ketoncsoport keletkezik. Ennek a ketonos kettős kötésnek a kialakulása lehetővé teszi a rezonancia kialakulását, mivel a kilépő karboxilátcsoportból érkező elektronok a keton felé mozognak.
Az oxalosuccinát dekarboxilációja (középen lent) kulcsfontosságú lépés az alfa-ketoglutarát kialakulásában. Ebben a reakcióban a szomszédos tirozin-hidroxil magányos párja elvonja a protont a karboxilcsoportról. Ezt a karboxilcsoportot az izocitrátmolekula béta-alegységének is nevezik. A karboxilcsoport deprotonálódása hatására a magányos elektronpár lefelé mozog, szén-dioxidot képezve és az oxalosuccinátról leválva. Az elektronok tovább mozognak az alfa-szén felé, felfelé tolva a kettős kötés elektronjait (így keletkezik a keton), hogy elvonjanak egy protont egy szomszédos lizinmaradványtól. A 2. és a 3. szénatom között egy alfa-béta telítetlen kettős kötés jön létre. Amint a képen látható, a zöld ion vagy Mg2+ vagy Mn2+, amely kofaktorként szükséges a reakció lejátszódásához. A fémion a negyedik és ötödik szénatomon lévő oxigénatomokkal (az izocitrát gamma alegységeként is ismert) ionos kölcsönhatások révén kis komplexet képez.
Az oxalosuccinátból a dekarboxilációs lépésben (jobbra lent) a szén-dioxid leválasztása után az enol a keto-ból tautomerizálódik. A keton kettős kötés kialakulását ennek az oxigénnek az alfa-szénről (C#2) történő deprotonálása indítja el ugyanazzal a lizinnel, amely az oxigént először protonálta. A magányos elektronpár lefelé mozog, és a kettős kötést létrehozó magányos párokat kirúgja. Ez a magányos elektronpár elvon egy protont a tirozinból, amely a dekarboxilációs lépésben deprotonálta a karboxilcsoportot. Az ok, amiért azt mondhatjuk, hogy a Lys és Tyr maradékok ugyanazok lesznek az előző lépésből, az az, hogy segítenek az izocitrát molekula megtartásában az enzim aktív helyén. Ez a két maradék képes hidrogénkötéseket kialakítani oda-vissza, amíg elég közel vannak a szubsztráthoz.
 Oxidoreduktáz lépés, ahol a NAD+ segítségével hidridet veszünk fel.
|
 Az oxalosuccinát dekarboxilálása.
|
 Az alfa-béta telítetlen kettős kötés telítése.
|
A fent említett izocitrát-dehidrogenáz enzim alfa-ketoglutarátot, szén-dioxidot és NADH + H+/NADPH + H+-t termel. A reakció során három változás megy végbe. A 2. szénatom oxidációja, a 3. szénatom dekarboxilációja (szén-dioxid elvesztése), és egy ketoncsoport képződése sztereokémiai változással sp3-ról sp2-re.
 |
 A sertés mitokondriális NADP+-függő izocitrát-dehidrogenáz Mn2+ és izocitrát komplexszel. Az aktív centrum zsebének felületi nézete, ahol az izocitrátot poláris aminosavak kötik.
|
 Sertés mitokondriális NADP+-függő izocitrát-dehidrogenáz Mn2+ és izocitráttal komplexálva.
|
 Disznó enzim komplex; Aktív hely izocitrát és szomszédos A.A.
|
Aktív helyEdit
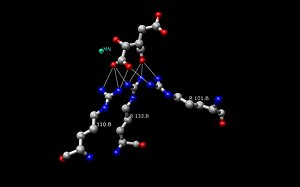
Az Escherichia coli-ban található izocitrát-dehidrogenáz (IDH) enzim szerkezete volt az első olyan szerkezet, amelyet sikerült feltárni és megérteni. Azóta a legtöbb kutató az Escherichia coli IDH szerkezetét használja a többi izocitrát-dehidrogenáz enzimmel való összehasonlításhoz. Sok részletes ismeret áll rendelkezésre erről a bakteriális enzimről, és megállapították, hogy a legtöbb izocitrát-dehidrogenáz szerkezetében és így működésében is hasonló. A szerkezetnek és a funkciónak ez a hasonlósága okot ad arra a feltételezésre, hogy a szerkezetek és az aminosavak is konzerválódtak. Ezért a legtöbb prokarióta izocitrát-dehidrogenáz enzim aktív helyeinek is konzerváltnak kell lenniük, ami a prokarióta enzimeken végzett számos vizsgálat során megfigyelhető. Az eukarióta izocitrát-dehidrogenáz enzimeket viszont még nem fedezték fel teljesen.Az IDH minden dimerjének két aktív helye van. Mindkét aktív hely egy NAD+/NADP+ molekulát és egy kétértékű fémiont (Mg2+,Mn2+) köt meg. Általában minden aktív helynek van egy konzervált aminosav-sorozata minden egyes specifikus kötőhelyhez. A Desulfotalea psychrophila (DpIDH) és a sertés (PcIDH) esetében három szubsztrát kötődik az aktív centrumhoz.
- Az izocitrát az aktív centrumon belül egy körülbelül nyolc aminosavból álló konzervált szekvenciához kötődik hidrogénkötéseken keresztül. Ezek a savak a következők (maradványaikban változhatnak, de hasonló tulajdonságokkal rendelkeznek): tirozin, szerin, aszparagin, arginin, arginin, arginin, tirozin és lizin. Helyzetük a gerincoszlopon változó, de mindannyian közeli tartományban vannak (pl. Arg131 DpIDH és Arg133 PcIDH, Tyr138 DpIDH és Tyr140 PcIDH).
- A fémion (Mg2+, Mn2+) három konzervált aminosavhoz kötődik hidrogénkötéseken keresztül. Ezek az aminosavak három aszpartát-maradékot tartalmaznak.
- A NAD+ és a NADP+ az aktív centrumon belül négy, az IDH enzimek között hasonló tulajdonságokkal rendelkező régióban kötődik. Ezek a régiók eltérőek, de a , , , , és körül vannak. A régiók ismét változnak, de a régiók közelsége konzervált.