- Mitől lesz egy molekula poláris?
- Nézzük meg a szén-dioxid szerkezeti képletét:
- Miért poláris a víz?
A víz azért poláris molekula, mert oxigénje erősen elektronegatív, és mint ilyen, az elektronpárt maga felé húzza (a két hidrogénatomtól távol), így enyhén negatív töltést kap.
A molekula polaritása nemcsak az alkotó atomjaitól függ, hanem attól is, hogy azok hogyan helyezkednek el a központi atom körül, azaz milyen térbeli elrendezésben. Hogy ezt jobban megértsük, tárgyaljuk a témát részletesebben.
Mitől lesz egy molekula poláros?
A molekula polaritása az elektronok egy adott irányba történő eltolódásával függ össze. Ez viszont a molekulában jelenlévő kötések polaritásától függ, mivel ezek a kötések is tartalmaznak elektronokat.
A molekulán belül az az atom, amelyik nagyobb erővel vonzza magához az elektronokat (ill, elektronegatívabb, mint a másik atom) enyhe negatív töltést vesz fel magán, és a két atom közötti kötés polárissá válik.
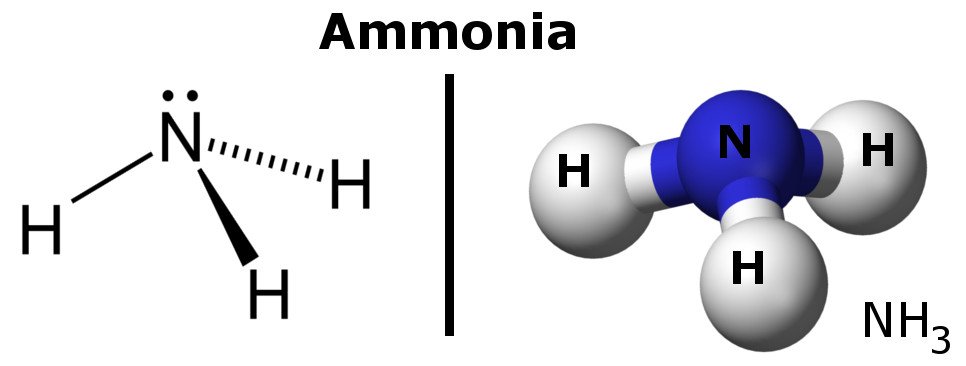
Ammónia poláris molekula, mert enyhén negatív és pozitív töltésű területek vannak benne.
Összességében azt mondhatjuk, hogy egy poláris kötés elektronsűrűsége a kötés egyik vége felé halmozódik fel, aminek következtében az a vége enyhe negatív töltéssel rendelkezik, míg a másik vége enyhe pozitív töltéssel. Ez teszi a molekulát polárrá.
Hasonlóképpen, ha egy molekulában nincsenek pozitív és negatív töltésű területek, akkor azt nem polárnak tekintjük.
Egy érdekes dolog azonban, hogy minél nagyobb az elektronegativitáskülönbség, annál polárisabb lesz a kötés egy molekulán belül. A karbonilvegyületek azért polárisak, mert a karbonilszén kissé pozitív. Tehát a szén-dioxidnak, amely egy pozitív szénatomot és két részben negatív oxigént tartalmaz, nem kellene polárisnak lennie?
Nos, a szén-dioxid két oxigénatomból áll, amelyek egy szénatomhoz kapcsolódnak. Az oxigénatomok sokkal elektronegatívabbak, mint a szénatomok, és mint ilyeneknek részben negatív töltéssel kell rendelkezniük, míg a szénatomnak enyhén pozitív töltésűnek kell lennie. Érdekes módon azonban ez nem így történik.
Vessünk egy pillantást a szén-dioxid szerkezeti képletére:
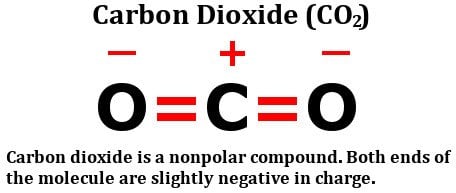
Két egyformán elektronegatív oxigénatomból áll, igen, de nézzük meg, hogyan helyezkednek el ezek az atomok a szénatom körül. Mindkettő tökéletes, 180 fokos szögben áll a szénnel szemben. Következésképpen egyenlő erővel, ellentétes irányba húzzák el az elektronsűrűséget a szénből. A végeredmény az, hogy a szénatomon lévő elektronsűrűség változatlan marad, ami a szén-dioxid molekulát nem teszi polárissá.
A szén-dioxid remek példa arra, hogy egy molekula geometriája döntő szerepet játszik abban, hogy poláris vagy nem poláris legyen. Most nézzünk meg egy vízmolekulát:
Miért poláros a víz?
A víz kémiai képlete H20, ami azt jelenti, hogy két hidrogénatomot és egy oxigénatomot tartalmaz. A hidrogénatomok héjában csak egy elektron van, míg az oxigénatomnak 6 valenciaelektronja van.
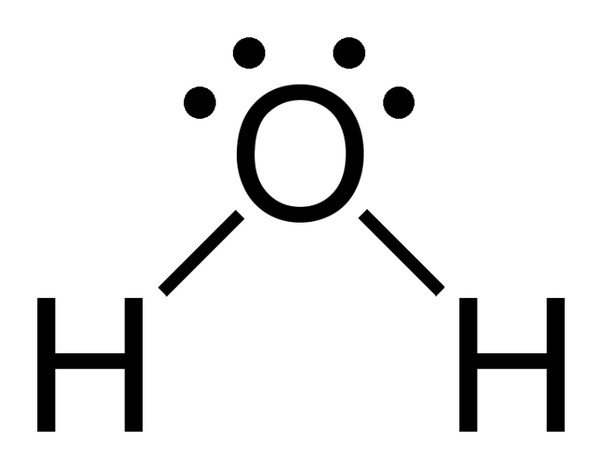
Megjegyezzük, hogy a víz oxigénatomján 2 magányos elektronpár található.
Mivel az oxigénnek 6 elektron van a valenciahéjában, ezért minden hidrogénatommal megoszt egy-egy elektront. Így a 2 pályáján 4 nem kötött elektron marad. Ezek a kötött és nem kötött elektronpárok tetraéder alakban helyezkednek el az oxigén körül, ezért tűnik a két kötés hajlított alakúnak.
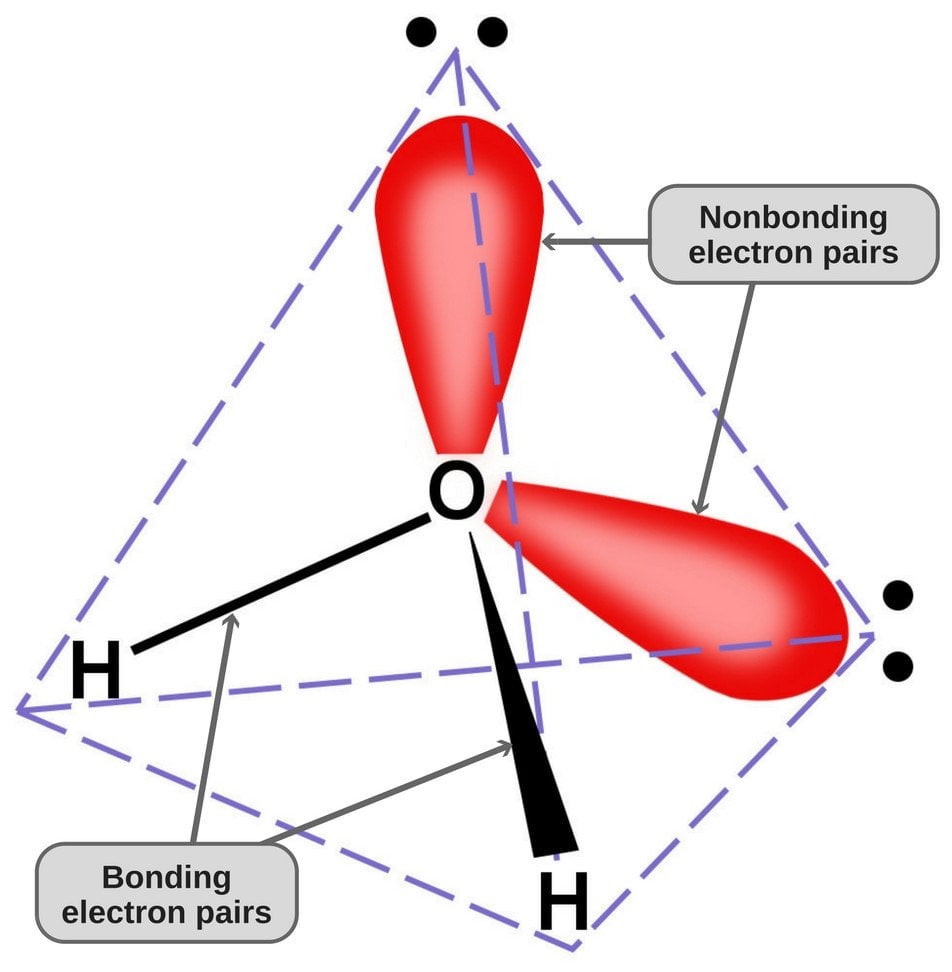
A vízmolekula tetraéderes geometriája.
Az oxigén- és a hidrogénatomok elektronegativitása eltérő (a hidrogén elektronegativitási értéke 2,1, míg az oxigén elektronegativitása 3,5); ezért mindkét kötés poláris. Mivel az oxigén elektronegatívabb, mint a hidrogén, az elektronsűrűség mindkét kötésben az oxigén felé tolódik el, ezáltal az oxigén körüli terület negatívabbá válik, mint a két hidrogénatom körüli területek.
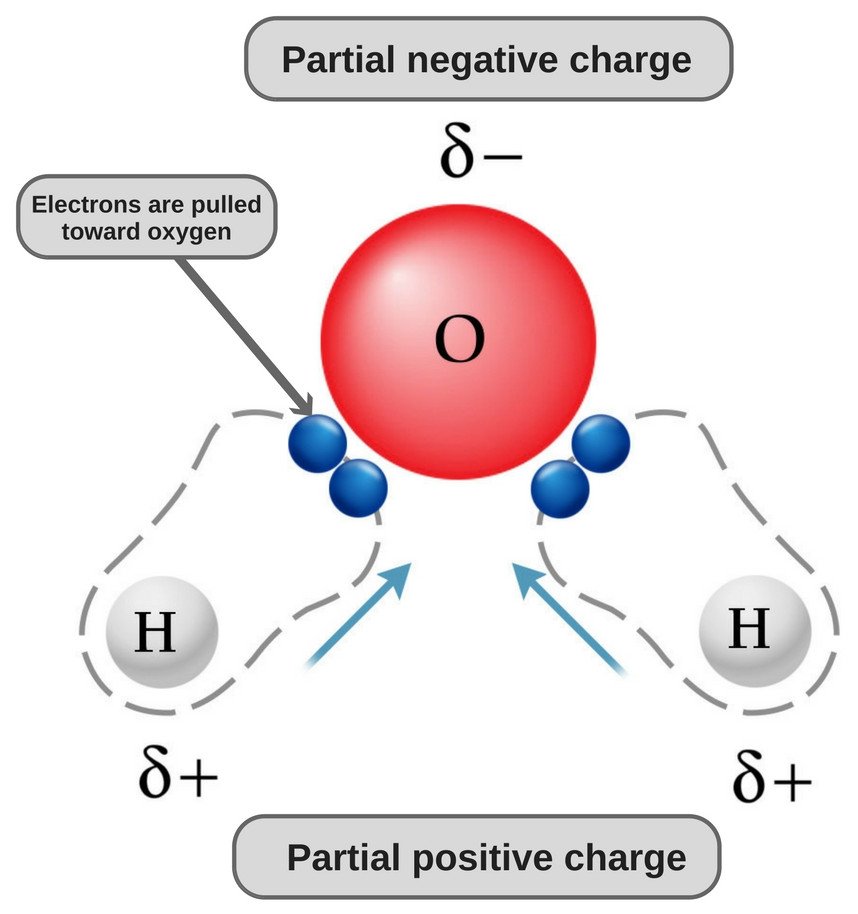
Ezért válik a vízmolekula polárrá!