Bevezetés
A krónikus vesebetegség (CKD) magas, különösen kardiovaszkuláris eredetű halálozással jár. Ugyanakkor paradoxon, hogy e betegek esetében a mortalitás és a hagyományos kardiovaszkuláris rizikófaktorok közötti korlátozott összefüggés paradoxon. Csak néhány gyulladással vagy táplálkozással kapcsolatos marker (pl. a C-reaktív fehérje és a szérumalbumin) bizonyult a CKD-ben a halálozás következetes előrejelzőjének.1
Az utóbbi években néhány megfigyeléses vizsgálat összefüggést mutatott ki a szérum emelkedett teljes alkalikus foszfatáz (ALP) koncentrációja és a CKD-s betegek halálozása között2-5; ennek az eredménynek a biológiai és klinikai jelentősége azonban továbbra sem ismert.
A gamma-glutamil transzferáz (GGT) egy enzim, amely a szérumban és a különböző szervek, például a máj, a hasnyálmirigy, a bél, a tüdő és a vese sejtjeinek külső felületén van jelen.6 A szérum GGT nemcsak az alkoholfogyasztás és a hepatobiliáris betegségek hagyományos markere, hanem számos tanulmány kimutatta az összefüggést az emelkedett szérum GGT-szint és a szív- és érrendszeri betegségek, a diabetes mellitus, a magas vérnyomás és a metabolikus szindróma között is.7
A GGT-szint a mortalitás előrejelzője az általános populációban, sőt, ezt az enzimet nemrégiben a mortalitást előrejelző biokémiai paraméterek közé sorolták.8 Továbbá a szérum GGT-szint segíthet a tisztázatlan eredetű magas ALP-értékek értelmezésében.
A szérum GGT klinikai és prognosztikai jelentőségét CKD-ben csak kevés tanulmány elemezte.9,10 E tanulmány célja az volt, hogy megvizsgálja a kórosan emelkedett szérum GGT-szintű CKD-s betegek klinikai jellemzőit és az ALP-vel való kölcsönhatását, valamint meghatározza e paraméter értékét a mortalitás előrejelzőjeként.
Anyagok és módszerek
Ez egy retrospektív, megfigyeléses vizsgálat, amelyet egy olyan felnőtt betegekből álló kohorszon végeztünk, akiket 2002 januárjától 2013 októberéig a spanyolországi Badajozban található Infanta Cristina Kórház nefrológiai osztályának alacsony tisztaságú (előrehaladott CKD) járóbeteg-ambulanciáján követtek. A vizsgálatba minden >18 éves,
mL/min/1,73m2 becsült glomeruláris filtrációs ráta (eGFR) mL/min/1,73m2 értékű, dialízis előtt álló beteget bevontak. A vesetranszplantációs diszfunkció miatt CKD-ben szenvedő betegeket nem vonták be a vizsgálatba.
A demográfiai adatokat és a klinikai paramétereket, mint például életkor, nem, testtömegindex (BMI), társbetegségek és gyógyszeres kezelés, a felvételkor rögzítették.
A komorbiditást a Davies-pontszám11 segítségével értékelték, és a betegeket a különböző társbetegségek összessége szerint osztályozták: nincs társbetegség, enyhe-közepes (1 vagy 2 társbeteg folyamat) vagy súlyos (3 vagy több társbeteg folyamat). A legfontosabb nyilvántartott társbetegségek a következők voltak: cukorbetegség, szívelégtelenség, koszorúér-betegség, cerebrovaszkuláris vagy perifériás érbetegség, krónikus obstruktív tüdőbetegség, rák és krónikus gyulladásos folyamatok.
A jelen vizsgálatban a “májbetegség” kifejezés nemcsak a krónikus májbetegséggel, májzsugorral vagy májátültetéssel diagnosztizált betegeket foglalta magában, hanem az aktív alkoholizmusban vagy aktív hepatotróp (B vagy C) vírusfertőzésben szenvedő betegeket is. A nem alkoholos steatohepatitis (zsírmájbetegség) gyakori ultrahanglelet volt ezeknél a betegeknél, bár ez a betegség nem szerepelt a májbetegségek listáján.
A betegeket a vizsgálatba való bekerüléstől kezdve rendszeresen nyomon követték halálukig, veseátültetésig, a követés elvesztéséig vagy az adatgyűjtési időszak végéig (2014. december 31.).
A vizsgálat retrospektív felépítése miatt egyéni beleegyezést nem kértek.
Biokémiai mérések
2002 januárjától kezdődően a szérum GGT és az összes ALP is bekerült a rutinszerűen mért biokémiai paraméterek közé az előrehaladott CKD-klinikánk betegeinél.
A GGT-szintet autoanalizátorral (Advia Chemistry, Siemens Healthcare Diagnostics, New York, USA) határoztuk meg kinetikus kolorimetriás módszerrel gamma-glutamil-3-karboxi-4-nitroaniliddal és glicilglicinnel. A variációs koefficiens kevesebb, mint 4,5%, a referenciatartomány 0-36U/L.
A szérum ALP-szintjét szintén autoanalizátorral (Advia Chemistry) mértük, az ALPI módszerrel, amely a p-nitrofenilfoszfát p-nitrofenollá történő transzfoszforilációjának mérésével számszerűsíti az alkalinin-foszfatáz aktivitást 2-amino-2-metil-1-propanol jelenlétében. A variációs koefficiens kevesebb mint 4%, a referenciatartomány pedig 45-120U/L.
A kórosan emelkedett szérum GGT-vel vagy ALP-vel rendelkező betegek jellemzésére a vizsgálatba bevonták a kiindulási hematológiai és biokémiai paramétereket is (lásd az 1. táblázatot). A biokémiai paramétereket hagyományos laboratóriumi módszerekkel határozták meg (Advia Chemistry, New York, USA). A parathormon (molekula 7-84) (PTH) szintjét automatizált kemilumineszcens immunpróbával (DiaSorin, Olaszország), a szérum albumin koncentrációját bromokrezol zöld módszerrel, a nagy érzékenységű C-reaktív fehérjét pedig szilárd fázisú kemilumineszcens enzim immunpróbával (Immulite autoanalizátor, Diagnostic Product Corporation, New York, USA) határozták meg.
A betegcsoport klinikai és biokémiai jellemzői és alcsoportjai a kórosan magas GGT- vagy ALP-értékek szerint.
| Teljes | Normális GGT és ALP | magas. GGT | Magas ALP | Egyidejűleg magas GGT és ALP | P* | ||
|---|---|---|---|---|---|---|---|
| N betegek | 909 | 596 | 141 | 104 | 68 | ||
| Életkor (év) | 65 (15) | 66 (15) | 63 (13) | 66 (17) | 66 (14) | 0.234 | |
| Nem, férfi/nő | 485/424 | 316/280 | 81/60 | 46/58 | 42/26 | 0.094 | |
| Komorbiditási index % | |||||||
| Nincs | 31 | 37 | 21 | 29 | 9 | ||
| Mild.mérsékelt | 52 | 48 | 63 | 59 | 54 | ||
| Súlyos. | 17 | 15 | 16 | 12 | 37 | ||
| Aktív dohányosok, % | 15 | 14 | 21 | 10 | 25 | 0.011 | |
| Diabetes mellitus, % | 39 | 35 | 46 | 41 | 50 | 0.013 | |
| Májbetegség, % | 3 | 2 | 6 | 2 | 10 | ||
| Ischaemiás szívbetegség, % | 16 | 14 | 10 | 16 | 38 | ||
| CNS vagy perifériás ischaemia, % | 21 | 19 | 18 | 23 | 34 | 0.031 | |
| Szívelégtelenség, % | 18 | 16 | 21 | 14 | 37 | ||
| BMI, kg/m2 | 29.4 (6) | 29.2 (5.8) | 29.4 (6) | 30.6 (6.7) | 29.4 (5.9) | 0.176 | |
| eGFR, ml/perc/1.73 m2 | 14.7 (5.1) | 14.8 (5.1) | 14.6 (4.6) | 14.1 (4.4) | 15.6 (6.2) | 0.234 | |
| Hemoglobin (g/dl) | 11.4 (1.7) | 11.4 (1.7) | 11.1 (1.7) | 11.4 (1.5) | 11.6 (1.8) | 0.205 | |
| Szérum húgysav, mg/dl | 7,6 (1,9) | 7,5 (1,9) | 7,9 (2.1) | 7.5 (1.7) | 8.4 (2.4)a | ||
| Összes koleszterin, mg/dl | 186 (49) | 187 (48) | 191 (56) | 179 (42) | 182 (50) | 0.226 | |
| Trigliceridek, mg/dl | 147 (96) | 140 (76) | 167 (133)b | 140 (70) | 171 (163) | 0.003 | |
| Szérum albumin, g/dl | 3.9 (0.5) | 3.9 (0.5) | 3.8 (0.5) | 3.9 (0.5) | 3.8 (0.5) | 0.151 | |
| Szérum összkalcium, mg/dl | 9,1 (0,8) | 9,2 (0.9) | 9.2 (0.7) | 9 (0.9) | 8.9 (0.8) | 0.049 | |
| Szérum foszfor, mg/dl | 4,7 (1,1) | 4,7 (1) | 4,7 (0,9) | 4,6 (1.2) | 4,6 (1,2) | 0,851 | |
| Szérum bikarbonát, mEq/L | 21,4 (3.9) | 21.6 (3.8) | 21.2 (3.7) | 20.5 (4.4) | 22.1 (4.5) | 0.026 | |
| PTH, pg/ml | 267 (220) | 241 (187) | 234 (184) | 448 (337)c | 281 (195) | ||
| ALT, IU/L | 18 (16) | 16 (8) | 25 (23)d | 15 (6) | 30 (39)d | ||
| GGT, IU/L | 36 (63) | 18 (8) | 69 (39)d | 19 (8) | 142 (181)d | ||
| ALP, IU/L | 99 (52) | 79 (20) | 89 (21) | 163 (67)e | 187 (88)e | ||
| Szérum ferritin, ng/mLg | 173 (247) | 148 (179) | 284 (361)d | 112 (118) | 271 (465)d | ||
| C-reaktív fehérje, mg/L | 9.9 (17.3) | 8.5 (15.6) | 14.6 (22.2)f | 6.9 (9.4) | 17.8 (24.2)f | ||
| Proteinuria, mg/g kreatinin | 2462(2787) | 2227(2632) | 2726(3035) | 3023(3314) | 3109(2473) | 0.004 | |
| Renin-angiotenzin gátlók, % | 79 | 80 | 78 | 78 | 72 | 0.502 | |
| Béta-blokkolók, % | 26 | 25 | 30 | 22 | 35 | 0.140 | |
| Diuretikumok, % | 60 | 59 | 62 | 60 | 65 | 0.829 | |
| Statinok, % | 53 | 54 | 53 | 55 | 47 | 0.762 | |
| Alopurinol, % | 22 | 22 | 25 | 26 | 13 | 0.200 | |
| D-vitamin analógok, % | 10 | 10 | 7 | 15 | 9 | 0.201 | |
| Trombocitaggregáció-gátlók, % | 34 | 33 | 28 | 41 | 38 | 0.124 | |
Az adatok átlagban (szórással) vannak megadva, hacsak nincs másképp megadva.
ANOVA vagy χ2 a csoportok között.
P0.05 magas GGT-ALP vs. normál GGT-ALP vagy magas ALP, Scheffé-teszt.
P0.05 magas GGT vs. normál GGT-ALP, Scheffé-teszt.
P0.0001 magas ALP vs. magas ALP. minden más alcsoport, Scheffé-teszt.
P0.0001 magas GGT vagy magas GGT-ALP vs. normál GGT-ALP vagy magas ALP, Scheffé-teszt.
P0.0001 magas ALP vagy magas GGT-ALP vs. magas GGT-ALP. normál GGT-ALP vagy magas GGT, Scheffé-teszt.
P0,001 magas GGT vagy magas GGT-ALP vs. normál GGT-ALP vagy magas ALP, Scheffé-teszt.
845 betegről állnak rendelkezésre adatok.
A glomeruláris filtrációs ráta (eGFR) becslésére az MDRD-4 képletet használták.12
A szérumferritin volt az egyetlen paraméter, amelynek értékei hiányoztak. A rendelkezésre álló értékek átlagát bevonták a leíró elemzésbe, de a hiányzó értékeket nem számították ki, és ezt a változót nem vették fel kovariábilisnak a túlélési elemzésbe.
Kimeneti változó
A kimeneti változó a bármilyen okból bekövetkező halál volt. A halál okait 5 csoportba soroltuk: hirtelen halál, kardiovaszkuláris, fertőző, rosszindulatú és egyéb okok.
Statisztikai elemzés
A folyamatos változók leíró összehasonlítására a jellemzőiktől függően parametrikus vagy nem parametrikus teszteket használtunk, a kategorikus változók esetében pedig a Chi-négyzet tesztet. A Pearson-tesztet a kétváltozós korrelációs elemzéshez használták.
A betegek közötti túlélési különbségeket a GGT- vagy ALP-kvartilisek szerint Kaplan-Meier-görbék segítségével elemezték, és a Mantel-Haenszel log-rank-teszt segítségével hasonlították össze.
Multivariáns Cox-féle arányos kockázati modellekkel elemezték a kiindulási GGT- és ALP-értékek hatását a teljes halálozásig eltelt időre.
Mivel a kiindulási GGT- és ALP-szintek pozitívan torzított eloszlást mutattak, az értékeket logaritmikusan átalakították a folyamatos változóként való felvételhez.
A különböző felvételi időszakok figyelembevétele érdekében a többváltozós modelleket a felvételi időszakoknak (2002-2005, 2006-2009, 2010-2014) megfelelő kategorikus változóval is kiigazítottuk.
A GGT-t és az ALP-t folyamatos változóként (logaritmikus transzformáció) és kategorikus változóként elemeztük: felső kvartilis és kórosan magas értékek (GGT>36IU/L és ALP>120IU/L).
A következő regressziós modelleket vettük figyelembe: (1) Univariáns. (2). Életkor, nem, komorbiditási pontszám, cukorbetegség, májbetegség, aktív dohányos, BMI, kiindulási eGFR és felvételi időszak szerint korrigálva. (3) A 2. modellben szereplő változókkal, valamint a teljes szérum kalcium-, foszfor-, PTH-, albumin-, C-reaktív fehérje-, triglicerid-, húgysav- és alanin-aminotranszferáz (ALT) szintekkel korrigálva. (4) A legjobb illeszkedésű modell a visszafelé irányuló feltételes, lépésenkénti eliminációs eljárás alkalmazásával.
Az arányos veszélyek feltételezését log-mínusz log görbék és Schöenfeld reziduumok segítségével teszteltük minden egyes változóra. A betegeket a halál, a követés elvesztése, a veseátültetés vagy a követés végén (2014. december 31.) cenzorálták, attól függően, hogy melyik következett be előbb.
A leíró adatokat folyamatos változók esetében átlag és szórás, illetve medián és interkvartilis tartomány, kategorikus változók esetében pedig abszolút értékek és százalékos arányok formájában adtuk meg. A p-érték
EredményekBetegek jellemzői
A vizsgálati csoportba 909, 4. vagy 5. CKD-stádiumú, dialízis előtt álló beteg tartozott (átlagos eGFR 14,7±5,1mL/min/1,73m2). Az átlagéletkor (±SD) 65±15 év volt, és a betegek 53%-a férfi volt. Valamennyien kaukázusiak voltak. A klinikai és biokémiai alapjellemzőket az 1. táblázat tartalmazza.
A betegek klinikai és biokémiai jellemzőinek a kórosan magas GGT- vagy ALP-szintek jelenléte szerinti elemzéséhez a betegeket négy alcsoportba osztották (1. táblázat): normál GGT- és ALP-szint (a betegek 66%-a), magas GGT-, de normál ALP-szint (16%), normál GGT, de magas ALP (11%) és egyszerre magas GGT és ALP (7%).
Így 209 (23%) és 172 (19%) betegnél volt kórosan magas a kiindulási GGT-, illetve ALP-szint. A GGT és az ALP felső kvartilis értéke 34IU/L, illetve 112IU/L volt.
Az alcsoportok között nem volt jelentős különbség az átlagéletkor és a nemi megoszlás tekintetében. A komorbiditási pontszám és az aktív dohányosok aránya jelentősen magasabb volt a magas GGT-értékkel rendelkező betegeknél, különösen az egyidejűleg magas GGT- és ALP-értékkel rendelkező csoportban (1. táblázat).
A májbetegségek ritka társbetegségek voltak ebben a betegcsoportban. A magas GGT-szintű betegek mintegy 8%-ánál azonban májbetegséget diagnosztizáltak.
A kardiovaszkuláris betegségek előfordulási gyakorisága a magas GGT- vagy magas ALP-értékkel rendelkező betegeknél hasonló volt, mint a normális GGT- és ALP-értékkel rendelkező betegeknél, azonban a kardiovaszkuláris betegségek ezen előfordulási gyakorisága jelentősen megnőtt az egyidejűleg magas GGT- és ALP-értékkel rendelkező betegeknél.
A biokémiai paraméterekben az alcsoportok között szignifikáns különbségeket figyeltek meg (1. táblázat). A magas GGT-szintű betegeknél magasabb volt a húgysav, a trigliceridek, az ALT, a ferritin és a CRP szérumkoncentrációja, mint a normális GGT- és ALP-szintű vagy csak a magas ALP-szintű betegeknél. A csak magas ALP-t tartalmazó betegek alcsoportjában magasabb volt a PTH-szint. Az átlagos kiindulási albuminértékek hasonlóak voltak az alcsoportok között.
Ezeket a GGT-vel vagy ALP-vel összefüggő biokémiai mintákat megerősítette a bivariáns korrelációs elemzés (2. táblázat).
A biokémiai paraméterek közötti korrelációs koefficiensek.
| Log GGTa | Log ALPb | Haemoglobin | Hámsav | Héjsav | Trigliceridek | ALT | Foszfor | Kalcium | Ferritin | Albumin | PTH | C-reaktív fehérje | eGFR | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Log GGTa | ||||||||||||||||
| Log ALPb | 0.337** | |||||||||||||||
| Haemoglobin | -0.001 | 0.029 | ||||||||||||||
| Hámsav | 0.162** | 0.051 | 0.068* | |||||||||||||
| Trigliceridek | 0.164** | 0.011 | 0.063 | 0.083* | ||||||||||||
| ALT | 0.387** | 0.107** | 0.002 | 0.093** | 0.043 | |||||||||||
| Foszfor | -0.013 | 0.024 | -0.092* | 0.075* | 0.020 | 0.026 | ||||||||||
| Kalcium | 0.019 | -0.105** | 0.161** | 0.034 | 0.127** | 0.014 | -0.178** | |||||||||
| Ferritin | 0.244** | 0.050 | -0.149** | 0.054 | 0.059 | 0.195** | -0.037 | -0.043 | ||||||||
| Albumin | -0.072* | -0.074* | 0.208** | -0.004 | 0.029 | 0.009 | -0.097** | 0.317** | -0.112** | |||||||
| PTH | -0.055 | 0.296** | -0.060 | 0.066* | -0.025 | -0.042 | 0.244** | -0.168** | -0.100** | 0,072* | ||||||
| C-reaktív fehérje | 0,197** | 0.088** | -0.190** | 0.076* | 0.005 | 0.021 | -0.048 | -0.055 | 0.238** | -0.233** | -0.077* | |||||
| eGFR | 0.080* | -0.028 | 0.163** | 0.008 | -0.015 | 0.003 | -0.555** | 0.136** | 0.044 | 0.012 | -0.268** | 0.054 | ||||
| Proteinuria | 0.098* | 0.131** | -0.055 | -0.081* | 0.161** | 0.077* | 0.207** | -0.250** | 0.005 | -0.534** | 0.065 | 0.005 | -0.158** |
P0.05.
P0.01.
Log-transzformált gamma-glutamil transzferáz.
Log-transzformált alkalikus foszfatáz.
Mortalitás és egyéb érdekes események
A vizsgálati időszak alatt összesen 365 beteg (40%) halt meg, a betegcsoport medián túlélése 74 hónap volt (3. táblázat). A várakozásoknak megfelelően a leggyakoribb halálozási okok a kardiovaszkuláris és a fertőzések voltak, az alcsoportok között nem volt jelentős különbség (3. táblázat).
Mortalitás és egyéb érdekes kimeneti változók a csoport egészében és a GGT és az alkalikus foszfatáz (ALP) szerinti alcsoportokban.
| összesen | Normális GGT és ALP | magas GGT. | Magas ALP | Egyidejűleg magas GGT és ALP | ||
|---|---|---|---|---|---|---|
| Medián túlélési idő , hónap | 74 | 86 | 61 | 82 | 38 | |
| Halálozás, N (%) | 365 (40) | 219 (37) | 61 (43) | 46 (44) | 39 (57) | |
| A halál oka, N (%): | ||||||
| Hirtelen | 58 (16) | 34 (16) | 13 (21) | 5 (11) | 6 (15) | |
| Szív- és érrendszeri | 137 (38) | 82 (37) | 17 (28) | 23 (50) | 15 (39) | |
| Fertőző | 53 (14) | 32 (15) | 9 (15) | 10 (22) | 2 (5) | |
| Rosszindulatú | 38 (10) | 24 (11) | 7 (11) | 1 (2) | 6 (15) | 6 (15) |
| Egyéb | 79 (22) | 47 (21) | 15 (25) | 7 (15) | 10 (26) | |
| Dialízis, N (%) | 526 (58) | 346 (58) | 80 (57) | 67 (64) | 33 (48) | |
| Veseátültetés, N (%) | 133 (15) | 92 (15) | 20 (14) | 16 (15) | 5 (7) | |
| Elveszett a követésben, N (%) | 71 (8) | 49 (8) | 14 (10) | 6 (6) | 2 (3) | |
A követési időszak alatt, a betegek 58%-ának dialízist kellett kezdenie, 15%-uk pedig veseátültetésben részesült (nem volt megelőző transzplantáció). Sem az alcsoportok között, sem a dialízist megkezdő, a transzplantáción átesett vagy a követésből kimaradt betegek százalékos arányában nem volt különbség (3. táblázat).
A gamma-glutamil-transzferáz és az alkalikus foszfatáz mint a túlélés meghatározói
Az 1. és 2. ábra a Kaplan-Meier-túlélési görbéket mutatja a GGT-, illetve az ALP-értékek gyakorisági eloszlásának kvartilisei szerint. A magas GGT- vagy ALP-szintű betegeknél (felső kvartilisek) rosszabb volt a túlélés.
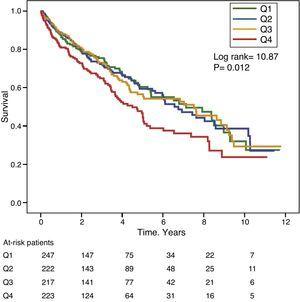
Kaplan-Meier túlélési görbék a szérum GGT-szintek gyakorisági eloszlásának kvartilisei szerint (Q, kvartilisek).
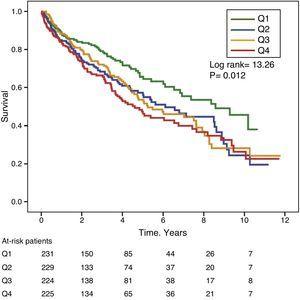
Kaplan-Meier túlélési görbék a szérum ALP-szintek gyakorisági eloszlásának kvartilisei szerint. (Q=kvartilisek).
A Cox-regressziós modellek alapján a GGT mint folytonos vagy kategorikus változó (felső kvartilis vagy szérumérték >36IU/L) szignifikánsan összefüggött a fokozott halálozással az elemzett modellekben (4. táblázat). Az ALP szintén szignifikánsan és függetlenül társult a mortalitás növekedéséhez minden elemzett modellben, kivéve, ha az ALP a legjobb illeszkedésű modellben a felső kvartilis értékeként meghatározott kategorikus változóként szerepelt. Ebben a modellben az ALP és a halálozás közötti kapcsolat mértéke nem érte el a statisztikai szignifikanciát (P=0,052) (4. táblázat).
Cox-regressziós modellek a halálozással való kapcsolatról.
| Változó | Univariate HR (95% CI) | Multivariate model 1a HR (95% CI) | Multivariate model 1a HR (95% CI) | Multivariate model 1a HR (95% CI) CI) | Multivariáns modell 2b HR (95% CI) | Multivariáns modell 3c HR (95% CI) |
|---|---|---|---|---|---|---|
| Log-transzformált GGT | 1.310 (1,154-1,489) P0,0001 |
1,260 (1,095-1,449) P0,0001 |
1,174 (1,005-1,371) P=0.042 |
1.166 (1.010-1.347) P=0.036 |
||
| GGT felső kvartilis | 1.459 (1.163-1.829) P=0.001 |
1.415 (1.119-1.829) P=0.001 |
1.415 (1.119-1.788) P=0,004 |
1,329 (1,036-1,705) P=0,025 |
1,315 (1,064-1,714) P=0,013 |
|
| GGT>36IU/L | 1.513 (1.202-1.905) P0.0001 |
1.509 (1.185-1.923) P=0.001 |
1.393 (1.078-1.800) P=0.011 |
1.390 (1.089-1.779) P=0.009 |
||
| Log-transzformált ALP | 1.635 (1.278-2.093) P0.0001 |
1.479 (1.149-1.904) P=0.002 |
1.395 (1.061-1.833) P=0.017 |
1.327 (1.008-1.746) P=0.044 |
||
| ALP felső kvartilis | 1.332 (1.062-1.670) P=0.013 |
1.288 (1,023-1,621) P=0,031 |
1,277 (1,001-1,630) P=0,049 |
1,261 (0,998-1,594) P=0,052 |
||
| ALP>120IU/L | 1.527 (1.197-1.947) P=0.001 |
1.419 (1.109-1.815) P=0.005 |
1.362 (1.048-1.770) P=0.021 |
1.305 (1.015-1.678) P=0.038 |
Kor, nem, komorbiditási index, cukorbetegség, dohányzás, májbetegség, BMI, eGFR és vizsgálati időszakok figyelembevételével kiigazítva.
Az 1. modell összes kovariánsával, valamint kalciummal, foszforral, PTH-val, húgysavval, trigliceridekkel, ALT-vel, albuminnal és C-reaktív fehérjével korrigálva.
A legjobb illeszkedésű modell, amely tartalmazza az 1. és 2. modell összes változóját, valamint a GGT-t vagy az ALP-t, automatikus változóválasztási eljárással.
A magas GGT-szintű (>36IU/L) betegek halálozásának kockázati aránya (HR) hasonló volt a magas ALP-szintű (>120IU/L) betegeknél megfigyelthez (HR=1,31) a teljesen kiigazított modellben (4. táblázat). A 3. ábra a Kaplan-Meier-túlélési görbéket mutatja, amelyek ezt az összefüggést, valamint az egyidejűleg magas GGT és ALP additív hatását a csökkent túlélésre szemléltetik.
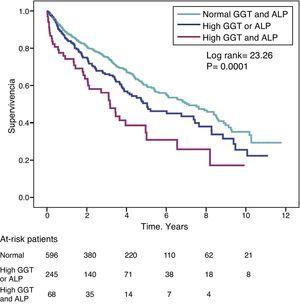
Kaplan-Meier túlélési görbék a vizsgált betegeknél a normális GGT- és ALP-szintek, a kórosan magas GGT- vagy ALP-szint (egyik vagy másik) és az egyidejűleg magas GGT- és ALP-szintek szerint.
A májkomorbiditásnak a GGT és az ALP és a halálozás közötti összefüggésre gyakorolt esetleges zavaró hatásának értékelésére Cox-regressziós modellt állítottunk fel, 27, korábban májbetegséggel diagnosztizált beteg kizárásával. Ebben az illesztett modellben a magas GGT (>36IU/L) statisztikailag szignifikáns kapcsolatot tartott fenn a halálozással (HR=1,316; 95% CI: 1,016-1,705; P=0,03), míg a magas ALP (>120IU/L) a statisztikai szignifikancia határán mutatott összefüggést (HR=1,296; 95% CI: 0,999-1,680; P=0,05).
Diszkusszió
A jelen vizsgálat eredményei azt mutatják, hogy a szérum GGT vagy ALP emelkedett szintje függetlenül összefügg a CKD-s betegek magasabb halálozásával. Ez a vizsgálat azt is első ízben mutatja, hogy a két paraméter egyidejű emelkedése additív hatással van a mortalitás előrejelzésére, még a májbetegséggel nem rendelkező betegek esetében is.
Ebben a vizsgálatban a CKD-s és magas GGT-szintű betegeknél nagyobb volt a társbetegség, különösen a cukorbetegség és a szívelégtelenség, valamint a metabolikus szindrómában megfigyelthez hasonló biokémiai profil, bár a BMI ebben az alcsoportban nem különbözött a többi vizsgált betegétől.
Az ALP szervezetben ubiquitásának köszönhetően az enzim magas szérumszintje különböző patológiai folyamatok kifejezője lehet. Ebben az értelemben a specifikus ALP izoenzimek meghatározása hasznos lehet az eredet megkülönböztetésében olyan esetekben, amikor az izolált emelkedés nem tulajdonítható a csontok fokozott átalakulásának.
A CKD-s és magas ALP-szintű betegeknél jelentett többletmortalitást ellentmondásosan a csont-ásványi anyagcsere nagyon súlyos kontrollhiányából eredő lehetséges kardiovaszkuláris káros hatásoknak tulajdonították.2,3,13,14. Számos patogén mechanizmust javasoltak ennek az összefüggésnek a magyarázatára, beleértve a fokozott érelmeszesedést az artériák falában történő pirofoszfát-hidrolízis révén,15 a szisztémás gyulladást16,17 és a D-vitamin-hiányt18. Azonban az ALP csontból származó izoenzimének (csontspecifikus ALP) szérumszintje és a CKD-s betegek mortalitása közötti szignifikáns összefüggés hiánya19 komoly kétségeket vet fel a csont-ásványi anyagcserével való patogén kapcsolatra vonatkozó hipotézissel kapcsolatban.
Ebben a vizsgálatban a betegek 11%-ának emelkedett ALP-szintje volt normális GGT-szint mellett, és ennek az alcsoportnak a fő jellemzője a magas átlagos PTH-szint volt, ami arra utal, hogy a csont lehet az ALP emelkedésének az oka. Az egyidejűleg magas ALP és GGT azonban a betegek egy olyan alcsoportját jellemezte, amely nagyobb fokú társbetegséggel, főként szív- és érrendszeri betegségekkel rendelkezett, és biokémiai profilja jobban hasonlított a csak magas GGT-vel rendelkező betegekéhez, mint a csak magas ALP-vel rendelkező betegekéhez. Így a magas GGT-szint megléte vagy hiánya alapján két kockázati profil különböztethető meg a CKD-ben és magas ALP-ben szenvedő betegeknél. Míg a magas ALP önmagában mérsékelt halálozási kockázattal járt, addig a két enzim egyidejű emelkedése magasabb halálozási kockázattal járt.
A GGT az extracelluláris redukált glutation (GSH), az emlősök egyik fő intracelluláris antioxidánsának hidrolíziséért felelős enzim, amely lehetővé teszi, hogy a prekurzor aminosavak később új intracelluláris GSH-szintézishez használhatók legyenek.6 Így a megnövekedett GGT az intracelluláris GSH-kimerülés kifejeződése, és ezért a GGT az oxidatív stressz markerének tekinthető.6
A szérum GGT az általános populációban kardiometabolikus biomarkernek bizonyult. Különböző tanulmányok szignifikáns, független összefüggést találtak a GGT-szint és mind a kardiovaszkuláris, mind az összmortalitás között.20-22 A magas GGT-szintek összefüggést mutattak a koszorúér-betegség és a szívelégtelenség rosszabb prognózisával.23,24. Megfigyelték a GGT lehetséges patogenetikai szerepét az ateroszklerotikus plakkok kialakulásában, eróziójában és későbbi ruptúrájában is,25 ami biológiai szempontból magyarázatot adhat a kardiovaszkuláris morbiditással és mortalitással való kapcsolatára.
A GGT prediktív értékét CKD-s betegeknél alig vizsgálták. Postorino és munkatársai9 584 dializált CKD-s betegnél erős, független összefüggést figyeltek meg a magas GGT-szint és a teljes és kardiovaszkuláris mortalitás között. Ebben a vizsgálatban azonban nem határozták meg a szérum ALP-koncentrációt.
Egy másik vizsgálatban a magas GGT-szint CKD-s betegeknél kifejezett endothelialis diszfunkcióval társult, ami arra utal, hogy kapcsolat van e marker emelkedett szintje és a kardiovaszkuláris betegségek kockázata között.10
A lehetséges szisztémás prooxidatív hatáson kívül más hipotézisek is magyarázhatják az emelkedett GGT-szint és a CKD-s betegek halálozása közötti összefüggést. Így a magas GGT egyszerűen jelezhet alkoholfogyasztást vagy májbetegségeket, olyan társbetegségeket, amelyek indokolnák a túlzott mortalitást. Ebben a vizsgálatban azonban a GGT a krónikus alkoholizmusban, krónikus májbetegségben vagy hepatotróp vírusfertőzésben szenvedő betegek kizárása után is szignifikáns összefüggést tartott fenn a mortalitással, így kizárható a májbetegség kizárólagos szerepe ebben az összefüggésben.
A zsírmájbetegség és a pangásos májbetegség mindazonáltal két olyan szubklinikai májbetegség, amely magas GGT-szintet okozhat.26,27 A zsírmájbetegség viszonylag gyakori lelet a CKD-s betegeknél, és szorosabb kapcsolatban áll a kardiovaszkuláris kockázati tényezőkkel, mint a májszövődmények kialakulásával.27 A zsírmájbetegséggel összefüggő klinikai és biokémiai jellemzők hasonlóak a vizsgálatunkban a betegek magas GGT-t mutató alcsoportjában megfigyeltekhez. Ebben a vizsgálatban azonban a legtöbb betegnél nem vizsgálták megfelelően a zsírmájbetegség diagnózisát, ezért nem garantálható, hogy a magas GGT elsősorban ennek a betegségnek a következménye.
A májzsugorodás a jobb oldali szívelégtelenséghez vagy bármely olyan okhoz kapcsolódó passzív pangásnak tulajdonítható májbetegségek spektrumára utal, amely növeli a centrális vénás nyomást, beleértve a térfogattúlterhelést, a súlyos pulmonális hipertóniát vagy a billentyűbetegségeket.28 Az emelkedett szérum GGT vagy ALP jellegzetes biokémiai eltérések a bal kamrai diasztolés diszfunkcióban szenvedő CKD-s betegeknél, különösen, ha pulmonális pangással társulnak,29 ami szintén elismert kockázati tényezője a halálozásnak ezeknél a betegeknél.30
Az emelkedett GGT mikroszomális enzimek indukcióját is tükrözheti.31 Az alkoholfogyasztás mellett számos gyógyszer indukálhatja a májenzimeket. Ebben a vizsgálatban a CKD-betegeknél leggyakrabban felírt gyógyszerek egyike sem volt szignifikáns kapcsolatban a magas GGT- vagy ALP-szintekkel, bár nem zárható ki a vény nélkül kapható gyógyszerek (különösen a fájdalomcsillapítók) lehetséges hatása a magas GGT-szintekre betegeinknél.
Ez a vizsgálat egy sor korlátozást tartalmaz. Tekintettel a retrospektív felépítésre, nem lehetett ok-okozati összefüggéseket megállapítani. A vizsgálatot egyetlen helyszínen végezték, és a vizsgált kohorsz, bár reprezentatív volt a helyi lakosságra nézve, etnikailag homogén (kaukázusi) volt. A GGT-t és az ALP-t nem elemezték időben változó kovariátorként, ezért valószínű, hogy a GGT átmeneti emelkedésének prognosztikai jelentősége eltér az idővel fennmaradó emelkedéstől. Ebben a vizsgálatban azonban a keresztmetszeti elemzésben a magas GGT kimutatása a CKD egy bizonyos szakaszában egy olyan klinikai fenotípushoz kapcsolódott, amely a kardiovaszkuláris komorbiditással és a mortalitással való kapcsolata miatt nagy érdeklődésre tart számot. Végül, a csontspecifikus ALP-t és más, specifikusabban a csont remodellinghez kapcsolódó paramétereket nem mértünk.
Végeredményben a kórosan emelkedett GGT-szint gyakori lelet a CKD-s betegeknél, amely gyakrabban figyelhető meg a nagyobb komorbiditással, különösen a szív- és érrendszeri betegségekkel rendelkező betegeknél, és függetlenül összefügg a mortalitással. A szérum GGT és ALP egyidejű emelkedése növeli a halálozási kockázatot. Ezért a szérum GGT ALP-vel kombinált mérése további prediktív információt nyújthat a CKD-ben szenvedő betegeknél.
Érdekütközések
A szerzők kijelentik, hogy nincsenek érdekellentétek.
Nem állnak fenn.