A legtöbb élő szervezetben a glikogén és a keményítő, a megadalton méretű glükózpolimerek jelentik a könnyen hozzáférhető energia és szénvegyületek fő tartalékát. Az emlősökben a glükózfelvétel és -felhasználás szigorú ellenőrzés alatt áll. A normál glükózkezelés hibái számos emberi kórképhez társulnak, mint például a glikogénraktározási betegségek és a cukorbetegség, amelyekben a tartós hiperglikémia a betegség korai kezdetével és fokozott súlyosságával jár együtt. A glikogén katalitikus átalakításának metabolikus útjai több enzimet foglalnak magukban, ezek közül a glikogén-szintáz az a(1,4)-kötött glükánok megnyúlását, a glikogén-foszforiláz pedig a lebontását katalizálja. Az elmúlt 30 évben a glikogén és a maltodextrin foszforilázok biokémiai és szerkezeti vizsgálatával rengeteg információt szereztek a glikogén lebontásáról. Ezek a vizsgálatok kimutatták, hogy a glikogén-foszforiláz szabályozása a kovalens és nem kovalens alloszterizmus lenyűgöző példája, amelyet a hormonális kontroll kiválóan összehangol. A tercier és kvaterner szerkezeteket leíró információk ma már gyakorlatilag az összes, a glikogén feldolgozásában közvetlenül részt vevő enzimről rendelkezésre állnak. Meglepő módon nagyon kevés szerkezeti információt közöltek a glikogén-szintázról, amely a glikogén megnyúlását katalizálja ![]() -(1,4)-kötött glükózmaradványok egymást követő hozzáadásával a polimer nem redukáló végéhez, ADP/UDP-glükózt használva glükózdonorként.
-(1,4)-kötött glükózmaradványok egymást követő hozzáadásával a polimer nem redukáló végéhez, ADP/UDP-glükózt használva glükózdonorként.
Most meghatároztuk az Agrobacterium tumefaciensből származó glikogén-szintáz (AtGS) kristályszerkezetét 2,3 Å felbontásban, mind apo-formában, mind ADP jelenlétében. Az adatokat ID29-en gyűjtötték, és a szerkezetet SAD-technikával (egyhullámú anomális diffrakció) oldották meg, amelyet sűrűségmódosító eljárások követtek. A fehérje dimerként található az aszimmetrikus egységben, ahol minden monomer két “Rossmann-fold” doménből áll (81. ábra), amelyek a glikogén-foszforiláz és a GT-B szupercsalád más glikoziltranszferázainak szerkezetéhez hasonlóan szerveződnek. A két domén közötti mély hasadék tartalmazza a katalitikus központot. Az emlősök (GT3 család) és a bakteriális (GT5) glikogénszintázok közötti fő különbség az, hogy csak a GT3 enzimek foszforilációval és nem kovalens alloszterikus modulációval szorosan szabályozottak. A GT3, GT5 és glikogén-foszforiláz szekvenciák közötti szerkezetalapú többszörös szekvenciaillesztések szerint a humán glikogén-szintázban a szabályozó foszforilációs helyek valószínűleg a 25-residue N-terminális és 120-residue C-terminális inszerciókban találhatók, a bakteriális glikogén-szintázok nem szabályozott GT-B magján kívül. Mutagenezis vizsgálatok korábban két konzervált Arg-klasztert azonosítottak a GT3 enzimekben, amelyek mind a foszfo-Ser/Thr maradékok, mind a nem kovalens aktivátor Glc-6P allosztérikus hely(ek) részét képezik. Az AtGS-ben az ezzel egyenértékű maradékok a C-terminális domén egyik végén, a reakciócentrumtól távol helyezkednek el, ami hosszú távú szabályozó hatásra utal.
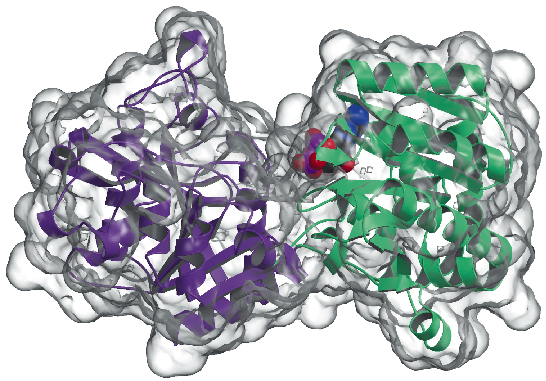
81. ábra: A glikogén-szintáz szerkezete: az oldószerrel hozzáférhető felületet átlátszóan ábrázoljuk. Figyeljük meg a kötött ADP molekulát (VDW golyóként rajzolva).
Az AtGS szerkezete feltűnő topológiai hasonlóságot mutat a glikogén/maltodextrin foszforilázok (GT35 család) magszerkezeteivel (82a. ábra), annak ellenére, hogy a szekvenciaazonosság alacsony (~14%). Az AtGS minden egyes Rossmann-hajtás doménjének szerkezete lényegesen közelebb áll a GT35 családba tartozó foszforilázokéhoz, mint bármely más nukleotidfüggő glikoziltranszferázéhoz. A glikogén-szintáz és a foszforilázok katalitikus helyeikben is erős hasonlóságot mutatnak (82b. ábra). Az ADP ribóz és a piridoxálcsoportok egyenértékű pozíciókban helyezkednek el, akárcsak az ADP disztális foszfátja az AtGS-ben és a szervetlen foszfát szubsztrát a foszforilázokban. Továbbá a szubsztrátok glükózrészeivel kölcsönhatásba lépő kritikus aminosavak is konzerváltak. A glikogénszintázok és a foszforilázok által alkalmazott katalitikus mechanizmus tehát valószínűleg hasonló, és a szerkezetben bekövetkező finom változások magyarázzák összességében eltérő funkcionális tulajdonságaikat.
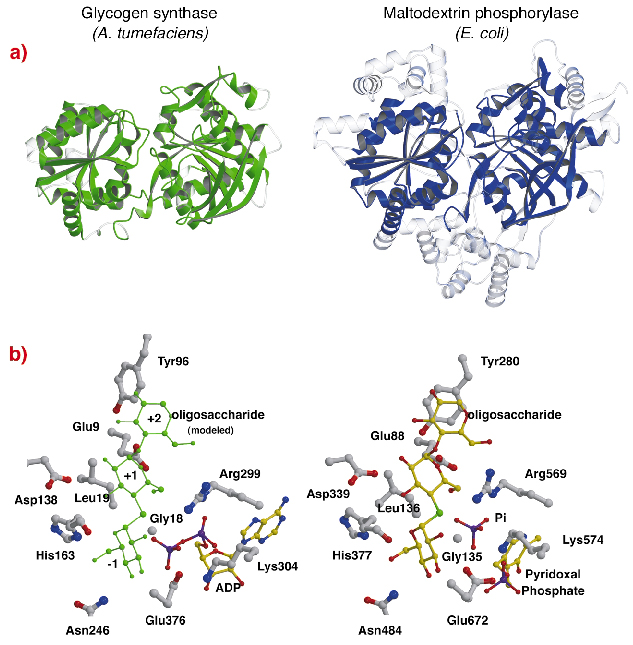
82. ábra: Homológia a glikogénfoszforilázzal: (a) a szerkezeti összehangolást követően az AtGS és az E. coli maltodextrin-foszforiláz MalP közötti, egymásra helyezett egyenértékű maradékok szilárd anyagban ábrázolva (a nem összehangolt régiók átlátszó színnel); (b) az AtGS és a MalP katalitikus helyei.
A kezdeti feltételezés, miszerint a glikogénszintézis egyszerűen a degradatív foszforolízisének megfordítását jelenti, tévesnek bizonyult, mivel Leloir kimutatta, hogy az UDP-Glc és a glikogénszintáz, nem pedig a Glc-1-P és a glikogénfoszforiláz felelős a poliszacharidok megnyúlásáért . Munkánk most azonban azt bizonyítja, hogy a glükóz-glikogén interkonverzió ellentétes, egymástól független reakcióit szorosan rokon homológ enzimek katalizálják.