Le XeF4 ou tétrafluorure de xénon est un composé chimique constitué d’atomes de xénon et de fluorure. C’est le premier composé binaire découvert au monde. C’est un type de gaz noble ayant l’équation chimique de
Xe +2 F2 -> XeF4
Le XeF4 a un aspect blanc solide et a une densité de 4,040 g cm-3 sous forme solide. Dans des conditions ordinaires, il apparaît comme un cristallin incolore. Il a une température sublime de 115,7 degrés Celsius ou 240,26 degrés Fahrenheit. Comme les autres fluorures de xénon, le tétrafluorure de xénon a une formation exergonique. À température et pression normales, il reste dans un état stable. Il réagit instantanément avec l’eau et libère de l’oxygène moléculaire, du fluorure d’hydrogène et du gaz xénon pur.
| Nom de la molécule | Tétrafluorure de xénon (XeF4) |
| Nombre de valence. Electrons dans la molécule | 36 |
| Hybridation de XeF4 | hybridation sp3d2 |
| Angles de liaison | 90 degrés et 180 degrés |
| Géométrie moléculaire du XeF4 | Planaire carré |
Pour en savoir plus sur ses propriétés physiques et chimiques, il faut connaître sa structure de Lewis et sa géométrie moléculaire. Découvrons la structure de Lewis du tétrafluorure de xénon.
Pour réaliser la structure de Lewis, il faut connaître les électrons de valence du XeF4 pour réaliser sa structure et connaître le placement des atomes dans la molécule.
Contenu
XeF4 Electrons de valence
Dans cette molécule, nous avons un atome de Xénon et quatre atomes de Fluor. Nous allons calculer les électrons de valence de ces deux atomes pour déterminer le nombre total d’électrons de valence de XeF4.
Électrons de valence du Xénon = 8
Électrons de valence du Fluor = 7*4 ( comme il y a quatre atomes de Fluor, nous allons le multiplier par 4)
Nombre total d’électrons de valence de Xef4 : 8 + 7*4
: 8 + 28
: 36
Il y a donc un total de 36 électrons de valence dans XeF4.
Structure de Lewis du XeF4
Maintenant que nous connaissons les électrons de valence du tétrafluorure de xénon, il vous sera plus facile de dessiner sa structure de Lewis. Cette structure de Lewis par points est une représentation imagée des électrons de valence autour des atomes individuels d’une molécule avec la liaison qu’elle forme.
Les liaisons dans la structure sont représentées à l’aide de lignes, tandis que les électrons qui ne participent pas à la formation de la liaison sont représentés par des points. Les électrons qui ne forment aucune liaison sont appelés électrons non liants ou paires d’électrons solitaires.
Ici, comme le Xénon est l’atome le moins électronégatif, nous le placerons au centre et tous les autres atomes de fluor autour de lui comme ceci :

Maintenant que nous avons placé tous les atomes, montrons les liaisons entre chaque atome de Fluor et de Xénon. Chaque liaison dans la molécule prend deux électrons, et comme il y a quatre liaisons simples dans cette molécule, 8 électrons sur 36 sont utilisés.
Commencez à placer le reste des électrons de valence autour des atomes. Chaque atome de fluor aura six électrons de valence autour de lui, car un électron a été utilisé pour faire la liaison.
Vous pourriez remarquer que nous avons déjà placé 24 électrons sur 28 autour des atomes de fluor. Les électrons non liants restants ou les paires d’électrons solitaires seront placés sur le Xénon, car il constitue une exception à la règle de l’octuor.
Placez ces deux paires d’électrons non liants sur le Xénon, et maintenant vous avez une structure de Lewis où il y a deux paires d’électrons solitaires sur le Xénon et six électrons non liants sur chaque atome de Fluor.
Hybridation du XeF4
Les orbitales de l’atome central de Xénon sont hybridées, ce qui entraîne la formation de nouvelles orbitales hybridées. Le xénon possède six électrons dans ses orbitales 5p et deux électrons dans les orbitales 5s. Il n’y a pas d’électrons dans les orbitales d et les orbitales f dans l’état fondamental du xénon. Mais lorsque cet atome est dans un état excité, deux électrons dans les orbitales p se déplacent vers les orbitales d ; par conséquent, il y a quatre électrons non appariés au total. Deux d’entre eux sont dans les orbitales p, et les deux autres électrons non appariés sont dans les orbitales d. Ces orbitales hybridées conduisent à une hybridation sp3d2 dans le XeF4.
Géométrie moléculaire du XeF4
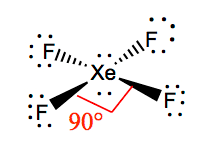
Il est plus facile de comprendre la géométrie moléculaire d’une molécule donnée lorsque l’on connaît sa structure de Lewis. Comme le xénon possède deux paires d’électrons solitaires, il adoptera une structure qui aide ces paires solitaires à éviter les forces de répulsion. Pour maintenir ces répulsions au minimum, les paires solitaires seront dans un plan perpendiculaire. Et comme il y a quatre atomes de fluor, la molécule aura un arrangement tel que sa géométrie moléculaire est un plan carré. XeF4 a une géométrie électronique d’octaèdre, ce qui rend la géométrie moléculaire du tétrafluorure de xénon plane et carrée.

XeF4 Angles de liaison
Les angles de liaison de F-Xe-F sont de 90 degrés, et les paires solitaires ont des angles de 180 degrés. Les atomes de fluor sont situés à 90 degrés les uns par rapport aux autres, ce qui entraîne une distribution symétrique des électrons dans le plan de la molécule. Ces angles de liaison contribuent à la formation d’une géométrie moléculaire plane et carrée.
Polarité du XeF4 – Le XeF4 est-il polaire ou non polaire ?
Bien que les liaisons entre les atomes de xénon et de fluor soient polaires, XeF4 est une molécule non polaire. Vous vous demandez comment ? Toutes les liaisons Xe-F sont en opposition les unes avec les autres mutuellement, ce qui rend la somme du moment dipolaire nulle. Comme il y a quatre électrons sur l’atome de xénon, qui sont localisés sous forme de paires d’électrons non liants. Comme l’arrangement global des atomes et des électrons dans la molécule est tel que la somme vectorielle des dipôles est nulle, XeF4 est une molécule non polaire.
Marques finales
Le tétrafluorure de xénon fait partie de ces molécules relativement faciles à comprendre. Sa structure de Lewis est l’une des structures les moins compliquées, car tous les atomes de Fluor sont disposés selon le schéma symétrique. Les paires solitaires de la molécule sont situées dans un plan perpendiculaire en forme d’octaèdre pour garder leurs forces répulsives au minimum.
Pour résumer ce billet de blog, nous pouvons dire que le XeF4 possède 36 électrons de valence. Il a deux paires solitaires d’électrons non liants sur l’atome central du Xénon. La molécule a une géométrie électronique octaédrique et une géométrie moléculaire plane carrée. XeF4 est une molécule non polaire et possède une hybridation sp3d2.