Introduction
On a constaté qu’un taux de filtration glomérulaire estimé (DFGe) inférieur à 60mL/min/1,73 m2 est associé à un risque accru de mortalité toutes causes confondues et cardiovasculaire dans les populations générales et à haut risque.1,2 Les personnes dont le DFGe est inférieur sont plus susceptibles de mourir de causes cardiovasculaires que d’insuffisance rénale.1,3 La prévalence du DFGe
mL/min/1,73 m2 augmente progressivement avec l’âge, pouvant atteindre 50 % chez les personnes âgées de plus de 80 ans.4,5 Compte tenu du vieillissement de la population mondiale, on s’attend à ce que la fonction rénale ait un impact croissant sur les maladies cardiovasculaires dans les années à venir.
Certaines études ont signalé que l’association entre le DFGe et la mortalité est atténuée par l’âge.1,6 De plus, la signification clinique d’une fonction rénale modérément réduite (DFGe 45-59mL/min/1,73 m2) chez les personnes âgées de plus de 65 ans fait l’objet d’un débat permanent.7,8 On a constaté que la mortalité était significativement plus élevée pour un DFGe 6,9 mais seulement pour un DFGe 4,10-12 Les résultats concernant les événements cardiovasculaires (ECV) sont encore plus incohérents.12,13 Ce scénario a conduit certains auteurs à proposer un seuil calibré en fonction de l’âge, c’est-à-dire un DFGe 8, ce qui est intéressant en raison de la prévalence élevée de réductions plus légères chez les personnes âgées.
Certaines des divergences dans les résultats peuvent être dues à des différences dans les méthodes utilisées pour mesurer la créatinine, les équations d’estimation du DFGe ou les caractéristiques des populations étudiées. De plus, les études menées dans des régions à faible incidence de maladies coronariennes (MC) n’incluaient pas les individus âgés de plus de 74 ans14,15 ou ne fournissaient pas d’informations détaillées entre les groupes d’âge.16,17
L’objectif de cette étude était d’évaluer l’association par âge entre le DFGe et la mortalité toutes causes confondues (MCA) et l’incidence des maladies cardiovasculaires chez les individus âgés de plus de 60 ans dans une population d’Europe du Sud à faible incidence de MC18.
MéthodeDesign et population étudiée
Nous avons réalisé une étude de cohorte rétrospective incluant tous les individus nés en 1950 ou avant, enregistrés dans l’un des 40 centres de soins de santé primaires avec un laboratoire centralisé faisant partie du service de soins primaires de Costa de Ponent dans le nord-est de l’Espagne (desservant une population de 873 549 individus), et dont la créatinine a été mesurée entre le 1er janvier 2010 et le 31 décembre 2011. Nous avons exclu les patients atteints d’une maladie rénale de stade 5 (DFGe
Sources de données
Les données cliniques de base ont été obtenues à partir des dossiers médicaux électroniques des soins primaires ; pour la maladie cardiovasculaire de base, nous avons également comptabilisé les admissions antérieures à l’hôpital en raison d’une maladie cardiovasculaire ou les procédures de revascularisation depuis 2005. Nous avons défini la date d’index comme celle à laquelle la première mesure de la créatinine a été effectuée pendant la période d’inclusion ; le statut de base a été défini selon les caractéristiques enregistrées entre 1 an avant et 1 mois après la date d’index.
Évaluation de la fonction rénale
Les taux de créatinine sérique ont été mesurés par un seul laboratoire à l’aide de la méthode cinétique compensée standardisée de Jaffe traçable à une méthode de référence de spectrophotométrie de masse à dilution isotopique. Le DFGe a été estimé en utilisant l’équation de la créatinine de la Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI)19 sans correction pour la race, qui n’était pas disponible.
Nous avons classé le DFGe en catégories cliniques selon le guide de pratique clinique 2012 de la KDIGO : 15 à 29, 30 à 44, 45 à 59, 60 à 89 et 90 à 119.20
Covariables
Nous avons recueilli des données sur l’âge, le sexe, le statut tabagique (jamais fumeur, fumeur actif et ancien fumeur), l’hypercholestérolémie (cholestérol sérique > 6.4 mmol/L ou traitement par statine), les facteurs de risque cardiovasculaire (hypertension, diabète sucré) et les diagnostics antérieurs de maladie cardiovasculaire (coronaropathie, maladie cérébrovasculaire, artériopathie périphérique et insuffisance cardiaque).
Résultats
Les données sur la date de décès ont été obtenues à partir des registres hospitaliers ou administratifs sans spécification de la cause ; tous les critères d’évaluation de l’ACM ont été obtenus à partir des dossiers d’hospitalisation, qui comprennent les données de tous les hôpitaux de Catalogne, la région nord-est de l’Espagne. Le critère d’évaluation principal était l’ACM et le critère d’évaluation secondaire était l’ensemble des ECV, y compris les maladies coronariennes (infarctus du myocarde aigu, angine de poitrine instable ou angor) et les accidents vasculaires cérébraux (accident vasculaire cérébral non hémorragique ou accident ischémique transitoire). Nous avons analysé séparément les CVE durs (infarctus aigu du myocarde et accident vasculaire cérébral non hémorragique), les coronaropathies et les accidents vasculaires cérébraux.
Les participants ont été suivis à partir d’un mois après la date d’index jusqu’à leur décès, leur transfert vers un autre système de santé ou jusqu’à la fin de l’étude (31 décembre 2013).
Le protocole de l’étude a été approuvé par le comité local d’éthique de la recherche clinique (IDIAP Jordi Gol P11/43). Nous n’avons pas demandé le consentement éclairé des participants, car le comité d’éthique de la recherche ne l’a pas jugé nécessaire.
Analyse statistique
Toutes les variables ont été analysées par groupe d’âge (60 à 74 ans et ≥ 75 ans). Nous avons utilisé ces groupes d’âge parce qu’ils coïncident avec les systèmes les plus courants d’estimation du risque de maladie cardiovasculaire.18 Les variables continues sont décrites sous forme de moyenne ± écart-type ou de médiane (distribution non normale), et les variables catégorielles sont décrites sous forme de fréquences absolues et relatives. Nous avons utilisé le test t de Student et le test de Kruskall-Wallis pour évaluer les différences entre les groupes de variables continues à distribution normale et non normale, respectivement. Nous avons utilisé le test du chi-deux pour les variables catégorielles et avons également testé la tendance linéaire entre les catégories de DFGe. Les événements incidents ont été calculés à l’aide des courbes de Kaplan-Meier à 3 ans.
Dans chaque groupe, nous avons utilisé des modèles de risques proportionnels de Cox pour estimer les rapports de risque (HR) pour l’association entre le DFGe en tant que variable continue et le risque d’ACM. Nous avons vérifié la linéarité de l’effet du DFGe en utilisant des splines linéaires avec 4 degrés de liberté dans les modèles de Cox. En raison du petit nombre d’individus ayant un DFGe ≥ 120 (n = 14) et de la diminution de la précision des estimations au-delà de ce point, ces individus ont été exclus des analyses ultérieures. Nous avons également utilisé des modèles de risques proportionnels de Cox pour tester l’association entre le DFGe catégorique, défini par les points de coupure cliniques KDIGO 2012, et l’ACM. Pour tous les MCA, l’analyse a été effectuée en utilisant des techniques de survie à risques concurrents (régression des risques proportionnels subdistributifs de Fine-Gray) pour tenir compte de l’effet possible de la mortalité incidente sur les estimations.
L’hypothèse de proportionnalité du risque dans le temps a été évaluée graphiquement (résidus de Schoenfeld) pour la variable d’exposition (DFGe).
Les modèles de risques proportionnels deox pour le DFGe continu et catégorique ont été ajustés pour l’âge, le sexe, le statut tabagique, l’hypercholestérolémie, le diabète sucré, l’hypertension et les antécédents de maladie cardiovasculaire (cardiaque ischémique, cérébrovasculaire, artériopathie périphérique ou insuffisance cardiaque). Les modèles ont en outre été ajustés pour les traitements pour lesquels des données étaient disponibles (statines et médicaments du système rénine-angiotensine).
Bien que le CKD-EPI ait été développé à partir d’un échantillon présentant une large tranche d’âge (18-97 ans), peu d’individus âgés de 80 ans et plus étaient présents. Par conséquent, nous avons effectué une analyse de sensibilité en utilisant l’équation de l’étude Berlin Initiative-1,21 qui a été spécifiquement développée dans un échantillon communautaire d’individus âgés ≥ 70 ans.
Les modèles finaux ont été validés en utilisant le test de Hosmer-Lemeshow et l’aire sous la courbe caractéristique d’exploitation du récepteur. Pour les deux méthodes, la censure et les événements concurrents ont été pris en compte.
Toutes les analyses statistiques ont été réalisées à l’aide de R version 3.2.3 (R : un langage et un environnement pour le calcul statistique R Foundation for Statistical Computing, Vienne, Autriche), avec des tests bilatéraux et des P
RESULTATS
Sur 138 040 individus éligibles (73.1% de l’ensemble de la population âgée ≥ 60 ans dans cette région), 6797 ont été exclues parce qu’elles étaient en soins à domicile, 509 avaient une maladie rénale de stade 5 et 501 avaient été suivies pour Figure 1 du matériel supplémentaire). Il n’y avait pas de différence cliniquement significative entre les personnes incluses et exclues en termes d’âge (P = 0,374) ou de sexe (56,1 % et 55,1 % de femmes, respectivement ; P
L’âge médian de l’ensemble de l’échantillon était de 70 ans , et 56,1 % des participants étaient des femmes. Le DFGe médian était de 82,42 ; 13,5% des participants avaient un DFGe Tableau 1), la prévalence du DFGe P
P catégorie mL/min/1,73 m2.
Caractéristiques de base de la population étudiée, Stratifiée selon l’âge et la catégorie de débit de filtration glomérulaire estimé
| ALL | 90-119 mL | 60-89 mL | 45-59 mL | 30-44 mL | 15-29 mL | P global | P tendance | |
|---|---|---|---|---|---|---|---|---|
| Les personnes âgées de 60 à 74 ans | ||||||||
| Patients | 88 356 | 34 546 | 48 354 | 4257 | 986 | 213 | ||
| Âge, y | 66.0 | 64.0 | 68.0 | 70.0 | 70.0 | 70.0 | ||
| Sexe, femme | 47 549 (53,8) | 19 927 (57,7) | 24 863 (51.4) | 2173 (51.0) | 489 (49.6) | 97 (45.5) | ||
| Fumeur | ||||||||
| Jamais fumeur | 54 452 (61.6) | 21 525 (62.3) | 29 713 (61.4) | 2572 (60.4) | 532 (54.0) | 110 (51.6) | ||
| Fumeur actif | 10 458 (11,8) | 4714 (13,6) | 5189 (10,7) | 422 (9,91) | 107 (10,9) | 26 (12.2) | ||
| Ancien fumeur | 23 446 (26.5) | 8307 (24.0) | 13 452 (27.8) | 1263 (29.7) | 347 (35.2) | 77 (36.2) | ||
| Hypercholestérolémie | 44 990 (50,9) | 16 710 (48,4) | 24 994 (51,7) | 2529 (59,4) | 613 (62,2) | 144 (67.6) | ||
| Diabète sucré | 19 998 (22,6) | 7950 (23,0) | 10 226 (21,1) | 1296 (30,4) | 431 (43.7) | 95 (44,6) | ||
| Hypertension | 49 781 (56.3) | 17 167 (49.7) | 28 226 (58.4) | 3346 (78.6) | 857 (86.9) | 185 (86,9) | ||
| Maladie coronarienne | 6200 (7,02) | 1825 (5,28) | 3629 (7,51) | 527 (12.4) | 173 (17,5) | 46 (21,6) | ||
| Maladie cérébro-vasculaire | 4231 (4.79) | 1286 (3.72) | 2428 (5.02) | 361 (8.48) | 120 (12.2) | 36 (16.9) | ||
| PAD | 1686 (1.91) | 510 (1.48) | 906 (1.87) | 171 (4.02) | 76 (7,71) | 23 (10,8) | ||
| Insuffisance cardiaque | 1891 (2,14) | 453 (1,31) | 1011 (2,09) | 259 (6.08) | 132 (13,4) | 36 (16,9) | ||
| MCV antérieure* | 12 012 (13,6) | 3628 (10.5) | 6854 (14,2) | 1080 (25,4) | 361 (36,6) | 89 (41,8) | ||
| Statines | 39 392 (44.6) | 14 307 (41.4) | 22 025 (45.5) | 2341 (55.0) | 581 (58.9) | 138 (64.8) | ||
| RASD | 40 619 (46.0) | 13 468 (39.0) | 23 203 (48.0) | 3009 (70.7) | 787 (79.8) | 152 (71.4) | ||
| ≥ 75 ans et plus.ans | ||||||||
| Patients | 41 877 | 1768 | 27 971 | 8005 | 3449 | 684 | ||
| Âge, y | 79.0 | 77.0 | 79.0 | 81.0 | 82.0 | 83.0 | ||
| Sexe, femme | 25 482 (60.8) | 1004 (56.8) | 16 706 (59.7) | 5056 (63.2) | 2273 (65.9) | 443 (64.8) | ||
| Fumeur | ||||||||
| Jamais fumeur | 30 251 (72.2) | 1202 (68.0) | 20 086 (71.8) | 5836 (72.9) | 2616 (75.8) | 511 (74.7) | ||
| Fumeur actif | 1866 (4.46) | 126 (7.13) | 1278 (4.57) | 325 (4.06) | 113 (3.28) | 24 (3,51) | ||
| Ancien fumeur | 9760 (23,3) | 440 (24.9) | 6607 (23,6) | 1844 (23,0) | 720 (20,9) | 149 (21,8) | ||
| Hypercholestérolémie | 20 705 (49,4) | 798 (45.1) | 13 621 (48,7) | 4115 (51,4) | 1823 (52,9) | 348 (50,9) | ||
| Diabète sucré | 11 889 (28.4) | 586 (33.1) | 7587 (27.1) | 2309 (28.8) | 1161 (33.7) | 246 (36,0) | ||
| Hypertension | 30 563 (73.0) | 1078 (61.0) | 19 310 (69.0) | 6562 (82.0) | 3018 (87.5) | 595 (87.0) | ||
| Maladie coronarienne | 5074 (12.1) | 146 (8.26) | 3037 (10.9) | 1150 (14.4) | 603 (17.5) | 138 (20.2) | ||
| Maladie cérébrovasculaire | 4567 (10,9) | 171 (9,67) | 2781 (9,94) | 1034 (12,9) | 486 (14.1) | 95 (13.9) | ||
| PAD | 2904 (6.93) | 49 (2.77) | 807 (2.89) | 327 (4.08) | 185 (5.36) | 49 (7.16) | ||
| Insuffisance cardiaque | 3275 (7,82) | 90 (5,09) | 1648 (5,89) | 822 (10,3) | 551 (16,0) | 164 (24.0) | ||
| MCV antérieure* | 11 691 (27,9) | 389 (22,0) | 6900 (24,7) | 2657 (33,2) | 1419 (41.1) | 326 (47,7) | ||
| Statines | 19 029 (45.4) | 747 (42.3) | 12 460 (44.5) | 3789 (47.3) | 1698 (49.2) | 335 (49.0) | ||
| RASD | 25 247 (60.3) | 824 (46.6) | 15 632 (55.9) | 5649 (70.6) | 2644 (76.7) | 498 (72,8) | ||
CVD, maladie cardiovasculaire ; PAD, maladie artérielle périphérique ; RASD, médicaments du système rénine-angiotensine.
Sauf indication contraire, les données sont exprimées en nombre (%) ou en médiane .
Comprenant les maladies cérébrovasculaires, les MAP et l’insuffisance cardiaque.
Pour tester les associations de DFGe dans les modèles de Cox, nous avons défini un DFGe = 80 comme référence (également utilisé dans la méta-analyse du CKD-Prognostic Consortium)6 dans les deux groupes car il s’agissait du DFGe médian dans la population, et 60 à 90 comme catégorie clinique, car cette catégorie comprenait le plus grand nombre d’individus et était cliniquement significative.
Le suivi médian était de 38,2 mois . Un total de 6474 décès, 1573 événements coronariens et 2236 événements cérébrovasculaires ont été enregistrés. Tous les résultats étaient significativement plus fréquents dans le groupe d’âge le plus élevé (P tableau 2), à l’exception des événements cérébrovasculaires, qui étaient légèrement moins fréquents chez les personnes ayant un DFGe de 15 à 29.
Résultats dans la population de l’étude, stratifiée par âge et débit de filtration glomérulaire estimé selon les estimations de Kaplan-Meier à 3 ans. Test du log-rang (P global), Tendance linéaire Test de Wald (P tendance)
| Tous | 90-119 mL | 60-89 mL | 45-59 mL | 30-44 mL | 15-29 mL | P global | P tendance | ||
|---|---|---|---|---|---|---|---|---|---|
| 60- à 74 ans | |||||||||
| Patients | 88 356 | 34 546 | 48 354 | 4257 | 986 | 213 | |||
| Toutes causes confondues.toutes causes confondues, % | 2.08 | 1.79 | 1.93 | 3.91 | 8.20 | 18.6 | |||
| Tout CVE, % | 2,09 | 1,51 | 2,26 | 3,78 | 5,60 | 7.94 | |||
| CVE dur, % | 1,46 | 1,06 | 1,56 | 2,76 | 4,05 | 4.78 | |||
| CHD, % | 0,96 | 0,74 | 1,02 | 1,38 | 2,83 | 4.80 | |||
| Course, % | 1.16 | 0.79 | 1.27 | 2.44 | 2.88 | 3.17 | |||
| ≥ 75 ans et plus.ans | |||||||||
| Patients | 41 877 | 1768 | 27 971 | 8005 | 3449 | 684 | |||
| Mortalité toutes causes, % | 9.88 | 10.5 | 7.89 | 11.7 | 17,8 | 28,5 | |||
| Tout CVE, % | 4,34 | 3,31 | 3,90 | 4,80 | 6.77 | 8.35 | |||
| CVE dur, % | 3.24 | 2.22 | 2.90 | 3.75 | 4.90 | 5.93 | |||
| CHD, % | 1.69 | 1.30 | 1.48 | 1.77 | 2,86 | 5,41 | |||
| Course, % | 2.74 | 2,13 | 2,49 | 3,17 | 4,00 | 3,34 | |||
CHD, maladie coronarienne ; CVE, événement cardiovasculaire.
Les deux modèles, pour l’ACM et tout CVE, ont montré une proportionnalité du risque dans le temps pour la variable d’exposition (DFGe ; données non présentées).
L’association entre le DFGe et le risque d’ACM suivait un modèle en forme de U dans les deux groupes d’âge, mais était plus atténuée dans le groupe plus âgé (figure 1). En revanche, les HR pour tout ECA présentaient une distribution linéaire, avec une augmentation progressive du risque à partir d’un DFGe plus élevé vers un plus faible ; ce schéma était similaire dans les deux groupes d’âge, ainsi que pour d’autres critères d’évaluation cardiovasculaires (figure 2 du matériel supplémentaire). Pour toutes les issues, les HR chez les personnes âgées de ≥ 75 ans sont devenus significatifs en dessous de DFGe = 60 (figure 1), entre DFGe = 55 et DFGe = 60 pour l’ACM et à DFGe ∼ 50 pour toute CVE.
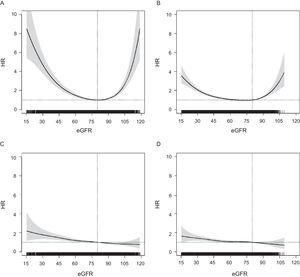
Association entre le DFGe (variable continue) et le risque d’ACM chez les personnes âgées de P valeur
En termes de catégories cliniques de DFGe, le risque d’ACM et de tout CVE a progressivement augmenté dans les catégories de DFGe inférieures à 60 à 89 dans les deux groupes d’âge (figure 2). L’augmentation du risque d’ACM était beaucoup plus élevée et abrupte chez les personnes âgées de 60 à 74 ans que chez les personnes âgées de ≥ 75 ans, tandis que celle de tout CVE était plus similaire dans les deux groupes d’âge et était à la limite de la signification dans la catégorie de DFGe = 45 à 59 pour les personnes âgées de ≥ 75 ans. Un ajustement supplémentaire pour le traitement par des statines et des médicaments du système rénine-angiotensine n’a pas modifié les valeurs de HR (données non présentées). Nous avons également constaté que les personnes ayant un DFGe de 90 à 119 présentaient un risque plus élevé de décès dans le groupe le plus âgé et un risque significativement plus faible de toute CVE dans le groupe le plus jeune uniquement. Les résultats des modèles pour les coronaropathies, les accidents vasculaires cérébraux et les accidents vasculaires cérébraux graves étaient similaires à ceux de l’ensemble des accidents vasculaires cérébraux (figure 3 du matériel supplémentaire). Une analyse de sensibilité utilisant l’équation de l’étude Berlin Initiative-1 pour calculer le DFGe ne montrait aucune différence (figure 4 du matériel supplémentaire).

Association entre les catégories de DFGe et le risque de mortalité toutes causes confondues et tout événement cardiovasculaire, évaluée à l’aide de modèles de risques proportionnels de Cox ajustés considérant le décès comme un événement concurrent des événements cardiovasculaires (valeur P globale
Les modèles finaux ont montré une bonne calibration et une bonne discrimination (figure 5 du matériel supplémentaire et tableau du matériel supplémentaire).
DISCUSSION
Dans une population d’individus âgés ≥ 60 ans dans un pays à faible risque cardiovasculaire, le risque d’ACM et de tout CVE augmentait progressivement avec la diminution du DFGe, à la fois chez les personnes âgées de 60 à 74 ans et chez les personnes âgées de ≥ 75 ans, indépendamment des autres facteurs de risque et des maladies cardiovasculaires. Cependant, les HR dans le groupe d’âge le plus élevé sont devenus significatifs à un DFGe inférieur (inférieur à DFGe = 60), et étaient à la limite de la signification pour tout CVE dans la catégorie DFGe = 45 à 59. L’augmentation du risque de mortalité associée au DFGe était plus élevée chez les personnes âgées de 60 à 74 ans que chez les personnes âgées de ≥ 75 ans, mais était similaire pour le risque de CVE. En outre, l’association entre le DFGe et la mortalité suivait un modèle en forme de U, avec une augmentation de la mortalité dans la catégorie 90 à 119 et était plus élevée chez les ≥ 75 ans.
Dans cette population étudiée, les catégories d’âge définissaient 2 groupes bien différenciés, dans lesquels le nombre d’individus avec un DFGe
Comme prévu, l’incidence des résultats cardiovasculaires était inférieure à celle rapportée chez les personnes âgées dans les pays non méditerranéens,22 mais était plus élevée que chez les individus plus jeunes dans notre région23. Les événements cérébrovasculaires incidents étaient plus fréquents que les événements coronaires, ce qui a également été décrit dans les études sur les personnes âgées.22
Conformément aux rapports précédents,1,6,14,22,24 nous avons observé une relation en forme de U entre le DFGe en tant que variable continue et l’ACM dans les deux groupes d’âge. Fait remarquable, l’excès de risque de MCA observé dans la catégorie de DFGe = 90 à 119 était plus élevé chez les patients plus âgés. Cette augmentation du risque pourrait refléter une confusion due à la fonte musculaire secondaire à d’autres maladies conduisant au décès ; il s’agit d’une limite connue des formules d’estimation basées sur la créatinine.19 En revanche, nous avons constaté que le risque de nouvel ECA augmentait lorsque le DFGe était plus élevé ou plus faible. Ceci est cohérent avec certains rapports antérieurs,13,23,25 bien que d’autres aient rapporté une relation en forme de U moins marquée pour la mortalité cardiovasculaire6,12 et les maladies cardiovasculaires.15 Ainsi, les ECV incidents, qui semblent être moins affectés par les limites des formules d’estimation basées sur la créatinine, pourraient être un indice plus fiable de l’effet pronostique du DFGe sur le risque cardiovasculaire.
Il existe des preuves contradictoires sur la signification clinique d’un DFGe modérément réduit chez les personnes âgées. Peu d’études ont utilisé l’équation actuellement recommandée pour évaluer le risque associé au DFGe et pour comparer les résultats entre les différentes catégories d’âge. A notre connaissance, la nôtre est la première étude à le faire dans une population âgée résidant dans une région à faible incidence de coronaropathie.
Pour l’ACM, la méta-analyse CKD-PC6 a rapporté un HR ajusté significatif à un DFGe 9 a fait un constat similaire chez les 60 à 69 ans, 70 à 79 ans et ≥ 80 ans. En revanche, chez les octogénaires, l’étude sur la santé cardiovasculaire12 n’a trouvé de HR significatif qu’à un DFGe ≤ 43. Dans le sud de l’Europe, on a constaté que la mortalité augmentait chez les personnes âgées de plus de 65 ans avec un DFGe 16 et chez les personnes âgées de 60 à 74 ans avec un DFGe 15. Chez les personnes âgées de 35 à 74 ans sans maladie cardiovasculaire, on a constaté que le DFGe était un prédicteur limite significatif de l’ACM,14 et avec un risque significativement plus élevé à DFGe = 45-59.
Pour la mortalité cardiovasculaire, les HR dans les groupes âgés de 65 à 74 ans et ≥ 75 ans étaient significatifs pour le DFGe 6 alors que la Cardiovascular Health Study, utilisant des équations basées sur la créatinine, n’a pas trouvé d’association similaire chez les octogénaires12. En ce qui concerne le risque d’EVE incident, l’étude PREVEND a trouvé une association avec le DFGe chez les personnes de moins de 60 ans, mais pas chez celles âgées de ≥ 60 ans.13 Dans le sud de l’Europe, un risque accru de mortalité cardiovasculaire a été signalé pour un DFGe de 16 et de maladies cardiovasculaires incidentes (marginalement significatif) pour un DFGe de 15 et un DFGe de 23
Dans notre étude, les HR pour l’ACM et tout EVE ont augmenté régulièrement avec la diminution du DFGe en dessous de la catégorie 60 à 89, dans les deux groupes âgés de 60 à 74 ans et ≥ 75 ans. Comme dans les rapports précédents, les valeurs des HR et le gradient de risque étaient plus faibles dans le groupe le plus âgé,6,9 et lors de l’analyse du DFGe continu, les HR sont devenus significatifs à partir d’un DFGe 6
La plupart des directives internationales actuelles considèrent toutes les personnes ayant un DFGe 18,20,26 Dans la présente étude, 20 % des participants âgés ≥ 75 ans avaient un DFGe = 45 à 59, dont 74 % avaient un DFGe ≥ 50. Ainsi, considérer toutes les personnes âgées de la catégorie 45 à 59 comme présentant un risque plus élevé exposerait de nombreuses personnes ne présentant » aucun risque supplémentaire significatif » à des cibles et des traitements plus agressifs pour les facteurs de risque cardiovasculaire. En outre, l’augmentation de 11 % du risque relatif d’événements coronariens chez les personnes âgées de 60 à 74 ans pourrait ne pas être suffisante pour considérer la catégorie de DFGe = 45 à 59 comme un équivalent de risque de coronaropathie dans les pays où l’incidence de la coronaropathie est faible.
Forces et limites
L’une des principales forces de notre étude est le très grand nombre d’individus inclus, et le fait qu’ils aient été tirés d’un échantillon représentatif de la population, reflétant la situation réelle des patients pris en charge en soins primaires. Presque toutes les personnes âgées de > 60 ans (93%) ont été suivies par le système de soins de santé primaires catalan, et un pourcentage élevé d’entre elles ont subi une mesure de la créatinine, probablement parce que cela fait partie du bilan de santé préventif de base et du suivi de routine d’autres conditions chroniques prévalentes dans cette population. En outre, les tests de mesure de la créatinine ont été étalonnés par rapport à une méthode de référence utilisant la spectrophotométrie de masse à dilution isotopique, comme cela est recommandé, et ont été réalisés dans un laboratoire centralisé, ce qui réduit encore la variabilité.
Les résultats de cette étude doivent également être interprétés à la lumière de diverses limitations. Premièrement, les valeurs et les catégories de DFGe ont été attribuées sur la base d’une seule mesure, ce qui est habituel dans les études épidémiologiques du pronostic. En raison du biais de dilution de la régression, cela peut sous-estimer la véritable association entre le DFGe et les résultats d’intérêt. Cependant, il a été démontré que les faibles mesures du DFGe provenant de bases de données de laboratoires ambulatoires sont relativement stables chez les personnes âgées.27 Deuxièmement, nous n’avons pas tenu compte de l’effet de certains facteurs pouvant modifier la fonction rénale, tels que les néoplasmes, les médicaments néphrotoxiques, les infections ou les événements cliniques intercurrents. Nous pensons que ces effets sont minimisés par le grand nombre de patients inclus. Troisièmement, nous avons estimé le DFGe à partir des mesures de la créatinine sérique en utilisant la formule CKD-EPI, et nous acceptons les limites des formules d’estimation basées sur la créatinine, qui ont un impact plus important lorsque le DFGe est élevé.19 Nous n’avons pas corrigé pour la race, bien que l’ethnie caucasienne soit prédominante dans notre population, en particulier dans cette tranche d’âge. En outre, bien que l’utilisation diagnostique et pronostique de l’IPE-CKD chez les personnes âgées soit sujette à débat et que de nouvelles formules aient été développées, l’IPE-CKD est actuellement l’approche recommandée20 et est largement utilisée dans les soins primaires. En outre, une analyse de sensibilité avec un DFGe calculé selon l’équation de l’étude Berlin Initiative-1 a donné des résultats similaires. Quatrièmement, nous n’avons pas pu évaluer l’effet de l’albumine urinaire, car ces données n’étaient pas disponibles ; bien que le DFGe et l’albumine soient tous deux recommandés pour évaluer l’IRC, ils ont montré des implications pronostiques indépendantes1, et les résultats présentés ici apportent des informations précieuses sur l’effet du DFGe sur le risque cardiovasculaire et les niveaux de seuil chez les personnes âgées. Cinquièmement, les données ont été obtenues à partir de dossiers médicaux électroniques, et une détection erronée ne peut être exclue. Il a été démontré que les données relatives aux maladies cardiovasculaires dans le cadre des soins de santé primaires sont de meilleure qualité que pour d’autres maladies et qu’elles conviennent aux études épidémiologiques dans notre population.28,29 Les ECV mortels hors de l’hôpital n’ont pas été inclus. Plus précisément, il est possible que nous ayons sous-détecté les accidents vasculaires cérébraux chez les patients souffrant d’une maladie rénale avancée qui n’ont pas été admis à l’hôpital, et ceux-ci étaient probablement plus graves et avec une plus grande comorbidité entraînant le décès. Le schéma des accidents vasculaires cérébraux chez les personnes ayant un DFGe entre 45 et 80 était similaire à celui des autres CVE ; nous ne pensons pas que cela invalide nos résultats, puisque nous nous sommes concentrés sur l’IRC légère. Sixièmement, les modèles ont été ajustés pour les facteurs de risque et les maladies cardiovasculaires, ainsi que pour le traitement par statines et les médicaments du système rénine-angiotensine, mais pas pour d’autres comorbidités, médicaments ou facteurs socio-économiques susceptibles d’influer sur l’incidence de la CVE. Enfin, nous n’avons pas eu accès aux données sur la cause du décès. La mortalité toutes causes confondues comprend plusieurs étiologies qui ne sont pas liées à la fonction rénale mais à d’autres maladies associées à l’âge, au diabète sucré ou à l’insuffisance cardiaque, comme les infections ou les chutes. Bien que nous ayons ajusté certaines de ces comorbidités, nous ne pouvons pas exclure la présence d’autres sources de confusion, comme la fragilité.30
CONCLUSIONS
En conclusion, chez les personnes âgées de ≥ 60 ans résidant dans un pays à faible incidence de coronaropathie, nous avons observé une augmentation du risque d’ACM et de toute CVE avec la diminution du DFGe dans les deux groupes âgés de 60 à 74 ans et ≥ 75 ans. Cependant, les HR sont devenus significatifs à partir d’un DFGe
FUNDING
Ce projet a été soutenu par une subvention de recherche de l’Institut de la santé Carlos III, ministère de l’Économie et de la Compétitivité (Espagne), accordée dans le cadre de l’appel 2011 de l’Action stratégique pour la santé, au sein du Programme national de recherche orienté vers les défis sociétaux. Ce programme fait partie du Plan national de recherche technique, scientifique et d’innovation 2008-2011, cofinancé par des fonds FEDER (Fonds européen de développement régional) de l’Union européenne (PI11/02220). Ministère de l’économie et de la compétitivité par le biais de l’Institut Carlos III de la santé (RedIAPP RD12/0007) et des fonds FEDER Generalitat de Catalunya par le biais de l’AGAUR (A for Management of Universities and Research Grants) (2014 SGR 1225) (2014 SGR 902). M. Grau a été financé par une bourse Miguel Servet (Institut de santé Carlos III, ministère de l’Économie et de la Compétitivité, Espagne) (PI12/03287).
CONFLITS D’INTÉRÊTS
L. Pascual-Benito a reçu des honoraires de conférence d’Alter. A. Martínez-Castelao a reçu des honoraires de consultation/des conseils consultatifs rémunérés de Boëhringer-Ingelheim, et des honoraires de conférence de et Boëhringer-Ingelheim.
- –
Les individus ayant un DFGe
mL/min/1,73 m2 présentent un risque cardiovasculaire accru. La prévalence de la diminution du DFGe augmente progressivement avec l’âge, pouvant atteindre 50 % chez les personnes âgées de plus de 80 ans. Le débat se poursuit sur la signification clinique des réductions plus légères et plus fréquentes (DFGe de 45 à 59mL/min/1,73 m2) chez les personnes âgées. En outre, les études menées dans des régions où l’incidence des maladies coronariennes est faible n’ont pas inclus de personnes âgées de plus de 74 ans ou n’ont pas fourni d’informations détaillées sur les différents groupes d’âge.QU’APPORTE CETTE ÉTUDE ?
- –
Dans une population d’individus âgés de ≥ 60 ans résidant dans un pays à faible risque cardiovasculaire, le risque d’ACM et de toute CVE augmentait progressivement avec la diminution du DFGe, à la fois chez les personnes âgées de 60 à 74 ans et chez les personnes âgées de ≥ 75 ans, indépendamment des autres facteurs de risque et des maladies cardiovasculaires. Cependant, les HR dans le groupe d’âge le plus élevé sont devenus significatifs pour un DFGe inférieur à 60. L’augmentation du risque de mortalité associée au DFGe était plus élevée dans le groupe des 60 à 74 ans que dans le groupe des ≥ 75 ans, mais était similaire pour le risque d’EVE.
.