L’immunofluorescence (IF) est une approche morphologique commune utilisée pour déterminer la distribution des composants subcellulaires. Les anticorps qui sont conjugués avec des colorants fluorescents sont nécessaires dans le test IF. L’anticorps reconnaît spécifiquement l’antigène en se liant à l’épitope de la cible, et le fluorophore sera détecté sous un microscope à fluorescence. Ainsi, les composants subcellulaires peuvent être visualisés sur un fond sombre. L’IF peut également être utilisée comme une méthode alternative d’analyse semi-quantitative pour surveiller l’expression de l’intérêt.
Il existe trois types d’IF : l’IF directe, l’IF indirecte et l’IF combinée.
L’IF directe utilise un seul anticorps primaire qui est conjugué à un colorant fluorescent.
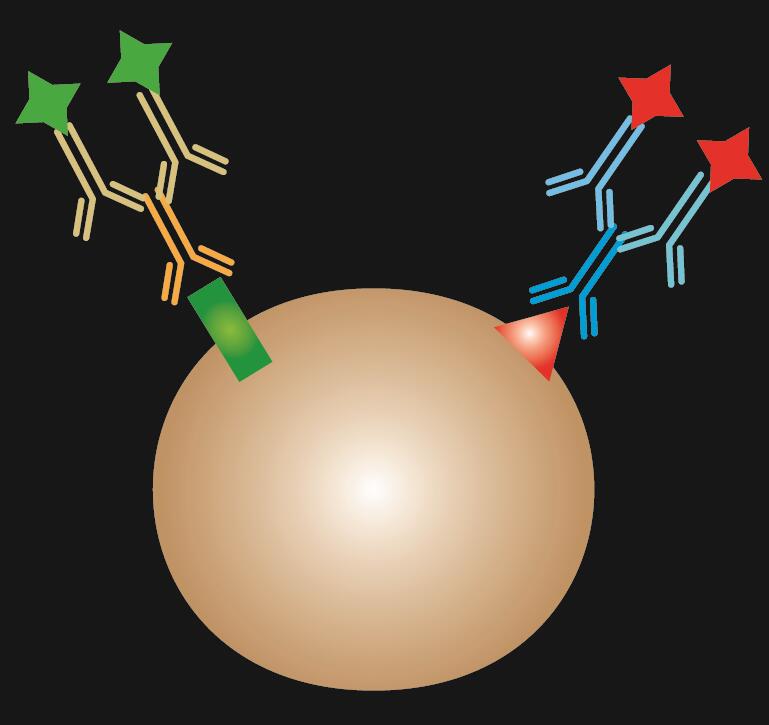
L’IF indirecte utilise deux anticorps pour la coloration : un anticorps primaire qui se lie spécifiquement à l’épitope et un anticorps secondaire apparié conjugué à un colorant fluorescent.
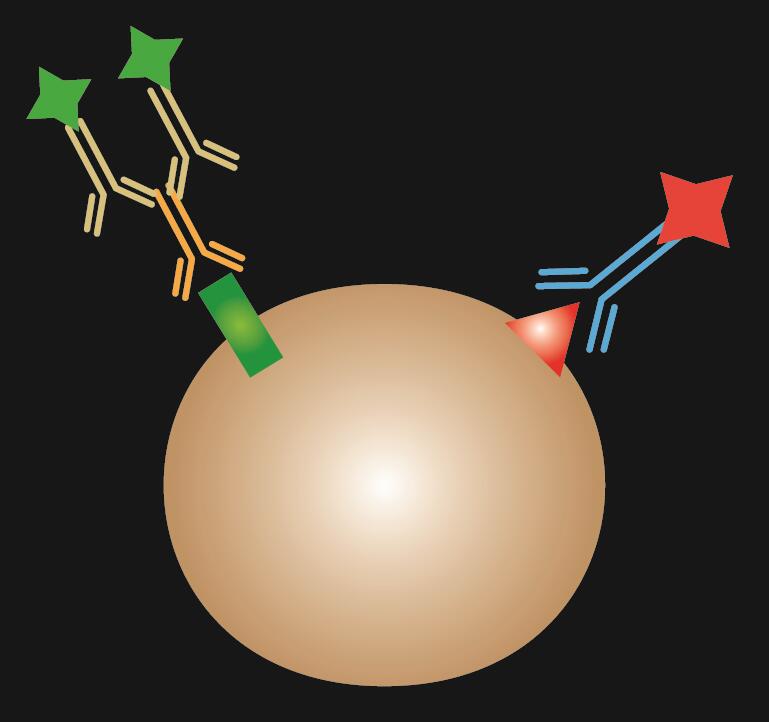
L’IF combinée est une combinaison de la coloration par IF directe et indirecte.
Tableau 1. Comparaison de l’IF directe, indirecte et combinée.
| Type d’IF | Direct | Indirect | Combiné |
|---|---|---|---|
| Diagramme schématique | 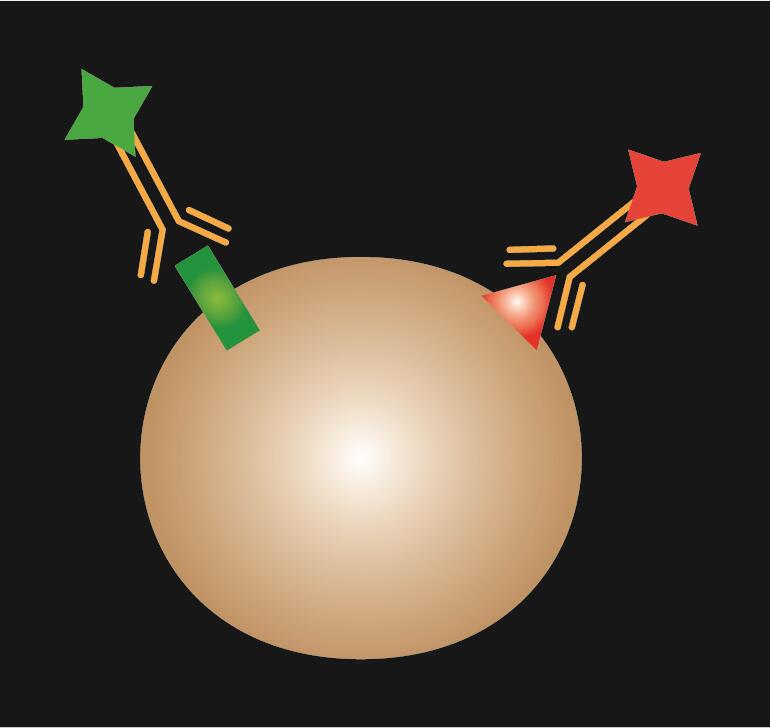 |
.  |
 |
| Avantages |
|
. |
|
| Inconvénients |
|
|
|
Parmi les trois types d’IF, la méthode d’IF indirecte est la plus populaire.
L’approche IF peut être utilisée sur des coupes de tissus, des lignées cellulaires cultivées et des cellules individuelles. Le processus de l’IF est similaire à l’immunohistochimie (IHC).
- Collection et fixation des échantillons
Les échantillons doivent être fixés rapidement après le retrait des tissus, et il est préférable de réaliser une préfixation par perfusion cardiaque avec du formaldéhyde à 4% ou du paraformaldéhyde chez les petits animaux comme les rongeurs. Il est recommandé que les tissus ne soient pas plus épais que 10 mm et le volume du fixateur doit être au moins 15 à 20 fois supérieur au volume du tissu. La fixation est très importante pour conserver la morphologie et la structure de la cellule ainsi que l’intégrité de l’antigène. Ainsi, les solutions de fixation doivent être soigneusement choisies en fonction des différents antigènes et échantillons de tissus.
Tableau 2. Stratégie de fixation pour les antigènes partiels.
| Antigène | Solution de fixation | Condition de fixation |
|---|---|---|
| Plus de protéines | 95~100%. alcool 4% paraformaldéhyde |
3~10 min à 37℃ 4~24 h à 4℃ |
| Enzyme | Acétone | 15 min à RT |
| Hormone | Acool à 95 % plus acide acétique glacial à 1~5 % | 30 min à 4℃ |
| Globuline immune | Acool à 95 % Carbone tétrachlorure |
10 min à 37℃ puis 15 min à 4℃ |
| Protéine fibreuse | 95% alcool plus 1~5% acide acétique glacial | 10 min à 37℃ puis 15 min à 4℃ |
| Virus | Acétone Tétrachlorure de carbone Alcool |
5~10 min à RT puis 30~60 min à 4℃ |
| Polysaccharide et bactéries | Acétone 10% formaldéhyde Méthanol |
3~10 min à RT puis 30~60 min à 4℃ |
| Lipoïde | Formaldéhyde à 10% | 3~10 min à RT |
| Cellule cultivée | Paraformaldéhyde à 4% | 15~20 min à chaud. à RT |
- Déshydratation et enrobage
La déshydratation est nécessaire lors de la préparation des coupes de tissus pour les raisons suivantes :
1. Coupe en paraffine : La paraffine est immiscible à l’eau.
2. section congelée : Des cristaux de glace gelés-décongelés détruiraient la morphologie des cellules.
La déshydratation est toujours effectuée en immergeant le tissu dans une série de solution d’éthanol à gradient croissant ou de solution de saccharose.
Par la suite, les échantillons de tissus peuvent être enrobés en ajoutant de la paraffine fondue pour les sections en paraffine, tandis que le composé OCT est ajouté pour les sections congelées. Cette étape permet d’obtenir une dureté appropriée pour les échantillons de tissus mous et permet de couper le tissu facilement.
- Section et coloration
Les tissus enrobés peuvent être sectionnés en tranches fines avec un microtome ou un microtome de congélation. L’épaisseur des tranches doit être décidée en fonction du diamètre cellulaire et de l’objectif du test IF. Les tranches plus fines (≤10 μm) sont suggérées pour être montées directement sur des lames adhésives avant la coloration, car elles sont faciles à détacher lors des multiples étapes de lavage. Les tranches plus épaisses (10~30 μm) obtiendront de meilleures images en utilisant la méthode de flottaison libre, car l’anticorps primaire pourrait pénétrer à travers les deux côtés de la tranche. Les coupes flottantes sont montées sur des lames après coloration. Les coupes flottantes de petits tissus tels que les racines des ganglions dorsaux (DRG) de la souris sont difficiles à réaliser et il est facile de perdre l’échantillon. Ainsi, la méthode de la section en bâton est recommandée pour certains petits échantillons de tissus. Les étapes de coloration doivent être réalisées dans l’obscurité lorsqu’un anticorps conjugué à un colorant fluorescent est impliqué.
Prendre connaissance des protocoles IF:
- Section en bâtonnet
- Section flottante libre
- Cellules en culture
- Imagerie et analyse
La signalisation positive est virtualisée sous un microscope fluorescent dans un fond sombre. La localisation d’intérêt est déterminée généralement par la coloration conjointe d’une protéine dont la localisation est connue. On peut aussi mesurer la quantité de cellules positives ou l’intensité de fluorescence de la signalisation positive pour une analyse quantitative. Par exemple, l’intensité de fluorescence plus forte fait référence à une expression relativement élevée de la protéine cible.
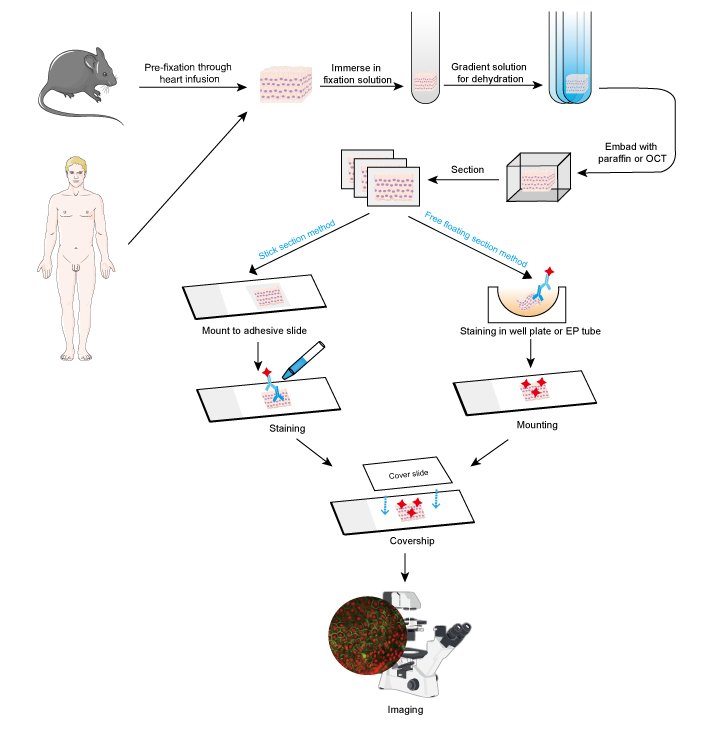
Figure 1. Flux de travail de l’IF sur des sections de tissus.
L’IF et l’IHC sont toutes deux des approches puissantes pour l’analyse morphologique avec des applications diagnostiques et pronostiques importantes. Plusieurs différences doivent être concernées dans vos recherches :
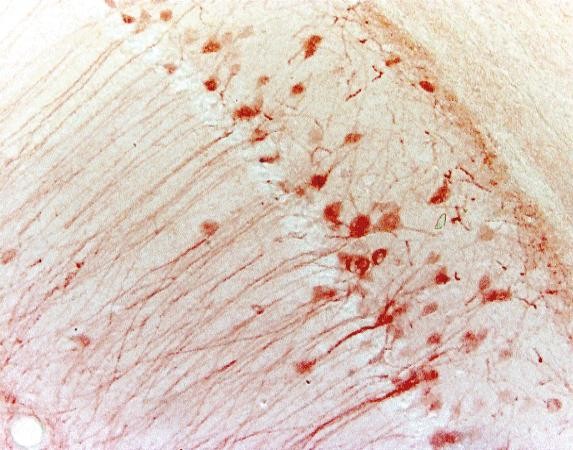
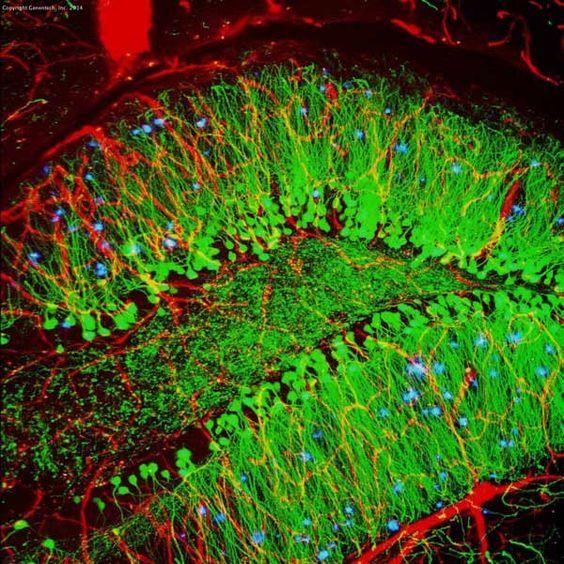
Tableau 3. Comparaison entre IHC et IF
| IHC | IF | |
|---|---|---|
| Méthode de marquage | Chromogène | Fluorescent |
| Étape de traitement | Plus car substrat nécessaire | Moins |
| Image |
|
|
| Microscope | Microscope à lumière | Microscope à fluorescence |
| Stabilité | Stable pendant ans | Moins stable à cause du photoblanchiment |
| Exemple (hippocampe de souris) |
 |
 |
.