La voie de l’apoptose par la perforine et le granzyme est la principale voie de signalisation utilisée par les lymphocytes cytotoxiques pour éliminer les cellules infectées par un virus et/ou transformées. Des études menées sur des souris dont le gène est perturbé indiquent que la perforine, en combinaison avec le granzyme, pourrait induire l’apoptose. Elle est vitale pour la fonction effectrice cytotoxique et a un rôle indispensable, mais non défini, dans l’apoptose médiée par le granzyme.
Perforine et Granzyme
La perforine est une protéine formant des pores et également connue sous le nom de toxines de granules cytoplasmiques. Le granzyme est une famille de sérine-protéases structurellement apparentées stockées dans les granules cytotoxiques des lymphocytes cytotoxiques (CL). La perforine et le granzyme induisent l’apoptose des cellules cibles de manière coopérative (Figure 1). Le granzyme est nécessaire pour déclencher l’apoptose des cellules cibles, mais il doit être délivré de manière appropriée par la perforine. La perforine et le granzyme se fixent tous deux à la surface des cellules cibles dans le cadre d’un complexe macromoléculaire unique associé à la serglycine, ce qui diminue encore la probabilité de diffusion passive des granzymes.
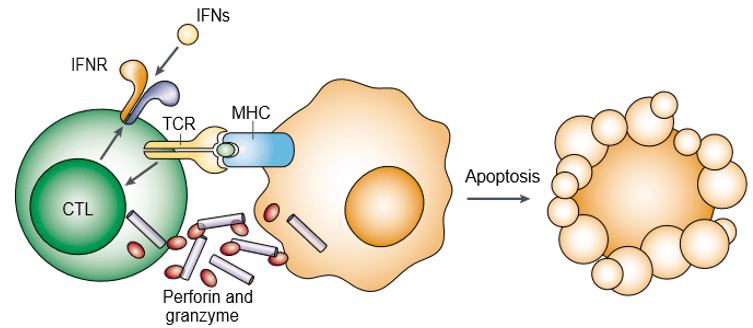
Figure 1. La perforine et le granzyme induisent l’apoptose des cellules cibles de manière coopérative.
Chez l’homme, on trouve les granzymes A, B, H, K et M, tandis que chez la souris, on trouve les granzymes A, B, C, D, E, F, G, K, L, M et N. Le granzyme A (GrA) et le granzyme B (GrB) sont les granzymes les plus abondants et ont été les plus étudiés. Les fonctions des granzymes A et B dans l’induction de l’apoptose des cellules cibles ont été largement étudiées in vitro, et elles sont mieux comprises que le rôle de la perforine au niveau moléculaire.
Processus et régulation de la voie d’apoptose de la perforine/du granzyme
Une fois sécrétés par les lymphocytes cytotoxiques, les granzymes pénètrent dans les cellules cibles, ce qui constitue une étape essentielle de la mort cellulaire. Les principales protéines lytiques emballées dans les granules sont différents granzymes et la protéine perforine formant des pores, qui facilite l’internalisation des granzymes par les cellules.
Le granzyme B déclenche principalement l’activation des caspases de manière indirecte, plutôt que par transformation directe des caspases. Il y parvient en activant directement les membres pro-apoptotiques » BH3 seulement » de la famille BCL-2, comme l’agoniste de mort à domaine d’interaction BH3 (Bid). Le Bid et les protéines pro-apoptotiques Bax et/ou Bak de la famille BCL-2 entraînent la fuite de médiateurs mitochondriaux pro-apoptotiques, tels que le cytochrome c, dans le cytosol. La libération du cytochrome c active la pro caspase-9, et en se liant au facteur 1 d’activation de la protéase apoptotique (Apaf-1), la pro caspase-9 devient la caspase-9 mature, qui continue à former l’apoptosome et active la caspase-3 en aval. La caspase-3 activée est capable de cliver des substrats spécifiques comme l’ICAD (inhibiteur de la DNase activée par la caspase, CAD), ce qui permet au CAD de se déplacer vers le noyau pour fragmenter l’ADN. Outre Bid, le granzyme B peut inactiver Mcl-1, qui est un membre de la famille anti-apoptotique Bcl-2, pour libérer la protéine pro-anti-apoptotique de la famille Bcl-2, Bim, sur la membrane mitochondriale externe. Et le granzyme B peut également servir de médiateur à la caspase-3 effectrice et à la caspase-8 initiatrice pour réguler la voie de l’apoptose.
Contrairement au granzyme B, le granzyme M ne dépend pas de la mitochondrie pour réguler, mais le granzyme M peut activer le granzyme B par le clivage de l’inhibiteur de protéinase 9 (PI-9) qui est l’inhibiteur du granzyme B. Le granzyme M peut également cliver directement l’ICAD pour libérer le CAD comme le granzyme B.
Le granzyme A induit une perte de potentiel de la membrane interne mitochondriale et la libération d’espèces réactives de l’oxygène (ROS). Elle génère des entailles d’ADN simple brin, plutôt que des fragments d’ADN oligonucléosomique. En réponse aux ROS, le complexe SET associé au RE, comprenant SET, Ape1, pp32, HMG2, NM23-H1 et TREX1, se transloque vers le noyau, où le granzyme A clive trois membres du complexe SET qui sont impliqués dans la réparation de l’ADN : HMG2, Ape1 et SET.
La voie de l’apoptose par la perforine et le granzyme dans la maladie
Les études sur des souris dont le gène est perturbé indiquent clairement que la voie de la perforine est intimement impliquée dans la défense contre les pathogènes viraux et les cellules transformées. Mais des rôles insoupçonnés de la perforine comme médiateur crucial de la surveillance immunitaire des cellules spontanément transformées et dans la régulation de l’homéostasie des cellules B et de la mémoire des cellules T ont également été démontrés in vivo. Paradoxalement, la perforine joue un rôle dans la pathogenèse de certains modèles de maladies auto-immunes, comme le diabète insulinodépendant chez les souris diabétiques non obèses (NOD), mais elle pourrait supprimer d’autres maladies auto-immunes, notamment l’encéphalomyélite auto-immune expérimentale (EAE).
Les voies d’apoptose perforine/granzyme qui régulent la polarisation et l’exocytose des granules sont en cours de détermination, et ces voies pourraient être perturbées par l’interaction des cellules cancéreuses avec certains lymphocytes cytotoxiques. Les récentes découvertes selon lesquelles l’entrée des granzymes dans les cellules cibles implique la liaison à des récepteurs membranaires spécifiques et que certaines tumeurs synthétisent des inhibiteurs de la sérine protéase qui peuvent neutraliser les granzymes ont indiqué de nouveaux moyens potentiels par lesquels les tumeurs pourraient échapper à l’attaque immunitaire.