- Abstrait
- Mots clés
- Introduction
- Méthodes précoces de production de pigments
- Méthode à l’acide sulfurique
- Méthode de chloration
- Séparation du fer
- Procédé par four électrique
- Route hydrométallurgique
- Méthode à haute pression
- Procédé atmosphérique
- Oxyhydrolyse
- Oxyhydrolyse en lit fluidisé
- Oxyhydrolyse par pulvérisation
- Production de titane
Abstrait
L’ilménite de faible teneur peut être lixiviée avec du HCl concentré à la pression atmosphérique et à 80oC. Après filtration pour séparer les matières insolubles, la solution contenant TiO2+ et Fe2+ est chauffée pour précipiter l’hydroxyde de titane et récupérer le HCl. L’hydroxyde de titane est ensuite calciné pour obtenir du rutile synthétique contenant 95+% de TiO2 tandis que le FeCl2 est soumis à une oxyhydrolyse ou à une fluidisation pour récupérer HCl et Fe2O3. Ce procédé peut naturellement être appliqué à l’ilménite de haute qualité. Il contourne le procédé du four électrique qui ne s’applique qu’à l’ilménite de haute qualité et est supérieur au procédé à l’acide sulfurique qui est très polluant. Le produit de ce procédé peut être utilisé pour préparer le pigment blanc ainsi que le titane métallique.
Mots clés
Lixiviation HCl, procédé Magpei, Rutile synthétique, Oxyhydrolyse, Four électrique, Chloration, Procédé à l’acide sulfurique
Introduction
Les principaux minéraux de titane sont le rutile, TiO2 et l’ilménite, FeTiO3 (Figure 1 et 2). Le rutile est facile à transformer en titane métal ou en pigment de TiO2 par la méthode de chloration alors que l’ilménite est plus compliquée en raison de sa forte teneur en fer. Comme les réserves mondiales de titane sont à 90 % sous forme d’ilménite et à seulement 10 % sous forme de rutile, le traitement de l’ilménite est évidemment une question importante en métallurgie .

Figure 1 : échantillon de musée de rutile, ~ 90 % TiO2

Figure 2 : échantillon de musée d’ilménite, FeTiO3 (59.4 % TiO2)
Les gisements d’ilménite peuvent être massifs comme dans la province de Québec (figure 3) ou sous forme de sables noirs (figure 4) associés à de la magnétite, de la monazite et d’autres minéraux précieux qui sont séparés par des méthodes physiques (figure 5). Dans la première séparation magnétique, un aimant faible est utilisé pour séparer la magnétite tandis que dans la deuxième séparation magnétique, un aimant à haute intensité est utilisé pour séparer l’ilménite.

Figure 3 : Un échantillon d’ilménite massive du Québec

Figure 4 : Sables de plage noirs comme en Inde
Méthodes précoces de production de pigments
Méthode à l’acide sulfurique
En 1916, la Titanium Pigment Corporation de Niagara Falls, New York, et la Titan Company de Norvège ont commencé simultanément la production commerciale de ce nouveau pigment blanc. A l’époque, les principaux pigments blancs utilisés dans les peintures étaient le plomb blanc, le blanc de zinc et le lithopone. Dans cette méthode, l’ilménite était traitée avec du H2SO4 concentré à 110-120°C pour former des sulfates de fer et de titanyle :
FeTiO3 + 4H+ → Fe2+ + TiO2+ + 2H2O
La réaction est conduite dans de grandes cuves en béton revêtues de briques résistant aux acides (figure 6), chauffées par injection directe de vapeur à haute pression ou dans un malaxeur (figure 7) . La masse solidifiée produite dans le réacteur à la fin de la réaction est ensuite évacuée du réacteur par dissolution dans l’eau ou dans un acide dilué. Après élimination du résidu insoluble par filtration, la solution contenant 120-130 g/L de TiO2 et 250-300 g/L de FeSO4 a été concentrée sous vide à 10°C pour cristalliser le FeSO4-7H2O qui a ensuite été centrifugé. L’oxyde de titane est ensuite précipité de la solution par dilution et ensemencement, ce qui entraîne la formation de H2SO4 dilué à éliminer (figures 8 et 9). Cependant, le plus grand producteur de pigments à Salvador, au Brésil, utilise encore cette technologie car il rejette les déchets dans l’océan qui sont enlevés par la marée.

Figure 5 : Bénéficiation des sables noirs pour récupérer ses composants précieux

Figure 6 : Grandes cuves en béton doublées de briques résistant aux acides
Figure 7 : Broyeur à boulets chauffé

Figure 8 : Production de pigment de TiO2 par le procédé de l’acide sulfurique

Figure 9 : Blanc de titane, ~ 100% TiO2
Méthode de chloration
DuPont aux USA produit le pigment depuis 1950 par chloration directe du minerai d’ilménite, séparation des produits par distillation fractionnée, puis oxydation du TiCl4 (Figure 10):

Figure 10 : Procédé simplifié de Du Pont pour la production de pigments à partir d’ilménite
2FeTiO3 + 7Cl2 + 3C → 2TiCl4 + 2FeCl3 + 3CO2
TiCl4 + O2 → TiO2 + 2Cl2
Le problème de ce procédé est la récupération du chlore à partir du chlorure ferrique ou la commercialisation des grandes quantités de ce coproduit.
Séparation du fer
En raison des problèmes de pollution liés à l’élimination de l’acide sulfurique dilué et du FeSO4, le fer contenu dans le minerai est séparé à un stade précoce. Ceci est réalisé de deux manières : par four électrique et par des voies hydrométallurgiques.
Procédé par four électrique
La méthode par four électrique a été développée dans les années 1950 . Le minerai était mélangé à une certaine quantité d’anthracite juste suffisante pour réduire le composant oxyde de fer du minerai, puis chargé dans un four électrique à 1 650°C où l’oxyde de fer est réduit en métal tandis que le titane est séparé sous forme de scories (Figure 11). Les réactions qui ont lieu pendant la réduction sont les suivantes :

Figure 11 : Procédé de séparation du fer dans un four électrique
FeTiO3 + C → Fe + CO + TiO2(scories)
Fe2O3 + 3C → 2Fe + 3CO
Cette méthode est utilisée par la Rio Tinto QIT dans son usine de Sorel près de Montréal et à Richards Bay en Afrique du Sud. Elle est également utilisée en Union soviétique à Zaporozhye (Ukraine) et au Japon.
Les scories de titane sont principalement du titanate de fer et de magnésium, (Fe,Mg)Ti4O10, et une petite quantité de silicates ; les analyses typiques sont de 72 à 85% de TiO2 total. Une petite quantité de TiO2 est réduite en Ti2O3. La réduction des oxydes de fer n’est pas menée à son terme, de sorte qu’une partie de l’oxyde de fer reste dans le laitier pour diminuer son point de fusion. Le point de fusion du TiO2 est de 1840°C et celui de l’ilménite de 1435°C.
Le laitier est riche en titane et pauvre en fer (figure 12) et est donc préférable à l’ilménite pour la fabrication de pigment de TiO2 ou de titane métal. Cependant, le laitier produit au Québec ne convient pas à la chloration en raison de son taux élevé d’impuretés – environ 16,6 % contre environ 6 % pour les autres laitiers . Ces impuretés vont non seulement consommer des quantités inutiles de chlore mais aussi créer un problème d’élimination. En outre, certaines de ces impuretés, par ex, le calcium et le magnésium, interféreront avec le processus de chloration lui-même qui est mené à 800°C en formant une phase fondue (CaCl2 m.p. 770°C, MgCl2 m.p. 708°C).

Figure 12 : Scorie de titane broyée, FeTi4O10 (70-80 % TiO2)
Pour ces raisons, la scorie de titane n’a été utilisée que pour la fabrication de pigment par le procédé à l’acide sulfurique . Les scories ont été traitées de la même manière que l’ilménite, à l’exception du fait qu’aucune séparation du sulfate ferreux n’était nécessaire car la majeure partie du fer était déjà séparée par réduction dans l’étape précédente (figure 13). Le procédé de traitement des scories à l’acide sulfurique souffrait cependant toujours du problème de l’élimination de l’acide usé et, par conséquent, il a été abandonné dans les années 1980 et remplacé par une nouvelle technologie basée sur la valorisation des scories à 94,5% de TiO2 par lixiviation de la plupart des impuretés par HCl sous pression pour les rendre aptes à la chloration.

Figure 13 : Lixiviation de scories de titane pour la production de pigment TiO2, aujourd’hui obsolète
Route hydrométallurgique
La voie hydrométallurgique a été développée dans les années 1960 et consistait à lixivier le fer de l’ilménite et à obtenir un résidu riche en titane (90-95% TiO2) connu sous le nom de « rutile synthétique » . Dans un cas, le procédé Altair, on a obtenu un TiO2 de qualité pigmentaire. Tous ces procédés utilisent un procédé d’oxyhydrolyse pour traiter le chlorure ferreux afin d’obtenir du HCl à recycler et du Fe2O3 comme sous-produit.
Méthode à haute pression
Dans cette méthode, l’ilménite de haute qualité est décomposée dans des autoclaves par 20% de HCl à 120°C et 200 kPa ; le fer est solubilisé sous forme de chlorure ferreux laissant un solide contenant environ 95% de TiO2 qui a l’analyse chimique du rutile que us pourquoi il est appelé rutile synthétique (Figure 14) :

Figure 14 : Rutile synthétique
FeTiO3 + 2H+ → TiO2 + Fe2+ + H2O
L’ilménite de faible qualité ne peut pas être traitée par cette méthode car tous les silicates et les matières insolubles contamineront le produit. Le rutile synthétique est ensuite traité par le chlore pour préparer du TiCl4 à partir duquel on obtient du TiO2 ou du titane métal sans problème de pollution. Ce procédé est utilisé aux États-Unis, en Angleterre, au Japon, à Taïwan et en Australie. L’oxyhydrolyse pourrait être réalisée de différentes manières décrites ci-dessous.
Procédé atmosphérique
En 2014, il a été constaté par Magpie Incorporation au Canada que l’ilménite de basse qualité peut être dissoute à 80°C avec du HCl concentré à pression atmosphérique. Après filtration pour éliminer les matières insolubles, la solution est distillée pour récupérer le HCl et hydrolyser l’ion titanyle en TiO2. Après filtration, le résidu est calciné pour produire du rutile synthétique (figure 16):

Figure 15 : Production de rutile synthétique à partir d’ilménite

Figure 16 : Production de 98+% de TiO2 à partir d’une ilménite de basse qualité
FeTiO3 + 4HCl → TiO2+ + Fe2+ + 4Cl- + 2H2O
TiO2+ + 2Cl- + H2O → TiO2 + 2HCl
Il est évident que la nouvelle technologie de lixiviation à pression ambiante est supérieure à l’ancienne fusion au four électrique – valorisation en autoclave.
Oxyhydrolyse
La solution de chlorure ferreux est régénérée en HCl et Fe2O3 par oxyhydrolyse :
2FeCl2 + 2H2O + 1/2O2 → Fe2O3 + HCl
C’est la même technologie qui est utilisée pour le traitement de la solution de cornichons. Deux méthodes sont utilisées
Oxyhydrolyse en lit fluidisé
Dans un réacteur à lit fluidisé, la solution de chlorure ferreux est introduite sur un grand lit d’oxyde ferrique chaud où le chauffage est assuré par les gaz de combustion chauds de fluidisation (figure 17). Lorsque le gaz de combustion traverse le lit d’oxyde bien agité, il atteint rapidement l’équilibre thermique avec le lit. La solution est introduite par-dessus le lit d’oxydes. L’alimentation liquide mouille la couche externe des particules d’oxyde chaudes et est rapidement évaporée pour former une couche en oignon de nouvel oxyde solide sur l’oxyde existant, produisant ainsi des particules homogènes denses.

Figure 17 : Réacteur à lit fluidisé pour l’oxyhydrolyse du chlorure ferreux
Oxyhydrolyse par pulvérisation
Dans ce type de torréfacteur à oxyhydrolyse, la solution de chlorure ferreux est pulvérisée dans un récipient cylindrique vide, tandis que l’énergie requise est fournie par le flux ascendant de gaz chauds générés dans les brûleurs inférieurs (figure 18). Les torréfacteurs à pulvérisation ont de grands diamètres pour maintenir les vitesses des gaz à un faible niveau. Si la vitesse du gaz est élevée, trop de particules sont éludées avec les effluents gazeux, et la qualité du produit et l’efficacité du torréfacteur diminuent. Les effluents gazeux et les oxydes quittent le four à contre-courant à une température d’environ 400°C à 500°C. Le temps de séjour des particules pulvérisées dans la zone de réaction à haute température est très court ; il faut donc créer par atomisation de très petites gouttelettes de liquide, qui peuvent être chauffées rapidement. Le chauffage rapide entraîne la formation d’une croûte d’oxyde solide à la surface de chaque gouttelette. Lorsque la masse de la gouttelette se réchauffe, l’eau contenue se vaporise et perce la coquille d’oxyde. Par conséquent, l’oxyde grillé par pulvérisation est composé de très fines sphères creuses « duveteuses ».

Figure 18 : Régénération de HCl à partir d’une solution de chlorure ferreux par oxyhydrolyse dans un torréfacteur par pulvérisation
Production de titane
Le titane métallique est produit par chloration de rutile, de rutile synthétique ou de scories de titane puis réduction dans un réacteur métallothermique de TiCl4 par du magnésium en titane (figures 19 et 20) :
TiO2 + C + 2Cl2 → TiCl4 + CO2
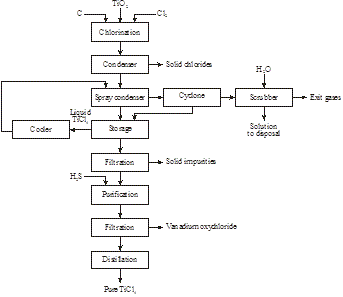
Figure19 : Production de TiCl4 à partir de rutile, de rutile synthétique ou de scories de titane

Figure 20 : Production de titane à partir de TiCl4
TiCl4 + Mg → Ti + MgCl2
Le chlorure de magnésium est ensuite électrolysé pour récupérer le magnésium et le chlore qui seront recyclés. La figure 21 montre le réacteur métallothermique retiré du four après réduction dont on récupère l’éponge de titane (figure 22).

Figure 21 : réacteur métallothermique retiré du four

Figure 22 : éponge de titane (en haut) et MgCl2 (en bas) retirés du réacteur
- Barksdale J (1966) Titanium, Its Occurrence, Chemistry and Technology, Ronald Press, New York.
- Sibum H (1997) « Titanium », pp. 1129-1179 in Handbook of Extractive Metallurgy edited by F. Habashi, published by WILEY-VCH, Weinheim, Germany.
- Habashi F (1993) A Textbook of Hydrometallurgy (2ndedtn). Métallurgie Extractive Québec, Québec, Canada.
- DuPont (2007) Brochure™ Ti-Pure® titanium dioxide.
- Habashi F (2002) Textbook of Pyrometallurgy, Métallurgie Extractive Québec, Québec, Canada.
- Toromanoff I, Habashi F (1985) Transformation of a Low-Grade Titanium Slag into Synthetic Rutile Intern. J. Mineral Processing 15 : 65-81
- Habashi F (1996) Problèmes de pollution dans les industries minérales et métallurgiques, Métallurgie Extractive Québec, Québec.
- Habashi F (1993) Hydrométallurgie sous pression (2eedtn). Métallurgie Extractive Québec, Québec, Canada.
- Habashi F, Kamaleddine F, Bourricaudy E (2015) A New Process to Upgrade Ilmenite to Synthet-ic Rutile Proceedings Conference of Metallurgists, Canadian Institute of Mining, Metallurgy, and Petroleum, Montreal. Réimprimé dans Metall 69 : 27-30
- Habashi F (1993) Deux cents ans de titane. Le traitement des minerais de titane pour la production de pigments et de métaux. Arab Min J 11 : 74-84