Contenu
- 1 Introduction
- 2 Points saillants structurels
- 3. Fonction
- 4 Pertinence pour la santé humaine & Maladie
- 5 Liens externes
Introduction
Lipase gastrique humaine (HGL, E.C. 3.1.1.3) (PBD ID : 1hlg) est la lipase qui est responsable de l’initiation de la digestion des graisses alimentaires dans l’estomac . Cette enzyme stable en milieu acide est sécrétée par les cellules principales de l’estomac humain et catalyse 10 à 20 % des processus lipolytiques totaux (c’est-à-dire ceux qui impliquent la dégradation des graisses) chez les adultes en bonne santé. L’HGL catalyse spécifiquement l’hydrolyse du triacylglycérol afin de produire du diacylglycérol et un sous-produit carboxylate, un processus qui facilite la dégradation ultérieure des graisses par la lipase pancréatique. En termes d’implications pathologiques, il existe des preuves suggérant que la sécrétion d’HGL est altérée chez les individus souffrant de gastrite (l’affection gastrique la plus courante, dans laquelle la paroi de l’estomac est enflammée). En outre, les personnes dont la fonction pancréatique est compromise (et donc les niveaux réduits de lipase pancréatique) doivent dépendre fortement de l’HGL pour digérer les graisses alimentaires .
Les points forts de la structure
L’HGL, une enzyme hydrolase composée de deux sous-unités de 379 résidus d’acides aminés, possède une qui contient les résidus Ser-153, His-353 et Asp-324. Cette structure est essentielle à la dégradation des lipides, coordonnée avec un résidu Leu-67 et Gln-154, qui sert à stabiliser l’état de transition. Sur le plan structurel, la lipase gastrique humaine présente un complexe (les feuillets bêta sont représentés en jaune, les hélices alpha en orange, les bobines enroulées en vert et les hydrates de carbone résolus en violet). Le de HGL aux résidus 215-244 laisse place aux (régions hydrophobes notées en rouge) entourant à la fois le site actif et l’interface du couvercle. On pense que ces régions attirent les lipides et favorisent le docking .
Fonction
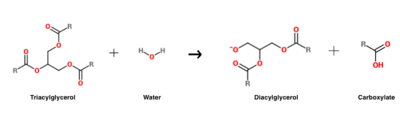
La réaction d’hydrolyse du triacylglycérol qui est catalysée par l’HGL .
L’HGL fonctionne à un pH optimal d’environ cinq, et catalyse principalement l’hydrolyse des triacylglycérols à chaîne courte .
En tant qu’estérase avec une sérine catalytiquement active, l’HGL présente un mécanisme ressemblant au mécanisme établi de la sérine estérase. La sérine du site actif, située dans le , est facilitée d’abord par la formation voisine d’un pont salin entre Asp-136 et His-152, qui induit l’appropriation d’un proton de Ser-153. Le Ser-153, maintenant hautement nucléophile, va attaquer le carbone carbonyle du groupe acétate dans une molécule de triacylglycérol. L’espèce tétraédrique est stabilisée par le trou de l’oxyanion. Cependant, dès que l’espèce se désassemble en acétate et lipase liés de manière covalente, la sérine subit une désacylation dans laquelle l’eau agit comme nucléophile. Cette étape finale ramène la Ser-153 à son état protoné .
Pertinence pour la santé humaine & Maladie
L’action hydrolytique de l’HGL est quelque peu accessoire chez les adultes en bonne santé, chez qui l’HGL module 10 à 20% de la dégradation des graisses alimentaires au maximum . Cependant, la présence de l’HGL est cruciale chez les enfants prématurés, qui présentent souvent une mauvaise fonction pancréatique, ainsi que chez les adultes présentant une insuffisance pancréatique pathologique (par exemple, une pancréatite chronique). Ces individus sont incapables de produire des quantités adéquates de lipase pancréatique et doivent donc compter principalement sur l’HGL pour la digestion des graisses alimentaires. Chez ces personnes, l’HGL est responsable de l’hydrolyse de 30 à 60 % des triglycérides alimentaires .
Tomasik et al. (2013) ont étudié la régulation hormonale de la sécrétion d’HGL chez les enfants et les adolescents atteints de gastrite. L’activité de l’HGL a été comparée dans trois groupes : un groupe expérimental composé d’adolescents diagnostiqués avec une gastrite à Helicobacter pylori (n = 10), un autre groupe expérimental composé d’adolescents avec une forme de gastrite non induite par H. pylori (n = 10), et un groupe témoin d’adolescents en bonne santé (n = 14). L’activité de l’HGL, en plus des concentrations plasmatiques de glucagon-like peptide-1, de cholécystokinine et de peptide insulinotrope dépendant du glucose, ont été observées par l’analyse d’échantillons de jus gastrique qui avaient été recueillis par des mesures endoscopiques chez chaque patient.
Les patients dont la gastrite superficielle a été induite par des agents pathogènes autres que H. pylori ont présenté des niveaux plus faibles d’activité HGL par rapport aux adolescents sains (p < .005) et à ceux qui ont été diagnostiqués avec une gastrite à H. pylori (p < .005). Les concentrations plasmatiques moyennes de peptide insulinotrope dépendant du glucose étaient plus faibles chez les patients sains (p < 0,005) que chez ceux qui n’avaient pas de gastrite à H. pylori (p < 0,003) et ceux qui avaient une gastrite à H. pylori (p < 0,01). La régulation de la sécrétion de l’HGL par le glucagon-like peptide-1 (GLP-1) et la cholécystokinine (CCK) s’est donc avérée altérée chez les adolescents atteints de gastrite ; à l’appui de cette constatation, la littérature existante suggère que le GLP-1 et la CCK inhibent la sécrétion de l’HGL. En outre, le peptide insulinotrope dépendant du glucose s’est avéré être un puissant activateur de l’activité de la lipase gastrique humaine dans tous les groupes expérimentaux et de contrôle .
PDB – 1HLG : http://www.rcsb.org/pdb/explore.do?structureId=1HLG
.