L’Interleukine 12 (IL-12) est une cytokine pro-inflammatoire d’un poids moléculaire de 70 kDa composée de deux sous-unités, IL-12p35 (35 kDa) et IL-12p40 (40 kDa). La structure hétérodimérique unique est partagée avec trois membres de la famille, à savoir l’IL-23 (p19/p40), l’IL-27(p28/Ebi3) et l’IL-35 (p35/Ebi3).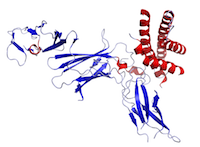
L’IL-12, également appelée IL-12p70, a été découverte indépendamment en 1989 par Kobayashi M. et al. (appelée facteur de stimulation des cellules tueuses naturelles) et en 1990 par Stern A.S. et al. (appelé facteur de maturation des lymphocytes cytotoxiques).
Cette figure est une structure de l’IL-12 créée en utilisant les données de la Protein Data Bank (PDB : 1F45) et rendue à l’aide de PyMOL.
L’IL-12 induit la différenciation des cellules T CD4+ naïves en cellules Th1 et active les cellules NK. Lors de l’activation, les cellules NK produisent de l’IFN-γ et de l’IL-2 mais aussi de l’IL-12 indiquant un mécanisme de rétroaction positive. L’IL-12 protège les cellules CD4+ Th1 de la mort apoptotique induite par les antigènes et on a constaté qu’elle avait des effets synergiques avec l’IL-18 dans le développement des cellules Th1. En outre, l’IL-12 joue un rôle dans le trafic et la migration des cellules T en induisant l’expression de molécules d’adhésion fonctionnelles telles que les ligands P et E-sélectine sur les cellules Th1 mais pas sur les cellules Th2. Par conséquent, les cellules Th1 sont sélectivement recrutées sur des sites favorisant une réponse immunitaire Th1. Sur le plan fonctionnel, ces cellules contribuent à la clairance des agents pathogènes intracellulaires, contrairement aux cellules Th2 qui sont responsables de l’immunité humorale en protégeant contre les envahisseurs extracellulaires. L’équilibre entre l’IL-12, favorisant les réponses Th1, et l’IL-4, favorisant les réponses Th2, détermine la préférence précoce exprimée dans la réponse immunitaire.
L’IL-12p35 partage une homologie de séquence substantielle avec la cytokine IL-6 tandis que la chaîne p40 est structurellement homologue au domaine extracellulaire de la chaîne α du récepteur de l’IL-6 (IL-6R). Ceci suggère que la structure de l’IL-12 a évolué à partir d’une cytokine primordiale de la famille IL-6 et de l’un de ses récepteurs. Bien que les transcrits de l’IL-12p35 soient présents dans de nombreux types de cellules, l’IL-12p35 libre n’est pas sécrétée sans la sous-unité IL-12p40. Cette dernière sous-unité est produite principalement par les monocytes, les macrophages, les neutrophiles et les cellules dendritiques activés. Les activités biologiques de l’IL-12p70 sont médiées par la liaison à un complexe récepteur membranaire (IL-12R) composé de deux sous-unités : IL-12R-β1 et IL-12R-β2. Alors que la sous-unité IL-12Rβ1 est exprimée de manière constitutive, l’expression de IL-12R-β2 sur les cellules Th1 est régulée par l’IFN-γ et est corrélée à la réactivité à l’IL-12. Lors de la liaison de l’IL-12, la voie de signalisation JAK-STAT est activée, STAT4 étant le médiateur prédominant des réponses des cellules T.
.