Dénomination générique : chlorhydrate de lopéramide
Formation posologique : capsules
Médicament revu par Drugs.com. Dernière mise à jour le 22 janvier 2021.
- Aperçu
- Effets secondaires
- Dosage
- Professionnel
- Interactions
- Plus
- Imodium Description
- Imodium – Pharmacologie clinique
- Indications et utilisation de l’Imodium
- Contre-indications
- Mises en garde
- Précautions
- Généralités
- Information pour les patients
- Interactions médicamenteuses
- Carcinogenèse, mutagenèse, altération de la fertilité
- Grossesse
- Grossesse catégorie C
- Mères allaitantes
- Utilisation pédiatrique
- Effets indésirables
- Données des études cliniques
- Expérience post-commercialisation
- Abus et dépendance
- Abus
- Dépendance
- Surdosage
- Dosage et administration de l’imodium
- Diarrhée aiguë
- Diarrhée chronique
- Enfants de moins de 2 ans
- Personnes âgées
- Insuffisance rénale
- Insuffisance hépatique
- Comment Imodium est-il présenté
- Frequently asked questions
- Plus d’informations sur Imodium (lopéramide)
- Ressources pour les consommateurs
- Ressources pour les professionnels
- Autres formulations
- Guides de traitement associés
Imodium Description
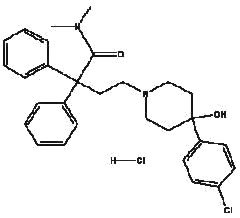
Imodium® (chlorhydrate de lopéramide), Le monochlorhydrate de 4-(p-chlorophényl)-4-hydroxy-N,N-diméthyl-a,a-diphényl-1-pipéridinebutyramide, est un antidiarrhéique synthétique à usage oral.
Imodium® est disponible en capsules de 2mg.
Les ingrédients inactifs sont : Lactose, amidon de maïs, talc et stéarate de magnésium. Les gélules d’Imodium® contiennent du jaune FD&C n° 6.
Imodium – Pharmacologie clinique
Les études in vitro et animales montrent que l’Imodium® (chlorhydrate de lopéramide) agit en ralentissant la motilité intestinale et en affectant le mouvement de l’eau et des électrolytes dans l’intestin. Le lopéramide se lie au récepteur opiacé de la paroi intestinale. Par conséquent, il inhibe la libération d’acétylcholine et de prostaglandines, réduisant ainsi le péristaltisme et augmentant le temps de transit intestinal. Le lopéramide augmente le tonus du sphincter anal, réduisant ainsi l’incontinence et l’urgence.
Chez l’homme, l’Imodium® prolonge le temps de transit du contenu intestinal. Il réduit le volume fécal quotidien, augmente la viscosité et la densité apparente, et diminue la perte de liquide et d’électrolytes. Aucune tolérance à l’effet antidiarrhéique n’a été observée. Les études cliniques ont indiqué que la demi-vie d’élimination apparente du lopéramide chez l’homme est de 10,8 heures avec une fourchette de 9,1 à 14,4 heures. Les concentrations plasmatiques du médicament inchangé demeurent inférieures à 2 nanogrammes par mL après la prise d’une capsule de 2 mg d’Imodium®. Les concentrations plasmatiques sont maximales environ cinq heures après l’administration de la capsule et 2,5 heures après celle du liquide. Les concentrations plasmatiques maximales de lopéramide étaient similaires pour les deux formulations. L’élimination du lopéramide se fait principalement par N-déméthylation oxydative. On pense que les isoenzymes du cytochrome P450 (CYP450), CYP2C8 et CYP3A4, jouent un rôle important dans le processus de N-déméthylation du lopéramide puisque la quercétine (inhibiteur du CYP2C8) et le kétoconazole (inhibiteur du CYP3A4) ont considérablement inhibé le processus de N-déméthylation in vitro, respectivement de 40 % et 90 %. En outre, les CYP2B6 et CYP2D6 semblent jouer un rôle mineur dans la N-déméthylation du lopéramide. L’excrétion du lopéramide inchangé et de ses métabolites se fait principalement par voie fécale. Chez les patients chez qui les paramètres biochimiques et hématologiques ont été surveillés pendant les essais cliniques, aucune tendance à l’anomalie n’a été notée pendant le traitement par Imodium®. De même, les analyses d’urine, l’ECG et les examens cliniques ophtalmologiques n’ont pas montré de tendances à l’anomalie.
Indications et utilisation de l’Imodium
L’Imodium® (chlorhydrate de lopéramide) est indiqué pour le contrôle et le soulagement symptomatique de la diarrhée aiguë non spécifique et de la diarrhée chronique associée aux maladies inflammatoires de l’intestin. Imodium® est également indiqué pour réduire le volume d’écoulement des iléostomies.
Contre-indications
Imodium est contre-indiqué chez les patients présentant une hypersensibilité connue au chlorhydrate de lopéramide ou à l’un des excipients.
Imodium est contre-indiqué chez les patients présentant des douleurs abdominales en l’absence de diarrhée.
Imodium n’est pas recommandé chez les nourrissons âgés de moins de 24 mois.
L’Imodium ne doit pas être utilisé comme traitement primaire :
– chez les patients atteints de dysenterie aiguë, qui se caractérise par la présence de sang dans les selles et une forte fièvre, – chez les patients atteints de colite ulcéreuse aiguë, – chez les patients atteints d’entérocolite bactérienne causée par des organismes invasifs, notamment Salmonella, Shigella et Campylobacter, – chez les patients atteints de colite pseudo-membraneuse associée à l’utilisation d’antibiotiques à large spectre.
Mises en garde
Une déplétion hydrique et électrolytique se produit souvent chez les patients qui ont la diarrhée. Dans de tels cas, l’administration de liquides et d’électrolytes appropriés est très importante. L’utilisation d’Imodium® n’exclut pas la nécessité d’un traitement approprié par des liquides et des électrolytes.
En général, Imodium ne doit pas être utilisé lorsque l’inhibition du péristaltisme doit être évitée en raison du risque possible de séquelles importantes, notamment l’iléus, le mégacôlon et le mégacôlon toxique. L’Imodium doit être interrompu rapidement en cas de constipation, de distension abdominale ou d’iléus.
Le traitement de la diarrhée par Imodium est uniquement symptomatique. Chaque fois qu’une étiologie sous-jacente peut être déterminée, un traitement spécifique doit être administré lorsque cela est approprié (ou lorsqu’il est indiqué).
Les patients atteints du SIDA traités par Imodium pour une diarrhée doivent voir leur traitement arrêté dès les premiers signes de distension abdominale. Des cas isolés de mégacôlon toxique ont été signalés chez des patients atteints du SIDA et souffrant de colite infectieuse due à des agents pathogènes viraux et bactériens traités par le chlorhydrate de lopéramide.
Imodium® doit être utilisé avec une prudence particulière chez les jeunes enfants en raison de la plus grande variabilité de la réponse dans ce groupe d’âge. La déshydratation, en particulier chez les jeunes enfants, peut influencer davantage la variabilité de la réponse à l’Imodium®.
Précautions
Généralités
Des réactions allergiques extrêmement rares, y compris une anaphylaxie et un choc anaphylactique, ont été rapportées. En cas de diarrhée aiguë, si une amélioration clinique n’est pas observée en 48 heures, l’administration d’Imodium® (chlorhydrate de lopéramide) doit être interrompue et les patients doivent être invités à consulter leur médecin. Bien qu’aucune donnée pharmacocinétique ne soit disponible chez les patients atteints d’insuffisance hépatique, Imodium doit être utilisé avec prudence chez ces patients en raison d’un métabolisme de premier passage réduit. Les patients présentant un dysfonctionnement hépatique doivent être surveillés de près afin de détecter tout signe de toxicité pour le SNC. Aucune donnée pharmacocinétique n’est disponible chez les patients atteints d’insuffisance rénale. Comme il a été signalé que la majorité du médicament est métabolisée et que les métabolites ou le médicament inchangé sont excrétés principalement dans les fèces, il n’est pas nécessaire d’ajuster la posologie chez les patients atteints d’insuffisance rénale. Aucune étude formelle n’a été menée pour évaluer la pharmacocinétique du lopéramide chez les sujets âgés. Cependant, dans deux études ayant inclus des patients âgés, il n’y a pas eu de différences majeures dans l’élimination du médicament chez les patients âgés souffrant de diarrhée par rapport aux jeunes patients.
Information pour les patients
Il faut conseiller aux patients de consulter leur médecin si leur diarrhée ne s’améliore pas en 48 heures ou s’ils notent la présence de sang dans leurs selles, développent une fièvre ou présentent une distension abdominale. Une fatigue, des étourdissements ou une somnolence peuvent survenir dans le cadre de syndromes diarrhéiques traités par Imodium. Par conséquent, il est recommandé de faire preuve de prudence lors de la conduite d’une voiture ou de l’utilisation de machines. (voir rubrique Effets indésirables).
Interactions médicamenteuses
Les données non cliniques ont montré que le lopéramide est un substrat de la glycoprotéine P. L’administration concomitante de lopéramide (16 mg en dose unique) avec une dose unique de 600 mg de quinidine, ou de ritonavir, tous deux inhibiteurs de la glycoprotéine P, a entraîné une augmentation de 2 à 3 fois des concentrations plasmatiques de lopéramide. En raison du risque d’augmentation des effets centraux lorsque le lopéramide est coadministré avec la quinidine et avec le ritonavir, la prudence est de mise lorsque le lopéramide est administré aux doses recommandées (2 mg, jusqu’à 16 mg de dose quotidienne maximale) avec des inhibiteurs de la glycoprotéine P.
Lorsqu’une dose unique de 16 mg de lopéramide est coadministrée avec une dose unique de 600 mg de saquinavir, le lopéramide a diminué l’exposition au saquinavir de 54%, ce qui peut avoir une pertinence clinique en raison de la réduction de l’efficacité thérapeutique du saquinavir. L’effet du saquinavir sur le lopéramide est de moindre importance clinique. Par conséquent, lorsque le lopéramide est administré avec le saquinavir, l’efficacité thérapeutique du saquinavir doit être étroitement surveillée.
Carcinogenèse, mutagenèse, altération de la fertilité
Dans une étude de 18 mois chez le rat avec des doses orales allant jusqu’à 40 mg/kg/jour (21 fois la dose maximale humaine de 16 mg/jour, sur la base d’une comparaison de la surface corporelle), il n’y a pas eu de preuve de cancérogenèse.
Le lopéramide n’était pas génotoxique dans le test d’Ames, le chromotest SOS chez E. coli, le test de létalité dominante chez les souris femelles ou le test de transformation des cellules d’embryon de souris.
La fertilité et la performance de reproduction ont été évaluées chez les rats en utilisant des doses orales de 2,5, 10 et 40 mg/kg/jour (femelles seulement) dans une deuxième étude. L’administration orale de 20 mg/kg/jour (environ 11 fois la dose humaine basée sur une comparaison de la surface corporelle) et plus a produit une forte altération de la fertilité des femelles. Le traitement de rats femelles avec jusqu’à 10 mg/kg/jour par voie orale (environ 5 fois la dose humaine basée sur une comparaison de surface corporelle) n’a eu aucun effet sur la fertilité. Le traitement de rats mâles avec 40 mg/kg/jour par voie orale (environ 21 fois la dose humaine basée sur une comparaison de surface corporelle) a produit une altération de la fertilité masculine, tandis que l’administration de jusqu’à 10 mg/kg/jour (environ 5 fois la dose humaine basée sur une comparaison de surface corporelle) n’a eu aucun effet.
Grossesse
Effets tératogènes
Grossesse catégorie C
Des études de tératologie ont été réalisées chez le rat en utilisant des doses orales de 2,5, 10 et 40 mg/kg/jour, et chez le lapin en utilisant des doses orales de 5, 20 et 40 mg/kg/jour. Ces études n’ont révélé aucun signe d’altération de la fertilité ou d’atteinte du fœtus à des doses allant jusqu’à 10 mg/kg/jour chez le rat (5 fois la dose humaine basée sur la comparaison de la surface corporelle) et 40 mg/kg/jour chez le lapin (43 fois la dose humaine basée sur la comparaison de la surface corporelle). Le traitement de rats avec 40 mg/kg/jour par voie orale (21 fois la dose humaine basée sur une comparaison de surface corporelle) a produit une altération marquée de la fertilité. Les études n’ont pas mis en évidence d’activité tératogène. Il n’existe pas d’études adéquates et bien contrôlées chez la femme enceinte. Le lopéramide ne doit être utilisé pendant la grossesse que si le bénéfice potentiel justifie le risque potentiel pour le ftus.
Effets non tératogènes
Dans une étude de reproduction péri et post-natale chez le rat, l’administration orale de 40 mg/kg/jour a produit une altération de la croissance et de la survie de la progéniture.
Mères allaitantes
De petites quantités de lopéramide peuvent apparaître dans le lait maternel humain. Par conséquent, l’Imodium n’est pas recommandé pendant l’allaitement.
Utilisation pédiatrique
Voir la section « Mises en garde » pour des informations sur la plus grande variabilité de la réponse dans ce groupe d’âge. En cas de surdosage accidentel d’Imodium® par des enfants, voir la section « Surdosage » pour le traitement suggéré.
Effets indésirables
Données des études cliniques
Les effets indésirables rapportés au cours des études cliniques sur Imodium® (chlorhydrate de lopéramide) sont difficiles à distinguer des symptômes associés au syndrome diarrhéique. Les effets indésirables enregistrés au cours des études cliniques avec Imodium® étaient généralement de nature mineure et autolimitative. Ils ont été plus fréquemment observés lors du traitement de la diarrhée chronique.
Les effets indésirables rapportés sont résumés indépendamment de l’évaluation de la causalité par les investigateurs.
1) Effets indésirables de 4 études contrôlées par placebo chez des patients souffrant de diarrhée aiguë
Les effets indésirables ayant une incidence de 1.0% ou plus, qui ont été rapportés au moins aussi souvent chez les patients sous chlorhydrate de lopéramide que sous placebo, sont présentés dans le tableau ci-dessous.
| Diarrhée aiguë | ||
|---|---|---|
| Chlorhydrate de lopéramide | Placebo | |
| No. de patients traités | 231 | 236 |
| Aspect gastro-intestinal | ||
| Constipation | 2,6% | 0.8 % |
Les effets indésirables dont l’incidence est supérieure ou égale à 1,0 %, et qui ont été plus fréquemment rapportés chez les patients sous placebo que sous chlorhydrate de lopéramide, sont : sécheresse buccale, flatulences, crampes abdominales et coliques.
2) Effets indésirables de 20 études contrôlées par placebo chez des patients souffrant de diarrhée chronique
Les effets indésirables ayant une incidence de 1,0% ou plus, qui ont été rapportés au moins aussi souvent chez les patients sous chlorhydrate de lopéramide que sous placebo, sont présentés ci-dessous dans le tableau ci-dessous.
| Diarrhée chronique | ||
|---|---|---|
| Chlorhydrate de lopéramide | Placebo | |
| No. de patients traités | 285 | 277 |
| Aspect gastro-intestinal | ||
| Constipation | 5.3% | 0,0% |
| Système nerveux central et périphérique AE% | ||
| Etourdissements | 1,4% | 0,7% |
Les effets indésirables ayant une incidence de 1.0% ou plus, qui ont été plus fréquemment rapportés chez les patients sous placebo que sous chlorhydrate de lopéramide étaient : nausées, vomissements, céphalées, météorisme, douleurs abdominales, crampes abdominales et coliques.
3) Effets indésirables de soixante-seize études contrôlées et non contrôlées chez des patients souffrant de diarrhée aiguë ou chronique
Les effets indésirables ayant une incidence de 1.0% ou plus chez les patients de toutes les études sont indiqués dans le tableau ci-dessous.
| Diarrhée aiguë | Diarrhée chronique | Toutes les études * | |
|---|---|---|---|
| * Tous les patients de toutes les études, y compris celles dans lesquelles il n’était pas précisé si les événements indésirables étaient survenus chez des patients atteints de diarrhée aiguë ou chronique. | |||
| No. de patients traités | 1913 | 1371 | 3740 |
| Evènements indésirables gastro-intestinaux% | |||
| Nausea | 0,7% | 3,2% | 1.8% |
| Constipation | 1,6% | 1,9% | 1,7% |
| Crampes abdominales | 0.5% | 3,0% | 1,4% |
Expérience post-commercialisation
Les effets indésirables suivants ont été rapportés :
Troubles de la peau et du tissu sous-cutané
Rash, prurit, urticaire, angioedème et cas extrêmement rares d’éruption bulleuse incluant un érythème polymorphe, syndrome de Stevens-Johnson et nécrolyse épidermique toxique ont été rapportés lors de l’utilisation d’Imodium
Désordres du système immunitaire
Des occurrences isolées de réactions allergiques et, dans certains cas, des réactions d’hypersensibilité sévères incluant un choc anaphylactique et des réactions anaphylactoïdes ont été rapportées lors de l’utilisation d’Imodium.
Troubles gastro-intestinaux
Bouche sèche, douleurs abdominales, distension ou inconfort, nausées, vomissements, flatulences, dyspepsie, constipation, iléus paralytique, mégacôlon, y compris mégacôlon toxique (voir rubriques Contre-indications et Mises en garde).
Troubles rénaux et urinaires
Rétention urinaire
Troubles du système nerveux
Dorosité, vertiges
Troubles généraux et anomalies au site administratif
Fatigue
Un certain nombre d’effets indésirables rapportés au cours des investigations cliniques et de l’expérience post-commercialisation avec le lopéramide sont des symptômes fréquents du syndrome diarrhéique sous-jacent (douleur/inconfort abdominal, nausées, vomissements, sécheresse de la bouche, fatigue, somnolence, vertiges, constipation et flatulences). Ces symptômes sont souvent difficiles à distinguer des effets indésirables du médicament.
Abus et dépendance
Abus
Une étude clinique spécifique destinée à évaluer le potentiel d’abus du lopéramide à fortes doses a permis de conclure à un potentiel d’abus extrêmement faible.
Dépendance
Des études chez des singes morphinodépendants ont démontré que le chlorhydrate de lopéramide à des doses supérieures à celles recommandées chez l’homme prévenait les signes de sevrage morphinique. Cependant, chez l’homme, le test de provocation de la pupille à la naloxone, qui, lorsqu’il est positif, indique des effets semblables à ceux des opiacés, effectué après une seule dose élevée ou après plus de deux ans d’utilisation thérapeutique d’Imodium® (chlorhydrate de lopéramide), s’est révélé négatif. L’Imodium® administré par voie orale (lopéramide formulé avec du stéarate de magnésium) est à la fois très insoluble et pénètre peu dans le SNC.
Surdosage
En cas de surdosage, (y compris le surdosage relatif dû à un dysfonctionnement hépatique), une rétention urinaire, un iléus paralytique et une dépression du SNC peuvent survenir. Les enfants peuvent être plus sensibles aux effets sur le SNC que les adultes. Des essais cliniques ont démontré qu’une bouillie de charbon activé administrée rapidement après l’ingestion de chlorhydrate de lopéramide peut réduire jusqu’à neuf fois la quantité de médicament absorbée dans la circulation générale. Si des vomissements se produisent spontanément lors de l’ingestion, une bouillie de 100 g de charbon actif doit être administrée par voie orale dès que les liquides peuvent être retenus.
Si les vomissements ne se sont pas produits, un lavage gastrique doit être effectué suivi de l’administration de 100 g de la bouillie de charbon actif par la sonde gastrique. En cas de surdosage, les patients doivent être surveillés pour des signes de dépression du SNC pendant au moins 24 heures.
Si des symptômes de surdosage apparaissent, la naloxone peut être administrée comme antidote. S’il répond à la naloxone, les signes vitaux doivent être surveillés attentivement pour détecter la réapparition des symptômes de surdosage du médicament pendant au moins 24 heures après la dernière dose de naloxone.
En raison de l’action prolongée du lopéramide et de la courte durée (une à trois heures) de la naloxone, le patient doit être surveillé de près et traité à plusieurs reprises avec la naloxone, comme indiqué. Comme relativement peu de médicament est excrété dans l’urine, on ne s’attend pas à ce que la diurèse forcée soit efficace pour le surdosage d’Imodium® (chlorhydrate de lopéramide).
Dans les essais cliniques, un adulte qui a pris trois doses de 20 mg dans une période de 24 heures a eu des nausées après la deuxième dose et a vomi après la troisième dose. Dans des études conçues pour examiner le potentiel d’effets secondaires, l’ingestion intentionnelle d’une dose unique allant jusqu’à 60 mg de chlorhydrate de lopéramide chez des sujets sains n’a entraîné aucun effet indésirable significatif.
Dosage et administration de l’imodium
(1 capsule = 2 mg)
Les patients doivent recevoir un remplacement approprié des liquides et des électrolytes, si nécessaire.
Diarrhée aiguë
Adultes : La dose initiale recommandée est de 4mg (deux capsules) suivie de 2 mg (une capsule) après chaque selle non formée. La dose quotidienne ne doit pas dépasser 16mg (huit capsules). Une amélioration clinique est généralement observée dans les 48 heures.
Enfants : Chez les enfants de 2 à 5 ans (20 kg ou moins), il faut utiliser la formulation liquide en vente libre (Imodium® A-D 1 mg/7,5 mL) ; pour les enfants de 6 à 12 ans, on peut utiliser soit les capsules Imodium®, soit l’Imodium® A-D liquide. Pour les enfants de 2 à 12 ans, le calendrier suivant pour les capsules ou le liquide répondra habituellement aux besoins posologiques initiaux :
Cadre posologique recommandé pour le premier jour
De deux à cinq ans : 1 mg t.i.d. (3mg dose quotidienne) (13 à 20 kg)
Six à huit ans : 2 mg b.i.d. (4mg dose quotidienne) (20 à 30 kg)
Huit à douze ans : 2mg t.i.d. (6mg dose quotidienne) (plus de 30 kg)
Dose quotidienne subséquente recommandée
Après le premier jour de traitement, il est recommandé d’administrer les doses subséquentes d’Imodium® (1 mg/10 kg de poids corporel) uniquement après une selle molle. La dose quotidienne totale ne doit pas dépasser les doses recommandées pour le premier jour.
Diarrhée chronique
Enfants : Bien que l’Imodium® ait été étudié chez un nombre limité d’enfants souffrant de diarrhée chronique ; la dose thérapeutique pour le traitement de la diarrhée chronique dans une population pédiatrique n’a pas été établie.
Adultes : La dose initiale recommandée est de 4 mg (deux capsules) suivie de 2 mg (une capsule) après chaque selle non formée jusqu’à ce que la diarrhée soit contrôlée, après quoi la dose d’Imodium® doit être réduite pour répondre aux besoins individuels. Lorsque la dose quotidienne optimale a été établie, cette quantité peut alors être administrée en une seule dose ou en doses fractionnées.
La dose d’entretien quotidienne moyenne dans les essais cliniques était de 4 à 8 mg (deux à quatre capsules). Une posologie de 16 mg (huit gélules) a rarement été dépassée. Si une amélioration clinique n’est pas observée après un traitement de 16 mg par jour pendant au moins 10 jours, il est peu probable que les symptômes soient contrôlés par une nouvelle administration. L’administration d’Imodium® peut être poursuivie si la diarrhée ne peut être contrôlée de manière adéquate par un régime alimentaire ou un traitement spécifique.
Enfants de moins de 2 ans
L’utilisation d’Imodium chez les enfants de moins de 2 ans n’est pas recommandée. De rares cas d’iléus paralytique associés à une distension abdominale ont été rapportés. La plupart de ces rapports sont survenus dans le cadre d’une dysenterie aiguë, d’un surdosage et chez de très jeunes enfants âgés de moins de deux ans.
Personnes âgées
Aucune étude pharmacocinétique formelle n’a été menée chez les sujets âgés. Cependant, aucune différence majeure n’a été signalée dans l’élimination du médicament chez les patients âgés atteints de diarrhée par rapport aux jeunes patients. Aucun ajustement posologique n’est nécessaire chez les personnes âgées.
Insuffisance rénale
Aucune donnée pharmacocinétique n’est disponible chez les patients présentant une insuffisance rénale. Les métabolites et le médicament inchangé étant principalement excrétés dans les fèces, aucun ajustement posologique n’est nécessaire chez les patients atteints d’insuffisance rénale (voir rubrique PRÉCAUTIONS).
Insuffisance hépatique
Bien qu’aucune donnée pharmacocinétique ne soit disponible chez les patients atteints d’insuffisance hépatique, l’Imodium doit être utilisé avec prudence chez ces patients en raison d’un métabolisme de premier passage réduit. (voir Précautions).
Comment Imodium est-il présenté
Capsules – chaque capsule contient 2 mg de chlorhydrate de lopéramide. Les capsules ont un corps vert clair et un capuchon vert foncé portant l’inscription « JANSSEN » sur un segment et « Imodium » sur l’autre segment. Les capsules Imodium® sont fournies en flacons de 100.
NDC 50458-400-10
(100 CAPSULES)
Conserver à 15°-25°C (59°-77°F).
Révisé en septembre 1996, juillet 1998, avril 2004
Approuvé en octobre 2005
©Janssen Pharmaceutica Inc. 1998
Rx Only
Printed in USA
U.S. Brevet 3, 714,159
| Imodium gélule de chlorhydrate de loperamide |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
Étiqueteur – McNeil Consumer Healthcare
Frequently asked questions
- Comment arrêter la diarrhée – des suggestions de médicaments ou de remèdes ?
Plus d’informations sur Imodium (lopéramide)
- Effets secondaires
- Pendant la grossesse ou l’allaitement
- Dosage. Informations
- Images des médicaments
- Interactions médicamenteuses
- Comparer les alternatives
- Groupe de soutien
- 24 revues
- Classe de médicaments : Antidiarrhéiques
- Alertes de la FDA (2)
Ressources pour les consommateurs
- Lecture avancée
Ressources pour les professionnels
- Informations posologiques
- Solution orale de lopéramide (FDA)
Autres marques Antidiarrhéiques, Up and Up Anti-Diarrheal Solution
Autres formulations
- Imodium A-D
Guides de traitement associés
- Diarrhée, aiguë
- Diarrhée, chronique
- Diarrhée du voyageur
- Diarrhée
Avis de non-responsabilité médicale
.