Il est important de connaître la structure de Lewis d’une molécule pour comprendre ses propriétés physiques, son hybridation et la forme de la molécule. Aujourd’hui, nous allons parcourir la structure de Lewis de I3- ou aussi connu sous le nom d’ion triodure car il a une charge négative. Cette molécule contient trois molécules d’iode, d’où son nom de triodure. Pour comprendre la structure de Lewis de la molécule, nous devons connaître les électrons de valence de la molécule d’iode.
Structure de Lewis
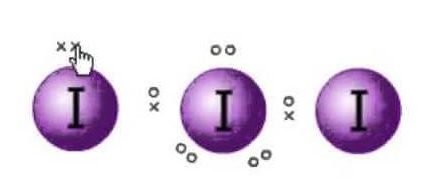
La structure de Lewis est la représentation des électrons des molécules. Il existe des paires solitaires et des électrons de valence qui permettent de déterminer l’hybridation et la forme de la molécule. Comme il y a des molécules d’iode, une molécule d’iode sera au centre. De plus, l’iode est dans le septième groupe du tableau périodique et a sept électrons de valence dans son orbite externe.

Nous avons ici trois molécules d’iode qui avec un électron supplémentaire qui lui donne une charge négative. Donc le nombre total d’électrons de valence sont : 7×3 + 1= 22.
Il y a 22 électrons de valence au total dans cette molécule. Maintenant, il y a une règle de l’octet que chaque atome suit. Selon cette règle, chaque atome doit avoir huit électrons dans son orbite externe. S’il y a 8 électrons dans l’orbite externe de l’atome central, il y a deux autres atomes qui doivent compléter leur octuor. Comme tous les atomes ont besoin de huit électrons dans leur orbite externe pour compléter l’octuor, un électron de l’atome d’iode central sera pris par les deux atomes d’iode voisins. Cela signifie 8-1-1=6.
Comme les électrons seront pris par les deux atomes.
Donc maintenant les électrons de valence sur l’atome central d’iode seront six. Ces six électrons formeront les paires d’électrons solitaires qui ne se lient pas. Comme il forme la paire d’électrons maintenant, il y aura trois paires solitaires, et deux paires de liaison des électrons comme chaque atomes d’Iode a une liaison avec l’atome central partageant un électron chacun au total il y a 3 paires solitaires et 2 paires de liaison sur l’atome central.
Hybridation
Pour connaître l’hybridation de n’importe quelle molécule, il y a une formule simple qui peut être utilisée. Cette formule permet de connaître le nombre d’hybridation qui permet de connaître l’hybridation de la molécule.
Les numéros d’hybridation et l’hybridation qu’il détermine sont énoncés comme suit :
- 2 : hybridation sp
- 3 : hybridation sp2
- 4 : hybridation sp3
- 5 : hybridation
La formule pour trouver le numéro est,
Nombre d’hybridation : Nombre d’électron de valence + monovalent + (charge négative) – (charge positive)/2
Les électrons de valence des atomes d’iode sont 7 car il y a sept électrons dans la coquille la plus externe. Le nombre d’atomes monovalents est de deux, car deux iodes sur trois sont monovalents. Maintenant quand nous venons à la charge de l’ion I3- il a une charge négative donc la valeur de cette charge négative sera 1.
Maintenant placez toutes les valeurs selon la formule,
7+1+2/2
=10/2
=5
Donc le numéro d’hybridation est 5 ce qui signifie que son hybridation est sp3d.
Une autre façon de trouver l’hybridation d’une molécule donnée est avec l’aide des paires solitaires et des électrons de valence. Le nombre de paires solitaires dans cette molécule est de 3, et le nombre d’atomes partageant des électrons de valence est de 2.
Hence, 3+2=5 ce qui détermine également une hybridation sp3d.
La forme de l’ion I3-

La forme de la molécule I3- est linéaire. Il y a trois atomes d’iode dont un a une charge négative supplémentaire. En raison de cet électron supplémentaire, il y a 3 paires d’électrons solitaires et 2 paires de liaisons, ce qui fait que le nombre stérique est de 5. Comme il y a trois paires solitaires sur l’atome central d’iode, ces paires essaient de se repousser autant que possible. Ainsi, afin d’être éloignées à une plus grande distance, les paires prennent les positions équatoriales, et les deux autres atomes d’iode sont à 180 degrés l’un de l’autre. Ainsi, la forme globale de l’ion I3- est linéaire.
Polarité
Voici donc la partie délicate à propos de cet ion, tout d’abord comme il a une charge sur lui nous pouvons l’appeler comme un ion polyatomique au lieu de l’appeler une molécule. Les ions sont les charges que nous voyons sur les molécules. Comme I3- a un électron, cet ion a une charge négative globale. Les molécules ont une polarité car elles possèdent les deux charges, à savoir une extrémité partiellement chargée positivement et une extrémité partiellement chargée négativement. Il existe un moment dipolaire sur les molécules qui dépend de la séparation des charges sur la molécule. Si la distance entre les deux charges est plus grande, le moment dipolaire sera aussi plus grand.
Mais quand on parle de l’ion I3- c’est un ion chargé négativement. Même lorsque nous dessinons, sa structure de Lewis, nous ne voyons pas de moment dipolaire ou les liaisons polaires en elle que la charge globale elle-même est négative sur l’ion. Il n’est donc ni polaire ni non polaire. Cependant, si vous devez décrire l’ion, vous pouvez utiliser l’expression » comme une molécule polaire » car I3- est soluble dans l’eau.
En conclusion, pour résumer, tout cet article, I3- est un ion polyatomique qui possède 22 électrons de valence, 3 paires solitaires, 2 paires de liaisons et une hybridation sp3d. Il est de forme linéaire et n’a pas de polarité.