Évaluation | Biopsychologie | Comparative |Cognitive |Développementale |Langage |Différences individuelles |Personnalité |Philosophie |Sociale |
Méthodes |Statistiques |Clinique |Éducation |Industrie |Eléments professionnels |Psychologie mondiale |
Biologique :Génétique comportementale – Psychologie évolutive – Neuroanatomie – Neurochimie – Neuroendocrinologie -Neurosciences – Psychoneuroimmunologie – Psychologie physiologique – Psychopharmacologie(Index, Schéma)
| Cerveau : Hypothalamus | ||
|---|---|---|
 |
||
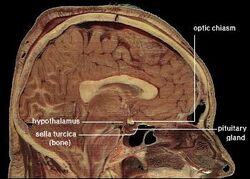
| Localisation de l’hypothalamus humain | ||
 |
||
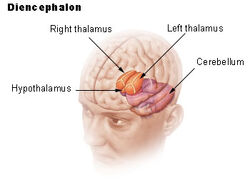
| Diencéphale | ||
| Latin | hypothalamus | |
| Sujet de Gray | sujet n°189 812 | |
| Partie de | ||
| Composantes | ||
| Artère | ||
| Vein | ||
| Information cérébrale/UW | hier-358 | |
| MeSH | A08.186.211.730.385.357 | |
L’hypothalamus relie le système nerveux au système endocrinien via la glande pituitaire (hypophyse). L’hypothalamus, (du grec ὑποθαλαμος = sous le thalamus) est situé sous le thalamus, juste au-dessus du tronc cérébral. Cette glande occupe la majeure partie de la région ventrale du diencéphale. On la trouve dans le cerveau de tous les mammifères. Chez l’homme, elle a à peu près la taille d’une amande.
L’hypothalamus régule certains processus métaboliques et d’autres activités du système nerveux autonome. Il synthétise et sécrète des neurohormones, souvent appelées hormones de libération hypothalamique, qui à leur tour stimulent ou inhibent la sécrétion des hormones hypophysaires.
L’hypothalamus contrôle la température corporelle, la faim, la soif, la fatigue, la colère et les cycles circadiens.
- Entrées
- Stimuli olfactifs
- Stimuli véhiculés par le sang
- Stéroïdes
- Entrées neuronales
- Noyaux
- Sorties
- Projections neurales
- Hormones endocriniennes
- Contrôle de la prise alimentaire
- Dimorphisme sexuel
- Réponses aux stéroïdes ovariens
- Stéroïdes gonadiques dans la vie néonatale des rats
- Les androgènes chez les primates
- Autres influences sur le développement hypothalamique
- Effets du vieillissement sur l’hypothalamus
- Voir aussi
- Images supplémentaires
- Références & Bibliographie
- Articles
- Matériel supplémentaire
- Articles
Entrées
L’hypothalamus est une région très complexe du cerveau des humains, et même de petits noyaux à l’intérieur de l’hypothalamus sont impliqués dans de nombreuses fonctions différentes. Le noyau paraventriculaire par exemple contient des neurones à ocytocine et à vasopressine (aussi appelée hormone antidiurétique) qui se projettent vers l’hypophyse postérieure, mais contient aussi des neurones qui régulent la sécrétion d’ACTH et de TSH (qui se projettent vers l’hypophyse antérieure), les réflexes gastriques, le comportement maternel, la pression sanguine, l’alimentation, les réponses immunitaires et la température.
L’hypothalamus coordonne de nombreux rythmes circadiens hormonaux et comportementaux, des schémas complexes de sorties neuroendocrines, des mécanismes homéostatiques complexes et de nombreux comportements importants. L’hypothalamus doit donc répondre à de nombreux signaux différents, dont certains sont générés de l’extérieur et d’autres de l’intérieur. Il est donc richement connecté avec de nombreuses parties du SNC, notamment la formation réticulaire du tronc cérébral et les zones autonomes, le cerveau antérieur limbique (en particulier l’amygdale, le septum, la bande diagonale de Broca et les bulbes olfactifs, et le cortex cérébral).
L’hypothalamus est sensible à :
- La lumière : longueur du jour et photopériode pour réguler les rythmes circadiens et saisonniers
- Stimuli olfactifs, y compris les phéromones
- Stéroïdes, y compris les stéroïdes gonadiques et les corticostéroïdes
- Informations transmises par voie nerveuse provenant notamment du cœur, de l’estomac, et de l’appareil reproducteur
- Entrées autonomes
- Stimuli véhiculés par le sang, y compris la leptine, la ghréline, l’angiotensine, l’insuline, les hormones hypophysaires, les cytokines, les concentrations plasmatiques de glucose et d’osmolarité, etc
- Stress
- Invasion de micro-organismes en augmentant la température du corps, en réinitialisant le thermostat du corps vers le haut.
Stimuli olfactifs
Les stimuli olfactifs sont importants pour la reproduction et la fonction neuroendocrine chez de nombreuses espèces. Par exemple, si une souris enceinte est exposée à l’urine d’un mâle » étrange » pendant une période critique après le coït, alors la grossesse échoue (effet Bruce). Ainsi, pendant le coït, une souris femelle forme une » mémoire olfactive » précise de son partenaire qui persiste pendant plusieurs jours.Les signaux phéromonaux aident à la synchronisation de l’œstrus chez de nombreuses espèces ; chez la femme, la synchronisation des menstruations peut également provenir de signaux phéromonaux, bien que le rôle des phéromones chez l’homme soit mis en doute par certains.
Stimuli véhiculés par le sang
Les hormones peptidiques ont des influences importantes sur l’hypothalamus, et pour ce faire, elles doivent échapper à la barrière hémato-encéphalique. L’hypothalamus est délimité en partie par des régions cérébrales spécialisées qui ne disposent pas d’une barrière hémato-encéphalique efficace ; l’endothélium capillaire de ces sites est fenestré pour permettre le libre passage de protéines et autres molécules, même de grande taille. Certains de ces sites sont les sites de neurosécrétion – la neurohypophyse et l’éminence médiane. Cependant, d’autres sont des sites où le cerveau échantillonne la composition du sang. Deux de ces sites, l’organe sous-fornical et l’OVLT (organum vasculosum of the lamina terminalis) sont des organes dits circumventriculaires, où les neurones sont en contact intime avec le sang et le LCR. Ces structures sont densément vascularisées et contiennent des neurones osmoceptifs et réceptifs au sodium qui contrôlent la consommation d’alcool, la libération de vasopressine, l’excrétion de sodium et l’appétit pour le sodium. Elles contiennent également des neurones dotés de récepteurs pour l’angiotensine, le facteur natriurétique auriculaire, l’endothéline et la relaxine, chacun de ces récepteurs étant important dans la régulation de l’équilibre hydrique et électrolytique. Les neurones de l’OVLT et du SFO se projettent vers le noyau supraoptique et le noyau paraventriculaire, ainsi que vers les zones hypothalamiques préoptiques. Les organes circumventriculaires peuvent également être le site d’action des interleukines pour susciter à la fois la fièvre et la sécrétion d’ACTH, via des effets sur les neurones paraventriculaires.
Il n’est pas clair comment tous les peptides qui influencent l’activité hypothalamique obtiennent l’accès nécessaire. Dans le cas de la prolactine et de la leptine, il existe des preuves d’une absorption active au niveau des plexus choroïdes, du sang vers le LCR. Certaines hormones hypophysaires ont une influence de rétroaction négative sur la sécrétion hypothalamique ; par exemple, l’hormone de croissance rétroagit sur l’hypothalamus, mais la façon dont elle pénètre dans le cerveau n’est pas claire. Il existe également des preuves d’actions centrales de la prolactine et de la TSH.
Stéroïdes
L’hypothalamus contient des neurones sensibles aux stéroïdes gonadiques et aux glucocorticoïdes – (les hormones stéroïdes de la glande surrénale, libérées en réponse à l’ACTH). Elle contient également des neurones spécialisés sensibles au glucose (dans le noyau arqué et l’hypothalamus ventromédial), qui sont importants pour l’appétit. La zone préoptique contient des neurones thermosensibles ; ceux-ci sont importants pour la sécrétion de TRH.
Entrées neuronales
L’hypothalamus reçoit de nombreuses entrées du tronc cérébral ; notamment du noyau du tractus solitaire, du locus coeruleus, et de la médulla ventrolatérale. La sécrétion d’ocytocine en réponse à la tétée ou à la stimulation vagino-cervicale est médiée par certaines de ces voies ; la sécrétion de vasopressine en réponse aux stimuli cardiovasculaires provenant des chimiorécepteurs du sinus carotidien et de la crosse aortique, et des récepteurs du volume auriculaire à basse pression, est médiée par d’autres. Chez le rat, la stimulation du vagin provoque également la sécrétion de prolactine, ce qui entraîne une pseudo-grossesse après un accouplement infertile. Chez la lapine, le coït provoque une ovulation réflexe. Chez la brebis, la stimulation du col de l’utérus en présence de niveaux élevés d’œstrogènes peut induire un comportement maternel chez une brebis vierge. Ces effets sont tous médiés par l’hypothalamus, et l’information est transportée principalement par les voies spinales qui relaient dans le tronc cérébral. La stimulation des mamelons stimule la libération de l’ocytocine et de la prolactine et supprime la libération de la LH et de la FSH.
Les stimuli cardiovasculaires sont véhiculés par le nerf vague, mais le vague véhicule également une variété d’informations viscérales, dont par exemple les signaux issus de la distension gastrique pour supprimer l’alimentation. Là encore, ces informations parviennent à l’hypothalamus via des relais dans le tronc cérébral.
Noyaux
Les noyaux hypothalamiques comprennent les éléments suivants :
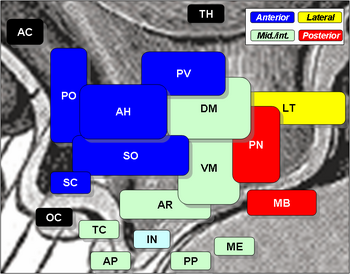
Noyaux hypothalamiques
| Région | Aire | Nucléus | Fonction |
| Antérieur | Médian | Noyau préoptique médian |
. contraction de la vessie |
| Noyau supraoptique (SO) |
|
||
| Noyau Paraventriculaire (PV) |
|
||
| Noyau hypothalamique antérieur (AH) |
|
||
| Noyau suprachiasmatique (SC) |
|
||
| Noyau latéral | Noyau préoptique latéral | ||
| Noyau latéral (LT) |
|
||
| Partie du noyau supraoptique (SO) |
|
||
| Tubéral | Médial | Noyau hypothalamique dorsomédial (DM) |
|
| Noyau ventromédial (VM) |
. |
||
Noyau arqué (AR)
|
|||
| Noyau latéral | . Noyau latéral (LT) |
|
|
| Noyaux tubéraux latéraux | |||
| Postérieur | Médian | Noyaux mammillaires (partie des corps mammillaires) (MB) |
|
| Noyau postérieur (PN) |
|
||
| Noyau latéral | Noyau latéral (LT) |
Voir aussi : Noyau préoptique ventrolatéral
Sorties
Les sorties de l’hypothalamus peuvent être divisées en deux catégories : les projections neurales, et les hormones endocrines.
Projections neurales
La plupart des systèmes de fibres de l’hypothalamus fonctionnent dans les deux sens (bidirectionnel).
- Les projections vers les zones caudales de l’hypothalamus passent par le faisceau médian du cerveau antérieur, le tractus mammillotegmentaire et le fascicule longitudinal dorsal.
- Les projections vers les zones rostrales de l’hypothalamus sont véhiculées par le tractus mammillothalamique, le fornix et le stria terminal.
Hormones endocriniennes
L’Hypothalamus affecte le système endocrinien et régit le comportement émotionnel, tel que, la colère et l’activité sexuelle. La plupart des hormones hypothalamiques générées sont distribuées à l’hypophyse via le système portail hypophysaire. L’hypothalamus maintient l’homéostasie cela inclut une régulation de la pression sanguine, du rythme cardiaque et de la température.
Les principales hormones hypothalamiques sont :
| Nom | Autres noms | Abréviations | Localisation | Fonction |
|---|---|---|---|---|
| Hormone de libération de la corticotropine | Facteur de libération de la corticotropine, corticolibérine | CRH, CRF | Nerones neuroendocrines parvocellaires dans le noyau paraventriculaire | avec la vasopressine, stimule l’antéhypophyse pour sécréter l’ACTH |
| Dopamine | Hormone inhibitrice de la prolactine | DA, PIH | neuroendocrine des neurones du noyau arqué | inhibe la sécrétion de prolactine par l’antéhypophyse |
| Hormone de libération des gonadotrophines | Hormone de libération de l’hormone lutéinisante | GnRH, LHRH | neuroendocrine des neurones dans les noyaux préoptiques médians et arqués | stimule l’hypophyse antérieure pour qu’elle sécrète LH et FSH |
| Hormone de libération de l’hormone de croissance | Facteur de libération de l’hormone de croissance, somatocrinine | GHRH, GHRF, GRF | neurones neuroendocrines du noyau arqué | stimule l’hypophyse antérieure pour sécréter l’hormone de croissance |
| Mélatonine | noyau suprachiasmatique | |||
| Somatostatine | Hormone de croissance-hormone inhibitrice, Facteur inhibiteur de la libération de somatotropine | SS, GHIH, SRIF | neuroendocrine neurones du noyau périventriculaire | inhibe la sécrétion de l’hormone de croissance par l’antéhypophyse |
| Hormone de libération de la thyrotropine | Facteur de libération de la thyrotropine, Thyroliberine, Protirelin | TRH, TRF | neurones neuroendocrines parvocellulaires dans les noyaux hypothalamiques paraventriculaires et antérieurs | stimule l’hypophyse antérieure pour sécréter la TSH |
Voir aussi : Hypocrétine
Contrôle de la prise alimentaire
La partie extrême latérale du noyau ventromédial de l’hypothalamus est responsable du contrôle de la prise alimentaire. La stimulation de cette zone entraîne une augmentation de la prise alimentaire. Une lésion bilatérale de cette zone entraîne l’arrêt complet de la prise alimentaire. Les parties médianes du noyau ont un effet de contrôle sur la partie latérale. Une lésion bilatérale de la partie médiane du noyau ventromédian provoque une hyperphagie et une obésité chez l’animal. Une lésion supplémentaire de la partie latérale du noyau ventromédial chez le même animal produit un arrêt complet de la prise alimentaire.
Il existe différentes hypothèses liées à cette régulation :
- Hypothèse lipostatique – cette hypothèse soutient que le tissu adipeux produit un signal humoral proportionnel à la quantité de graisse et agit sur l’hypothalamus pour diminuer la prise alimentaire et augmenter la production d’énergie. Il a été évident qu’une hormone, la leptine, agit sur l’hypothalamus pour diminuer la prise alimentaire et augmenter la production d’énergie.
- Hypothèse des gutpeptides – les hormones gastro-intestinales comme la Grp, les glucagons, la CCK et d’autres prétendent inhiber la prise alimentaire. La nourriture qui entre dans le tractus gastro-intestinal déclenche la libération de ces hormones qui agissent sur le cerveau pour produire la satiété. Le cerveau contient à la fois des récepteurs CCK-A et CCK-B.
- Hypothèse glucostatique – l’activité du centre de la satiété dans les noyaux ventromédians est probablement régie par l’utilisation du glucose dans les neurones. Il a été postulé que lorsque leur utilisation du glucose est faible et par conséquent lorsque la différence de glucose sanguin artério-veineux à travers eux est faible, l’activité à travers les neurones diminue. Dans ces conditions, l’activité du centre d’alimentation est incontrôlée et l’individu ressent la faim. La prise alimentaire est rapidement augmentée par l’administration intraventriculaire de 2-désoxyglucose diminuant donc l’utilisation du glucose dans les cellules.
- Hypothèse thermostatique – selon cette hypothèse, une diminution de la température corporelle en dessous d’un point de consigne donné stimule l’appétit, alors qu’une augmentation au-dessus du point de consigne inhibe l’appétit.
Dimorphisme sexuel
Plusieurs noyaux hypothalamiques sont sexuellement dimorphiques, c’est-à-dire qu’il existe des différences claires à la fois dans la structure et la fonction entre les mâles et les femelles.
Certaines différences sont apparentes même dans la neuroanatomie brute : la plus notable est le noyau sexuellement dimorphe au sein de la zone préoptique, qui n’est présent que chez les mâles. Cependant, la plupart des différences sont des changements subtils dans la connectivité et la sensibilité chimique d’ensembles particuliers de neurones.
L’importance de ces changements peut être reconnue par des différences fonctionnelles entre les mâles et les femelles. Par exemple, le schéma de sécrétion de l’hormone de croissance est sexuellement dimorphe, et c’est l’une des raisons pour lesquelles, dans de nombreuses espèces, les mâles adultes sont beaucoup plus grands que les femelles.
Réponses aux stéroïdes ovariens
D’autres dimorphismes fonctionnels frappants se trouvent dans les réponses comportementales aux stéroïdes ovariens de l’adulte. Les hommes et les femmes répondent différemment aux stéroïdes ovariens, en partie parce que l’expression des neurones sensibles aux œstrogènes dans l’hypothalamus est sexuellement dimorphe, c’est-à-dire que les récepteurs aux œstrogènes sont exprimés dans différents ensembles de neurones.
Les œstrogènes et la progestérone peuvent influencer l’expression des gènes dans des neurones particuliers ou induire des changements dans le potentiel de la membrane cellulaire et l’activation des kinases, conduisant à diverses fonctions cellulaires non génomiques. Les œstrogènes et la progestérone se lient à leurs récepteurs nucléaires hormonaux, qui se déplacent vers le noyau cellulaire et interagissent avec des régions de l’ADN connues sous le nom d’éléments de réponse aux hormones (HRE) ou se fixent sur le site de liaison d’un autre facteur de transcription. Il a été démontré que le récepteur des œstrogènes (RE) transactive d’autres facteurs de transcription de cette manière, malgré l’absence d’un élément de réponse aux œstrogènes (ERE) dans la région promotrice proximale du gène. Les RE et les récepteurs de la progestérone (RP) sont généralement des activateurs de gènes, avec une augmentation de l’ARNm et de la synthèse protéique ultérieure après une exposition aux hormones.
Les cerveaux masculins et féminins diffèrent dans la distribution des récepteurs des œstrogènes, et cette différence est une conséquence irréversible de l’exposition néonatale aux stéroïdes. Les récepteurs aux œstrogènes (et à la progestérone) se trouvent principalement dans les neurones de l’hypothalamus antérieur et médiobasal, notamment :
- la zone préoptique (où se trouvent les neurones de la LHRH)
- le noyau périventriculaire (où se trouvent les neurones de la somatostatine)
- l’hypothalamus ventromédial (qui est important pour le comportement sexuel).
Stéroïdes gonadiques dans la vie néonatale des rats
Dans la vie néonatale, les stéroïdes gonadiques influencent le développement de l’hypothalamus neuroendocrine. Par exemple, ils déterminent la capacité des femelles à présenter un cycle reproductif normal, et des mâles et des femelles à présenter des comportements reproductifs appropriés dans la vie adulte.
- Si l’on injecte une fois de la testostérone à un rat femelle dans les premiers jours de la vie postnatale (pendant la « période critique » de l’influence des stéroïdes sexuels), l’hypothalamus est masculinisé de manière irréversible ; le rat adulte sera incapable de générer une poussée de LH en réponse aux œstrogènes (une caractéristique des femelles), mais sera capable de présenter des comportements sexuels masculins (monter une femelle sexuellement réceptive).
- A l’inverse, un rat mâle castré juste après la naissance sera féminisé, et l’adulte présentera des comportements sexuels féminins en réponse aux œstrogènes (réceptivité sexuelle, lordose}.
Les androgènes chez les primates
Chez les primates, l’influence développementale des androgènes est moins claire, et les conséquences sont moins complètes. Le « Tomboyisme » chez les filles pourrait refléter les effets des androgènes sur le cerveau du fœtus, mais le sexe de l’élevage pendant les 2-3 premières années est considéré par beaucoup comme le déterminant le plus important de l’identité de genre, car pendant cette phase, soit l’œstrogène, soit la testostérone aura des effets permanents sur un cerveau féminin ou masculin, influençant à la fois l’hétérosexualité et l’homosexualité.
Le paradoxe est que les effets masculinisants de la testostérone sont médiés par l’œstrogène. Dans le cerveau, la testostérone est aromatisée en (estradiol), qui est la principale hormone active pour les influences du développement. Le testicule humain sécrète des niveaux élevés de testostérone à partir de la huitième semaine de la vie fœtale et jusqu’à 5 ou 6 mois après la naissance (une poussée périnatale similaire de testostérone est observée chez de nombreuses espèces), un processus qui semble être à la base du phénotype masculin. Les œstrogènes provenant de la circulation maternelle sont relativement inefficaces, en partie à cause des niveaux circulants élevés de protéines de liaison aux stéroïdes pendant la grossesse.
Autres influences sur le développement hypothalamique
Les stéroïdes sexuels ne sont pas les seules influences importantes sur le développement hypothalamique ; en particulier, le stress pré-pubertaire au début de la vie détermine la capacité de l’hypothalamus adulte à répondre à un facteur de stress aigu. Contrairement aux récepteurs des stéroïdes gonadiques, les récepteurs des glucocorticoïdes sont très répandus dans tout le cerveau ; dans le noyau paraventriculaire, ils assurent la médiation du contrôle par rétroaction négative de la synthèse et de la sécrétion du CRF, mais ailleurs, leur rôle n’est pas bien compris.
Effets du vieillissement sur l’hypothalamus
Des études sur des souris femelles ont montré que le noyau supraoptique (SON) et le noyau paraventriculaire (PVN) perdent environ un tiers des cellules immunoréactives à l’IGF-1R avec le vieillissement normal. De plus, les souris âgées soumises à une restriction calorique (CR) perdent un nombre plus élevé de cellules non immunoréactives à l’IGF-1R tout en conservant un nombre similaire de cellules immunoréactives à l’IGF-1R par rapport aux souris âgées Al. Par conséquent, les souris Old-CR présentent un pourcentage plus élevé de cellules immunoréactives IGF-1R reflétant une sensibilité hypothalamique accrue à l’IGF-1 par rapport aux souris vieillissant normalement.
Voir aussi
- Axe HPA
- Système hypophysaire hypothalamo
- Système hypophysaire surrénalien
- Lésions de l’hypothalamus
- Faisceau médian du cerveau antérieur
- Neuroendocrinologie
- Aire préoptique
.
Images supplémentaires
Ajouter une photo à cette galerie
- http://www.cancer.gov/Templates/db_alpha.aspx?CdrID=46359
- http://www.sci.uidaho.edu/med532/hypothal.htm
- Diagramme des noyaux (psycheducation.org)
- Diagramme des noyaux (universe-review.ca)
- Diagramme des noyaux (utdallas.edu)
- Sauf indication contraire dans le tableau, la référence est alors : Guyton huitième édition
- Walter F., PhD. Boron. Physiologie médicale : A Cellular And Molecular Approaoch, Elsevier/Saunders. Page 840
- http://thalamus.wustl.edu/course/hypoANS.html
- http://www.vivo.colostate.edu/hbooks/pathphys/endocrine/hypopit/overview.html
- Theologides A (1976). Les métabolites intermédiaires producteurs d’anorexie. Am J Clin Nutr 29 (5) : 552-8.
- John Money, « Le concept de trouble de l’identité sexuelle dans l’enfance et l’adolescence après 39 ans », Journal of Sex and Marital Therapy 20 (1994) : 163-77.
- Romeo, Russell D, Rudy Bellani, Ilia N. Karatsoreos, Nara Chhua, Mary Vernov, Cheryl D. Conrad et Bruce S. McEwen (2005). Stress History and Pubertal Development Interact to Shape Hypothalamic-Pituitary-Adrenal Axis Plasticity. Endocrinology 147 (4) : 1664-1674.
- Saeed O,Yaghmaie F,Garan SA,Gouw AM,Voelker MA,Sternberg H, Timiras PS. (2007). Les cellules immunoréactives au récepteur du facteur de croissance analogue à l’insuline-1 sont maintenues de manière sélective dans l’hypothalamus paraventriculaire de souris soumises à des restrictions caloriques. Int J Dev Neurosci 25 (1) : 23-8.
- Yaghmaie F, Saeed O, Garan SA, Voelker MA, Gouw AM, Freitag W, Sternberg H, Timiras PS (2006). Age-dependent loss of insulin-like growth factor-1 receptor immunoreactive cells in the supraoptic hypothalamus is reduced in calorically restricted mice. Int J Dev Neurosci 24 (7) : 431-6.
- F. Yaghmaie, O. Saeed, S.A. Garan, A.M. Gouw, P. Jafar, J. Kaur, S. Nijjar, P.S. Timiras, H. Sternberg, M.A. Voelker (2007). Suivi des changements de la sensibilité de l’IGF-1 hypothalamique avec le vieillissement et la restriction calorique. Gérontologie expérimentale 42 (1-2) : 148-149.
Références & Bibliographie
Articles
- Arees, E.A. et Mayer, B, (1967) Connexions anatomiques entre les régions médianes et latérales de l’hypothalamus concernées par la prise alimentaire, Science 157 : 1574-5
- Grossman, S.P. (1960) Eating or drinking elicited by direct adrenergic or cholinergic stimulation of the hypothalamus, Science 132 : 301-2.
- Hetherington, A.W. and Ranson, S.W. (1942) The relation of various hypothalamic lesions to adiposity in the rat, 76 : 475-99.
Matériel supplémentaire
Articles
- Google Scholar
.
- Cerveaux à UCDavis Hypothalamus
- Système endocrinien et hypothalamus
- Haute résolution.Résolution Cytoarchitecturale Primate Brain Atlases
- The Hypothalamus and Pituitary at endotexts.org
- Diagramme des noyaux (psycheducation.org)
- Diagramme des noyaux (universe-review.ca)
- Diagramme des noyaux (utdallas.edu)
|
v-d-e
Cerveau humain : diencéphale (TA A14.1.08, GA 9.807) |
||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Epithalamus |
|
Surface
|
||||||||||||||
| Thalamus |
|
Surface
|
Matière grise/
nucléus |
|||||||||||||
| Hypothalamus |
|
|||||||||||||||
| Subthalamus |
Noyau subthalamique – Zona incerta |
|||||||||||||||
| Système ventriculaire : Troisième ventricule |
récès : (Recoin optique, Recoin infundibulaire, Recoin suprapinéal, Recoin pinéal) Sillon hypothalamique – Tela chorioidea du troisième ventricule Organe subfornical Apertures : Interventriculaire/Monro Commissaire postérieure |
|||||||||||||||
|
v-d-e
Anatomie humaine, système endocrinien : Glandes endocrines |
||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Axes hypothalamiques/ hypophysaires |
|
|
|
|
||||||||||||
| Glandes pinéales |
Pinéalocytes – Corpora arenacea |
|||||||||||||||
| Islots pancréatiques | ||||||||||||||||
| . pancréas |
Cellule alpha – cellule bêta – cellule delta – cellule PP – cellule epsilon |
|||||||||||||||
Cerveau humain : Système limbique
Amygdale – Gyrus cingulaire – Gyrus fornicateur – Hippocampe – Hypothalamus – Corps mammillaire – Nucleus accumbens – Cortex orbitofrontal – Gyrus parahippocampique
.