Définition du problème
L’hyperparathyroïdie primaire est la surproduction non régulée d’hormone parathyroïdienne (PTH) entraînant une homéostasie anormale du calcium.
Fréquence
L’hyperparathyroïdie primaire est plus fréquente chez les femmes, l’incidence étant de 66 pour 100 000 personnes-années chez les femmes, et de 25 pour 100 000 personnes-années chez les hommes. Dans une vaste étude portant sur 3,5 millions de personnes inscrites au Kaiser Permanente de la Californie du Sud, l’incidence a fluctué dans le temps mais n’a pas diminué de façon substantielle. Au contraire, la prévalence de l’hyperparathyroïdie primaire a connu une augmentation substantielle dans cette population. L’âge moyen au moment du diagnostic est resté entre 52 et 56 ans.
Étiologie
Dans environ 85 % des cas, l’hyperparathyroïdie primaire est causée par un seul adénome. Dans 15 % des cas, de multiples glandes sont impliquées (c’est-à-dire soit des adénomes multiples, soit une hyperplasie). Dans de rares cas, l’hyperparathyroïdie primaire est causée par un carcinome parathyroïdien. L’étiologie des adénomes ou de l’hyperplasie reste inconnue dans la plupart des cas. Les cas familiaux peuvent faire partie des syndromes de néoplasie endocrinienne multiple (MEN 1 ou MEN 2a), du syndrome de la tumeur de la mâchoire hyperparathyroïdienne (HPT-JT) ou de l’hyperparathyroïdie familiale isolée (FIHPT). L’hypercalcémie hypocalciurique familiale et l’hyperparathyroïdie néonatale sévère appartiennent également à cette catégorie. La base génétique moléculaire du MEN 1 est une mutation inactivatrice du gène MEN1, situé sur la bande chromosomique 11q13. Le MEN 2a est causé par une mutation germinale du proto-oncogène Ret sur le chromosome 10. La mutation germinale du gène HRPT2 localisé sur le bras 1q du chromosome est responsable de l’HPT-JT, tandis que la FIHPT est génétiquement hétérogène.
Pathophysiologie
Dans l’hyperparathyroïdie primaire due à des adénomes, la rétroaction normale sur la production de l’hormone parathyroïdienne par le calcium extracellulaire semble être perdue, ce qui entraîne une modification du point de consigne. Cependant, ce n’est pas le cas dans l’hyperparathyroïdie primaire due à une hyperplasie parathyroïdienne. Une augmentation du nombre de cellules en est probablement la cause.
La résorption excessive chronique du calcium de l’os causée par un excès d’hormone parathyroïdienne peut entraîner une ostéopénie. Dans les cas graves, cela peut entraîner une ostéite fibrosa cystica, qui se caractérise par une résorption sous-périostée des phalanges distales, un effilement des clavicules distales, un aspect poivre et sel du crâne et des tumeurs brunes des os longs. Cela n’est pas courant aujourd’hui. En outre, l’augmentation chronique de l’excrétion de calcium dans l’urine peut prédisposer à la formation de calculs rénaux.
Les autres symptômes de l’hyperparathyroïdie sont dus à l’hypercalcémie elle-même et ne sont pas spécifiques à l’hyperparathyroïdie. Il peut s’agir de faiblesse musculaire, de fatigue, de déplétion volumique, de nausées et de vomissements et, dans les cas graves, de coma et de décès. Les manifestations neuropsychiatriques sont particulièrement fréquentes et peuvent inclure la dépression, la confusion ou des déficits subtils qui sont souvent mal caractérisés et peuvent ne pas être remarqués par le patient (ou peuvent être attribués au vieillissement). L’augmentation du calcium peut accroître la sécrétion d’acide gastrique, et les personnes atteintes d’hyperparathyroïdie peuvent avoir une prévalence plus élevée d’ulcère gastroduodénal. De rares cas de pancréatite ont également été attribués à l’hypercalcémie.
Une étude de cohorte prospective d’Ejlsmark-Svensson et al a rapporté que chez les patients atteints d’hyperparathyroïdie primaire, les scores du questionnaire de qualité de vie étaient significativement plus faibles en association avec une hypercalcémie modérée-sévère qu’en relation avec une hypercalcémie légère. Cependant, la qualité de vie ne semblait pas être liée à la présence de manifestations de l’hyperparathyroïdie primaire liées aux organes, telles que l’ostéoporose, les calcifications rénales et l’insuffisance rénale. Cela suggère que l’hypercalcémie est le principal moteur d’une qualité de vie altérée.
Présentation clinique
Histoire
Le syndrome clinique de l’hyperparathyroïdie primaire peut être facilement mémorisé comme « os, pierres, gémissements abdominaux et gémissements psychiques ». Avec l’introduction de la mesure systématique du calcium sanguin au début des années 1970, la présentation clinique la plus courante de l’hyperparathyroïdie primaire est passée d’une maladie osseuse grave ou de calculs rénaux à une hypercalcémie asymptomatique.
Les manifestations squelettiques de l’hyperparathyroïdie primaire comprennent principalement une perte osseuse corticale sélective. Des douleurs osseuses et articulaires, une pseudogoutte et une chondrocalcinose ont également été signalées. Dans les premières descriptions cliniques de l’hyperparathyroïdie primaire, certains patients ont développé un type particulier de maladie osseuse connue sous le nom d’ostéite fibrosa cystique, qui était caractérisée par une augmentation de la résorption osseuse ostéoclastique généralisée. Les modifications radiographiques sur film ordinaire associées à l’ostéite fibrosa cystica comprennent une résorption sous-périostée dans les phalanges et un résultat connu sous le nom de crâne poivre et sel. Cette présentation est rarement observée aujourd’hui, sauf dans les populations médicalement mal desservies.
Les manifestations rénales comprennent la polyurie, les calculs rénaux, l’hypercalciurie et, rarement, la néphrocalcinose.
Les manifestations gastro-intestinales comprennent de vagues douleurs abdominales, l’anorexie, les nausées, les vomissements, la constipation, l’ulcère gastroduodénal et la pancréatite aiguë.
Les manifestations neuromusculaires et psychologiques comprennent la fatigue, la faiblesse musculaire, la dépression, l’incapacité à se concentrer et les problèmes de mémoire ou les déficits subtils qui sont souvent mal caractérisés et peuvent ne pas être notés par le patient, une description courante étant le « brouillard cérébral ». Ces symptômes sont souvent attribués au vieillissement, et certains patients reçoivent un diagnostic de syndrome de fatigue chronique ou de fibromyalgie.
Les manifestations cardiovasculaires comprennent l’hypertension, la bradycardie, le raccourcissement de l’intervalle QT et l’hypertrophie ventriculaire gauche.
Physique
Les résultats de l’examen physique sont généralement non contributifs. L’examen peut révéler une faiblesse et une dépression musculaires. Une masse palpable dans le cou n’est généralement pas attendue avec l’hyperparathyroïdie, bien que dans de rares cas, elle puisse indiquer un cancer de la parathyroïde. Un nodule thyroïdien non diagnostiqué auparavant est beaucoup plus souvent la source d’un nodule palpable.
Considérations diagnostiques
Les causes d’hypercalcémie qui entraînent un taux de parathormone élevé de façon concomitante sont peu nombreuses. Elles comprennent l’hypercalcémie familiale bénigne (hypocalciurique) (FHH) (voir Troubles apparentés), l’hypercalcémie induite par le lithium et l’hyperparathyroïdie tertiaire. Une minorité de patients (c’est-à-dire 10 à 15 %) atteints d’hyperparathyroïdie ont des taux de parathormone qui se situent dans la plage de référence mais qui sont élevés de manière inappropriée en présence de concentrations élevées de calcium sérique. Un sous-ensemble de patients présente des taux de calcium normaux avec une hormone parathyroïdienne élevée, ce qu’on appelle l’hyperparathyroïdie normocalcémique. Cependant, lorsqu’on envisage ce diagnostic, il faut exclure toutes les causes potentielles d’hyperparathyroïdie secondaire (par exemple, faible apport en calcium, troubles gastro-intestinaux, insuffisance rénale, carence en vitamine D, hypercalciurie d’origine rénale). Les patients présentant des taux de calcium normaux et des taux élevés d’hormone parathyroïdienne en l’absence d’une cause secondaire identifiable doivent être surveillés pour détecter une évolution vers une hypercalcémie.
Les hyperparathyroïdies secondaires et tertiaires sont généralement diagnostiquées en fonction de leur contexte clinique. L’hypercalcémie induite par le cancer est associée à un faible taux de parathormone mais éventuellement à un taux élevé de peptide lié à la parathormone.
Prélèvement
Etudes de laboratoire
Les taux de calcium et d’albumine sériques totaux ou les taux de calcium ionisé doivent être mesurés. L’hypercalcémie doit être documentée à plus d’une occasion avant d’entreprendre un bilan diagnostique.
La mesure du taux d’hormone parathyroïdienne intacte est au cœur du diagnostic. Un niveau élevé d’hormone parathyroïdienne intacte avec un niveau élevé de calcium sérique ionisé est un diagnostic d’hyperparathyroïdie primaire. Une mesure du calcium dans les urines de 24 heures est nécessaire pour exclure une HFP.
Les anciens dosages mesuraient des fragments de la molécule d’hormone parathyroïdienne, comme la région C-terminale ou médiane de l’hormone parathyroïdienne. Ces dosages de première génération sont considérés comme obsolètes pour la pratique clinique. Les dosages de l’hormone parathyroïdienne de deuxième génération, appelés globalement dosages de l’hormone parathyroïdienne « intacte », et les dosages de l’hormone parathyroïdienne de troisième génération appelés dosages de l’hormone parathyroïdienne « entière » ou « biointact » utilisent deux anticorps différents contre deux segments différents de l’hormone parathyroïdienne. Les dosages de l’hormone parathyroïdienne de deuxième et troisième générations produisent des données beaucoup plus satisfaisantes sur le plan clinique que les dosages de première génération, mais présentent certaines limites qui continuent d’être évaluées dans plusieurs études.
Les autres résultats de laboratoire de l’hyperparathyroïdie primaire comprennent une légère acidose hyperchlorémique, une hypophosphatémie et une augmentation légère à modérée du taux d’excrétion urinaire du calcium.
Les taux de vitamine D doivent être mesurés lors de l’évaluation de l’hyperparathyroïdie primaire. Une carence en vitamine D (un taux de 25-hydroxyvitamine D inférieur à 20 ng par millilitre) peut provoquer une hyperparathyroïdie secondaire, et la réplétion de la carence en vitamine D peut aider à réduire les taux d’hormone parathyroïdienne. Dans la plupart des études, l’augmentation des réserves sériques de 25-hydroxyvitamine D à au moins 37,5 ng par millilitre est suffisante pour supprimer l’hormone parathyroïdienne et prévenir l’hyperparathyroïdie secondaire chez les personnes ayant une fonction rénale normale (bien que certaines études aient suggéré d’augmenter les réserves à 50 ng par millilitre).
Etudes d’imagerie
Les études d’imagerie ne sont pas utilisées pour poser le diagnostic d’hyperparathyroïdie primaire (qui est basé sur les données de laboratoire) ou pour prendre la décision de poursuivre ou non un traitement chirurgical (qui est basé sur des critères cliniques). Les études d’imagerie sont utilisées pour guider le chirurgien une fois que la thérapie chirurgicale a été décidée. Si une exploration limitée de la parathyroïde doit être tentée, une étude de localisation est nécessaire. Les autres utilisations des études d’imagerie dans l’évaluation initiale d’un patient atteint d’hyperparathyroïdie primaire sont controversées (voir Choix du traitement chirurgical, ci-dessous).
Pour de nombreux patients, la recommandation reste une exploration parathyroïdienne complète avec résection de toutes les glandes impliquées. De nombreux chirurgiens s’accordent à dire que les études d’imagerie ne sont pas nécessaires lorsque ce traitement chirurgical est choisi. Cependant, chez les patients qui présentent une hyperparathyroïdie récurrente ou persistante après une exploration chirurgicale précédente, un test d’imagerie pour localiser les glandes impliquées est définitivement indiqué.
L’ultrasonographie du cou est une technique sûre et largement utilisée pour la localisation des glandes parathyroïdiennes anormales. Elle est capable d’un haut degré de précision, mais elle est dépendante de l’opérateur et sa précision rapportée a beaucoup varié dans la littérature. Un avantage de l’échographie du cou est qu’elle peut être réalisée rapidement par le clinicien au moment de l’évaluation initiale. Les études sur l’échographie réalisée par un clinicien montrent des taux de précision qui se comparent favorablement à ceux des services de radiologie traditionnels, de l’ordre de 75 à 80 %. L’échographie, comme la scintigraphie de médecine nucléaire, ne s’est pas avérée fiable pour détecter les maladies multiglandulaires.
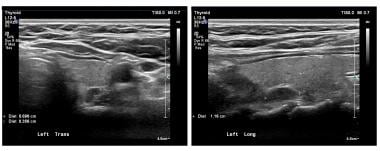 Les panneaux montrent une vue transversale et longitudinale (sagittale) d’un adénome parathyroïdien supérieur gauche en échographie. Les marques de calibre désignent l’adénome. Les adénomes sont typiquement homogènes et hypoéchogènes.
Les panneaux montrent une vue transversale et longitudinale (sagittale) d’un adénome parathyroïdien supérieur gauche en échographie. Les marques de calibre désignent l’adénome. Les adénomes sont typiquement homogènes et hypoéchogènes. La scintigraphie en médecine nucléaire avec du sestamibi radiomarqué est également une technique largement utilisée. Le sestamibi est couramment utilisé en imagerie cardiaque et on a découvert par hasard qu’il s’accumulait dans les adénomes parathyroïdiens. Ce radionucléide est concentré dans le tissu thyroïdien et parathyroïdien, mais il est généralement éliminé du tissu thyroïdien normal en moins d’une heure. Il persiste dans les tissus parathyroïdiens anormaux. Voir l’image ci-dessous.
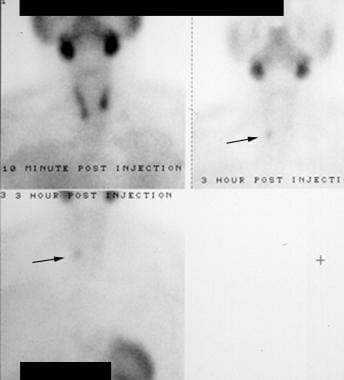 Hyperparathyroïdie. Scintigraphie au radionucléide technétium-99m (99mTc) sestamibi. L’image initiale (en haut à gauche) montre une absorption dans les glandes salivaires et la thyroïde. Les images ultérieures (à droite et en bas) montrent une disparition de la thyroïde mais une persistance dans la région du lobe inférieur droit de la thyroïde (flèches). Ceci s’est avéré être un adénome parathyroïdien droit.
Hyperparathyroïdie. Scintigraphie au radionucléide technétium-99m (99mTc) sestamibi. L’image initiale (en haut à gauche) montre une absorption dans les glandes salivaires et la thyroïde. Les images ultérieures (à droite et en bas) montrent une disparition de la thyroïde mais une persistance dans la région du lobe inférieur droit de la thyroïde (flèches). Ceci s’est avéré être un adénome parathyroïdien droit. Sur les images différées, une parathyroïde anormale est vue comme un foyer d’activité persistant. La sensibilité de la scintigraphie pour la détection des adénomes solitaires a beaucoup varié dans la littérature mais est généralement rapportée comme étant de 60-90%. La principale faiblesse de ce test réside dans le diagnostic des maladies multiglandulaires. Dans ce cas, la sensibilité chute à environ 50 %. La plupart des scintigraphies modernes au sestamibi sont réalisées par tomographie à photon unique (SPECT). Cette technique (voir l’image ci-dessous) combine la détection de la radioactivité avec l’imagerie détaillée de la tomodensitométrie, ce qui permet une meilleure sensibilité et une localisation anatomique plus précise que l’imagerie planaire standard (comme indiqué ci-dessus).
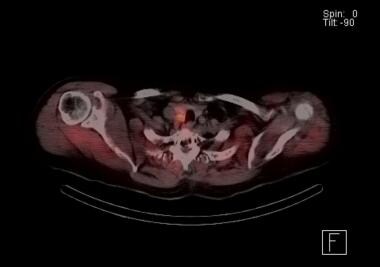 Scintigraphie parathyroïdienne au Sestamibi avec scintigraphie SPECT. L’orange indique l’accumulation de radionucléides. Les résultats indiquent la présence d’un adénome parathyroïdien droit juste derrière le lobe thyroïdien. Lors de l’exploration, on a constaté que ce patient avait des adénomes doubles adjacents à droite.
Scintigraphie parathyroïdienne au Sestamibi avec scintigraphie SPECT. L’orange indique l’accumulation de radionucléides. Les résultats indiquent la présence d’un adénome parathyroïdien droit juste derrière le lobe thyroïdien. Lors de l’exploration, on a constaté que ce patient avait des adénomes doubles adjacents à droite. Un avantage majeur de la scintigraphie parathyroïdienne au sestamibi est la possibilité de détecter des glandes parathyroïdiennes ectopiques, notamment dans le médiastin.
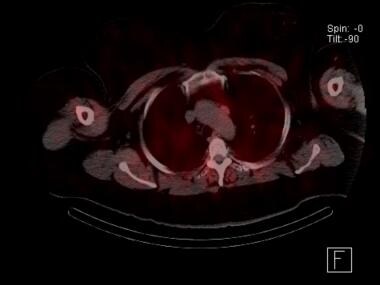 Scanner parathyroïdien au sestamibi avec SPECT scan montrant un adénome parathyroïdien médiastinal ectopique adjacent à l’arc aortique. Ce patient avait subi une exploration du cou qui avait échoué. Une excision transthoracique et robotisée a été curative.
Scanner parathyroïdien au sestamibi avec SPECT scan montrant un adénome parathyroïdien médiastinal ectopique adjacent à l’arc aortique. Ce patient avait subi une exploration du cou qui avait échoué. Une excision transthoracique et robotisée a été curative. L’utilisation de la tomodensitométrie en quatre dimensions (4D) pour la localisation des parathyroïdes est en augmentation. L’étude peut être réalisée sans contraste ou avec une imagerie de contraste dynamique. Les adénomes parathyroïdiens se rehaussent fortement avec le contraste en raison de leur haute vascularisation, puis le contraste s’efface rapidement. Les études par tomodensitométrie quadridimensionnelle ont montré des taux de sensibilité atteignant 88 %. La plus grande étude rétrospective disponible au moment de la rédaction de cet article a rapporté une sensibilité globale de 79 %. Comme d’autres études d’imagerie, la tomodensitométrie 4D est moins sensible pour détecter une maladie multiglandulaire (43-67 % ) qu’une maladie monoglandulaire (92-94 % ). Certaines études ont fait valoir qu’une tomodensitométrie à deux phases est aussi efficace que la modalité 4D pour la localisation des parathyroïdes, y compris dans les cas de petits adénomes, de réintervention et de maladie multiglandulaire, avec une exposition moindre aux radiations pour le patient. ) Cependant, si la technique biphasée permet de réduire l’exposition aux radiations, c’est probablement au prix d’une précision optimale.
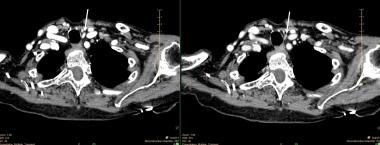 Un petit adénome parathyroïdien inférieur gauche comme démontré sur un scanner 4D-CT. Le panneau de gauche est une image unique de la phase de contraste précoce montrant un rehaussement intense. Le panneau de droite montre une disparition rapide du contraste. Les flèches blanches pointent vers l’adénome.
Un petit adénome parathyroïdien inférieur gauche comme démontré sur un scanner 4D-CT. Le panneau de gauche est une image unique de la phase de contraste précoce montrant un rehaussement intense. Le panneau de droite montre une disparition rapide du contraste. Les flèches blanches pointent vers l’adénome. L’imagerie par résonance magnétique (IRM) n’a pas été couramment utilisée pour la localisation de la parathyroïde dans la plupart des centres, et les études concernant cette modalité ont généralement été de petite taille et ont toutes utilisé un contraste. De nouvelles techniques, conceptuellement similaires au scanner 4D-CT, sont en cours de développement et pourraient augmenter la sensibilité de l’IRM et étendre son utilité.
L’absorptiométrie radiographique à double énergie est un outil utile pour démontrer l’atteinte du squelette dans l’hyperparathyroïdie primaire. Notez que l’hyperparathyroïdie affecte préférentiellement l’os cortical au niveau du radius (tiers distal). En cas d’hyperparathyroïdie primaire sévère, les radiographies du squelette montrent des changements pathognomoniques tels que la dégranulation sel et poivre dans le crâne et la résorption osseuse sous-périostée dans les phalanges. Cependant, les radiographies simples ne sont généralement pas utiles pour un emploi de routine dans le diagnostic et le traitement de l’hyperparathyroïdie.
Une étude de Thimmappa et al a suggéré que les études d’imagerie peuvent être utilisées à la place des dosages parathyroïdiens peropératoires (discutés ci-dessous) pour prédire la guérison dans la chirurgie de l’hyperparathyroïdie primaire. Les investigateurs ont décrit le protocole suivant :
-
Deux études de localisation préopératoires, dont une avec échographie réalisée par le chirurgien, sont réalisées
-
Les niveaux préopératoires de vitamine D sont évalués, avec une supplémentation fournie comme indiqué
Le rapport a soutenu que chez certains patients sélectionnés avec une forte corroboration entre les deux études de localisation et des résultats peropératoires qui sont cohérents avec ces études, les dosages parathyroïdiens peropératoires peuvent ne pas être nécessaires, l’étude ayant constaté que les taux de guérison chez les patients chez qui ce protocole était employé étaient égaux à ceux atteints en utilisant les dosages parathyroïdiens.
Procédures
Le prélèvement de la veine jugulaire interne bilatérale est utilisé pour aider à localiser les adénomes parathyroïdiens ectopiques, généralement en cas d’échec de l’exploration chirurgicale lorsque les techniques d’imagerie standard n’ont pas été utiles. Cette technique doit généralement être réservée aux centres disposant de spécialistes et à des patients hautement sélectionnés.
Traitement
L’excision chirurgicale des glandes parathyroïdes anormales (voir ci-dessous pour les détails du traitement chirurgical) offre le seul traitement permanent et curatif de l’hyperparathyroïdie primaire. Il est universellement admis que le traitement chirurgical doit être proposé à tous les patients présentant une maladie symptomatique. Les auteurs notent toutefois que les symptômes sont souvent négligés par les médecins et les patients ; la fatigue est un symptôme extrêmement courant qui est souvent ignoré, en particulier chez les personnes âgées, qui l’attribuent généralement au vieillissement ou à d’autres causes. Une certaine controverse existe concernant la gestion optimale des patients asymptomatiques.
Les lignes directrices pour la gestion de l’hyperparathyroïdie primaire asymptomatique ont été mises à jour en 2013 par le quatrième atelier international sur l’hyperparathyroïdie primaire asymptomatique. Les indications de la chirurgie sont les suivantes :
-
Calcium sérique >1 mg/dL au-dessus de la limite supérieure de la fourchette de référence
-
Densité minérale osseuse T-score égal ou inférieur à -2.5 (chez les femmes périménopausées ou postménopausées et chez les hommes âgés de 50 ans ou plus) au niveau du rachis lombaire, de la hanche totale, du col fémoral, ou au 1/3 distal du radius
-
Fracture vertébrale mise en évidence par radiographie ou évaluation de la fracture vertébrale (VFA)
-
Dégagement de la créatinine de < 60 cc/min
-
Excrétion urinaire de calcium sur vingt-quatre heuresexcrétion urinaire de calcium sur quatre heures >400 mg/jour et augmentation du risque de calculs évaluée par une analyse biochimique du risque de calculs.
-
Présence d’une néphrolithiase ou d’une néphrocalcinose déterminée par radiographie, échographie, ou de la tomodensitométrie
-
Age inférieur à 50 ans
Certains cliniciens préconisent un traitement chirurgical chez tous les patients atteints d’hyperparathyroïdie primaire, modifié uniquement pour les patients qui ne peuvent pas tolérer la chirurgie. Ils font valoir que l’opération est généralement bien tolérée, que ce traitement prévient les complications (par exemple, l’ostéoporose) et qu’il peut inverser des symptômes dont les patients ne se rendent souvent pas compte qu’ils sont atteints (par exemple, la fatigue, une légère dépression). En outre, le suivi des patients asymptomatiques est coûteux et fastidieux. Cette approche plus libérale a été formulée par un groupe d’experts réuni par l’American Association of Clinical Endocrinologists et l’American Association of Endocrine Surgeons. Ils ont conclu que « …la prise en charge chirurgicale devrait être envisagée et recommandée pour tous les patients asymptomatiques atteints de TSPP qui ont une espérance de vie raisonnable et des facteurs de risque opératoires et anesthésiques appropriés. » Cette approche proactive, comme pour toutes les parathyroïdectomies, devrait dépendre de la disponibilité d’un chirurgien expérimenté et bien formé.
Une étude d’enquête menée par Sharata et al auprès de prestataires de soins primaires aux États-Unis a révélé que seule une minorité de répondants montrait une connaissance ferme des stratégies de gestion de l’hyperparathyroïdie primaire. Les chercheurs ont constaté que 31% des 109 cliniciens ayant répondu à l’enquête connaissaient l’ensemble des critères relatifs à l’intervention chirurgicale chez les patients asymptomatiques et que 34% étaient capables d’identifier avec précision les tests de surveillance corrects pour les patients en observation. Parmi les patients sous observation, seuls 16% ont subi des études de surveillance correctes.
Gestion de l’hypercalcémie sévère dans le contexte aigu
La réduction du calcium sérique élevé peut être accomplie par l’utilisation d’une expansion du volume intravasculaire avec du chlorure de sodium et des diurétiques de l’anse tels que le furosémide une fois que le volume intravasculaire est restauré. Des médicaments tels que la calcitonine et le bisphosphonate IV ont été utilisés comme mesure temporaire avant le traitement chirurgical.
Soins non chirurgicaux et surveillance à long terme
Les patients symptomatiques qui ne subissent pas de chirurgie nécessitent une surveillance à long terme. Les recommandations comprennent l’évaluation des signes et symptômes manifestes d’hyperparathyroïdie chaque année, le dosage annuel du calcium sérique et de la créatinine, et l’évaluation de la densité minérale osseuse (colonne vertébrale, hanche et avant-bras) tous les 1 à 2 ans.
Les patients atteints d’hyperparathyroïdie primaire doivent maintenir un apport quotidien modéré en calcium élémentaire de 800 à 1000 mg et un apport en vitamine D adapté à leur âge et à leur sexe. Le maintien d’une bonne hydratation, la participation à une activité physique régulière et l’évitement de l’immobilisation et de certains médicaments (tels que les thiazides, les diurétiques et le lithium) sont souhaitables.
Pharmacothérapie
Il a été démontré que l’œstrogénothérapie chez les femmes ménopausées entraîne une légère réduction du calcium sérique (0,5-1 mg/dL) sans modification de l’hormone parathyroïdienne. Les œstrogènes ont également des effets bénéfiques sur la densité minérale osseuse (DMO) de la colonne lombaire et du col du fémur. Cependant, en raison des risques associés à la substitution œstrogénique, elle ne doit pas être utilisée dans le seul but de traiter l’hyperparathyroïdie primaire.
Il a été démontré que les modulateurs sélectifs des récepteurs œstrogéniques tels que le raloxifène entraînent une diminution du calcium sérique de la même ampleur que celle observée avec les œstrogènes.
Il a été démontré que les bisphosphonates, en particulier l’alendronate, améliorent la DMO au niveau de la colonne vertébrale et de la hanche chez les patients atteints d’hyperparathyroïdie primaire. Aucune modification significative de l’hormone parathyroïdienne, du calcium ou du calcium urinaire de 24 heures n’a été rapportée. Un traitement par un bisphosphonate tel que l’alendronate peut être envisagé chez les patients atteints d’hyperparathyroïdie primaire et de faible DMO qui ne peuvent ou ne veulent pas subir de chirurgie.
Les médicaments calcimimétiques activent le récepteur de détection du calcium et inhibent la fonction des cellules parathyroïdiennes. Le traitement par le cinacalcet a entraîné une réduction sans normalisation des taux de parathormone, une réduction et même une normalisation du calcium sérique, mais aucune augmentation de la DMO n’a été observée.
Autres traitements
L’injection percutanée d’alcool, l’ablation par énergie ultrasonore et d’autres techniques d’ablation percutanée de la glande parathyroïde ont été suggérées comme traitements alternatifs chez les patients atteints d’hyperparathyroïdie primaire qui ne peuvent ou ne veulent pas subir de chirurgie. Bien que les études sur ces techniques se poursuivent, leur utilisation systématique ne peut pas encore être soutenue.
Soins chirurgicaux
Un traitement chirurgical devrait être proposé à la plupart des patients atteints d’hyperparathyroïdie primaire. Le critère historique-l’approche opératoire standard est l’exploration complète du cou avec identification de toutes les glandes parathyroïdes et l’ablation de toutes les glandes anormales. Environ 85 % des cas d’hyperparathyroïdie primaire sont causés par un seul adénome. Par conséquent, la plupart des patients qui subissent une exploration complète du cou pour évaluer toutes les parathyroïdes subissent une dissection inutile. Plutôt que d’explorer toutes les glandes parathyroïdes, une technique plus récente, la parathyroïdectomie dirigée, a évolué. Cette technique s’appuie sur des études d’imagerie préopératoire pour localiser la glande anormale. Le chirurgien retire alors uniquement cette glande, sans visualiser les autres glandes.
Avec les techniques d’imagerie modernes, une parathyroïde anormale peut être détectée en préopératoire dans 70 à 80 % des cas. Cependant, aucune étude d’imagerie actuelle n’est fiable pour détecter plusieurs glandes anormales. Par conséquent, une méthode supplémentaire est nécessaire pour confirmer qu’aucune autre glande anormale n’est présente après l’excision de la lésion imagée. À cette fin, la plupart des centres utilisent le dosage peropératoire de l’hormone parathyroïdienne. La demi-vie plasmatique de l’hormone parathyroïdienne n’étant que d’environ 4 minutes, le taux chute rapidement après la résection de la source. Si le taux ne baisse pas après la résection de la glande anormale identifiée, la procédure est prolongée pour permettre une exploration plus approfondie. Cependant, le dosage peropératoire de l’hormone parathyroïdienne n’est généralement disponible que dans les centres qui réalisent un volume élevé de parathyroïdectomies.
Quelques auteurs ont préconisé la parathyroïdectomie radioguidée, détectant le sestamibi marqué dans la glande anormale à l’aide d’une sonde portative. La plupart des centres ont abandonné cette technique car si la glande se marque bien au sestamibi, ce qui permet une imagerie préopératoire adéquate, l’utilisation de la sonde portative en peropératoire est inutile dans la plupart des cas.
Greene et al ont examiné les tendances dans l’utilisation par les chirurgiens de l’exploration bilatérale ou limitée pour la parathyroïdectomie entre 1998 et 2008. En interrogeant 256 chirurgiens (membres de l’American Association of Endocrine Surgeons et de l’American College of Surgeons), qui représentaient ensemble 46 % des opérations parathyroïdiennes aux États-Unis, les chercheurs ont constaté qu’en 2008, 10 % des chirurgiens employaient l’exploration bilatérale du cou, 68 % l’exploration limitée et 22 % les deux techniques d’exploration dans leur pratique. En 1998, les statistiques pour les chirurgiens utilisant l’exploration bilatérale, limitée ou les deux types d’exploration étaient respectivement de 74%, 11% et 15%. L’étude indique que les médecins les plus susceptibles d’utiliser l’exploration limitée sont les chirurgiens endocriniens, les chirurgiens ayant une pratique à fort volume et les chirurgiens dont les mentors utilisaient l’exploration limitée.
Les auteurs ont également constaté qu’en 2008, la moitié des chirurgiens généralistes interrogés n’ont jamais contrôlé l’hormone parathyroïdienne en peropératoire (qu’ils utilisent l’exploration bilatérale ou limitée), alors que cela était vrai pour moins de 10% des chirurgiens endocriniens. En outre, il y avait de grandes variations « entre les sous-ensembles de chirurgiens en ce qui concerne les volumes opératoires, les indications de l’exploration bilatérale du cou, les soins, l’expertise avec et sestamibi, et les perceptions des taux de guérison et de complications ». Greene et ses coauteurs ont conclu qu’en raison des nombreuses différences qui existent dans la prise en charge chirurgicale de l’hyperparathyroïdie, il pourrait être nécessaire de définir des lignes directrices sur les meilleures pratiques.
Pour les maladies familiales, telles que le MEN 1, une parathyroïdectomie totale est réalisée avec une thymectomie cervicale et une autotransplantation à l’avant-bras. La cryoconservation d’une partie du tissu parathyroïdien est également recommandée.
La parathyroïdectomie est généralement bien tolérée. Les principaux risques sont la lésion des nerfs laryngés récurrents et l’hypoparathyroïdie due à la résection ou à la dévascularisation de toutes les glandes parathyroïdes. Bien que l’anesthésie locale ait été utilisée avec succès pour cette intervention, notamment dans les approches dirigées au cours desquelles un seul adénome est localisé en préopératoire, l’anesthésie générale est le plus souvent utilisée. Chez les patients chez qui l’hypercalcémie (et, par conséquent, la déshydratation) a été sévère, une attention particulière doit être portée à la restauration périopératoire de l’équilibre hydrique. La mobilité du cou doit être évaluée pour assurer un positionnement correct dans la salle d’opération.
Technique d’exploration complète du cou avec identification de toutes les glandes parathyroïdes
L’aspect le plus critique pour assurer le succès de cette opération est l’identification des 4 glandes parathyroïdes et l’élimination de toutes les glandes anormales. En cas d’hyperplasie de 4 glandes, une parathyroïdectomie de 3,5 glandes (subtotale) est réalisée. Environ 50 à 70 mg de tissu d’apparence normale sont laissés en place. Une suture non absorbable est laissée comme marqueur pour identifier la glande si une réintervention est nécessaire.
Le patient est placé dans la position de la chaise à gazon avec le cou étendu sur un rouleau d’épaule placé transversalement. Cette position permet une exposition complète des structures antérieures du cou et améliore le drainage veineux.
Une incision transversale basse placée dans un pli cutané donne le meilleur résultat cosmétique. La longueur de l’incision doit être adéquate pour permettre une exploration approfondie de tous les emplacements potentiels des glandes parathyroïdes ; cependant, étant donné l’élasticité des lambeaux cutanés du cou, une incision de 2 à 5 cm permet généralement une identification sûre des structures importantes.
Après l’obtention de l’hémostase de l’incision cutanée, des lambeaux sous-platysmaux sont développés supérieurement à l’encoche du cartilage thyroïdien et inférieurement à la partie plate du manubrium. Les muscles sternohyoïdien et sternothyroïdien (sangle) sont séparés sur la ligne médiane pour exposer la glande thyroïde. Si les études de localisation préopératoires suggèrent un adénome parathyroïdien, ce côté est abordé en premier.
Fréquemment, une veine thyroïdienne moyenne peut nécessiter une ligature pour assurer une mobilisation adéquate du lobe thyroïdien. Le lobe thyroïdien est soulevé de l’artère carotide commune et rétracté médialement. L’artère thyroïdienne inférieure est identifiée après une dissection émoussée et nette du tissu aréolaire en avant et en médial de l’artère carotide commune et en postéro-médial du lobe thyroïdien. Le nerf laryngé récurrent est identifié ensuite, en dessous et latéralement du lobe inférieur de la glande thyroïde.
L’intersection de l’artère thyroïdienne inférieure et du nerf laryngé récurrent est un repère important car la plupart des glandes parathyroïdes, supérieures et inférieures, sont situées à moins de 2 cm de cette zone. Les glandes parathyroïdes supérieures sont situées en arrière des deux tiers supérieurs du lobe thyroïdien et en arrière du nerf laryngé récurrent. Les glandes inférieures, dont la localisation est moins constante, se trouvent généralement en dessous de l’artère thyroïdienne inférieure et en dessous du nerf laryngé récurrent. Elles se trouvent habituellement à moins de 1 cm du lobe inférieur de la glande thyroïde.
Occasionnellement, toutes les glandes parathyroïdes ne peuvent pas être identifiées. Dans ce cas, on réexamine d’abord les localisations habituelles car la plupart des glandes parathyroïdes sont situées dans des zones typiques. Si les glandes parathyroïdes ne sont pas identifiées dans ces emplacements, alors une recherche systématique est effectuée, en prenant en considération le chemin de descente des glandes parathyroïdes supérieures et inférieures.
Les glandes inférieures peuvent être situées dans le ligament thyrothymique. Elles peuvent être difficiles à identifier, surtout après la division de la veine thyroïdienne inférieure, une manœuvre qui permet à la glande de se rétracter dans le médiastin supérieur. Le thymus est une autre localisation des parathyroïdes inférieures ectopiques. Si une glande inférieure ne peut pas être localisée, une thymectomie cervicale peut être réalisée, en élevant autant de tissu thymique vers le haut du médiastin que cela peut être fait en toute sécurité.
Les glandes parathyroïdiennes supérieures sont généralement dorsales aux deux tiers supérieurs de la glande thyroïde. Occasionnellement, ces glandes sont adjacentes aux vaisseaux thyroïdiens supérieurs. Elles peuvent également se trouver dans la gaine carotidienne ou en arrière de l’œsophage ou du pharynx (rétro-œsophagien). Enfin, les glandes parathyroïdes supérieures et inférieures peuvent être situées de manière aberrante dans la capsule de la glande thyroïde. Certains chirurgiens effectuent une lobectomie thyroïdienne du côté de la glande anormale manquante après avoir effectué une recherche exhaustive dans les emplacements susmentionnés. La sternotomie médiane ne doit généralement pas être réalisée lors de l’exploration initiale du cou pour une hyperparathyroïdie.
Les glandes anormalement hypertrophiées sont excisées après confirmation de la taille normale des autres glandes. Pendant l’excision, il est important d’éviter la rupture capsulaire de la glande anormale car cela peut être associé à l’implantation de cellules parathyroïdiennes dans le site opératoire et à une parathyromatose ultérieure. Les parathyroïdes peuvent être identifiées par des chirurgiens très expérimentés sur la base de leur apparence et de leur localisation. Si nécessaire, l’identification des glandes parathyroïdes doit être confirmée histologiquement par un examen en coupe congelée. En cas de parathyroïdectomie totale avec autotransplantation, le tissu parathyroïdien doit être cryoconservé pour une future autotransplantation au cas où la transplantation initiale ne fonctionnerait pas correctement.
Technique de la parathyroïdectomie dirigée
À bien des égards, la technique opératoire est similaire à celle décrite ci-dessus pour une exploration complète de la parathyroïde. Les différences sont notées ci-dessous.
Une imagerie adéquate de la glande anormale avant la chirurgie est essentielle. De plus, les dispositions pour la mesure peropératoire de l’hormone parathyroïdienne doivent être confirmées. Une ligne pour l’échantillonnage du sang veineux périphérique doit être établie. Souvent, la veine saphène distale fournit l’accès le plus pratique.
Certains chirurgiens modifient l’emplacement de l’incision en fonction de la localisation préopératoire de l’adénome. Cet auteur préfère une petite incision (c’est-à-dire ~2 cm) à l’emplacement standard pour une incision de col. Cette incision peut être facilement étendue si une exploration approfondie s’avère nécessaire.
Un taux de base d’hormone parathyroïdienne est prélevé immédiatement avant l’incision cutanée. Après identification et dissection de l’adénome, un niveau de pré-excision est dessiné. La manipulation de la glande provoque occasionnellement des augmentations significatives, parfois de plus de 10 fois, du niveau de l’hormone parathyroïdienne. Après l’excision de la glande, les taux de parathormone sont mesurés 5 minutes et 10 minutes après l’excision. Les critères d’une excision adéquate sont soit une chute de 50% de l’hormone parathyroïdienne entre le niveau de base et le niveau post-excision à 10 minutes, soit une chute de 50% de l’hormone parathyroïdienne par rapport au niveau pré-excision à 10 minutes et un niveau post-excision inférieur au niveau de base.
L’incision peut être fermée pendant le traitement des derniers taux d’hormone parathyroïdienne, mais le patient doit rester sous anesthésie, et le champ stérile maintenu jusqu’à ce que les résultats du dosage de l’hormone parathyroïdienne soient connus.
Si une parathyroïdectomie dirigée est réalisée avec succès, la plupart de ces patients peuvent sortir en toute sécurité le jour de la chirurgie.
Complications et soins postopératoires
Pour une exploration parathyroïdienne complète, l’hypoparathyroïdie et l’hypocalcémie postopératoires sont des préoccupations, mais elles sont extrêmement rares après une parathyroïdectomie dirigée et une exploration limitée du cou. L’hypocalcémie est plus fréquente après une exploration parathyroïdienne bilatérale, surtout lorsqu’une parathyroïdectomie subtotale est réalisée. Le nadir du calcium sérique survient généralement 24 à 72 heures après l’opération. De nombreux patients deviennent hypocalcémiques, mais peu deviennent symptomatiques. D’autre part, même lorsqu’une exploration limitée a été réalisée, de légers symptômes d’hypocalcémie peuvent apparaître dans les premiers jours suivant la parathyroïdectomie en l’absence d’hypocalcémie vérifiable. Pour cette raison, certains praticiens administrent systématiquement des suppléments de calcium par voie orale en postopératoire.
L’hypocalcémie après une chirurgie parathyroïdienne peut être due au syndrome de l’os affamé où le calcium et le phosphore se déposent rapidement dans l’os. Cela se caractérise par une hypoparathyroïdie et une hypocalcémie transitoire, mais parfois grave, jusqu’à ce que les glandes normales retrouvent leur sensibilité.
Si l’hypoparathyroïdie persiste, une supplémentation orale en calcium et en vitamine D est nécessaire. On peut commencer par le citrate ou le carbonate de calcium à raison de 400 à 600 mg de calcium élémentaire quatre fois par jour. Certains patients ont besoin de beaucoup plus. On commence à administrer du calcitriol à raison de 0,5 µg deux fois par jour et on l’augmente au besoin. On peut s’attendre à ce que les patients chez qui une parathyroïdectomie totale et une autotransplantation sont effectuées aient besoin d’une supplémentation temporaire en calcium.
Si un nerf laryngé récurrent est sectionné pendant la parathyroïdectomie, une réparation immédiate est indiquée. Si le nerf récurrent n’est pas connu pour être lésé en peropératoire mais qu’un dysfonctionnement est suggéré parce que le patient a développé un nouvel enrouement, une gestion expectative est choisie initialement puisque la plupart des patients récupèrent la fonction nerveuse en quelques semaines à quelques mois. La laryngoscopie est indiquée pour documenter à la fois le dysfonctionnement et la récupération de la fonction.
Une urgence potentiellement mortelle dans la période postopératoire est le développement d’un hématome en expansion dans l’espace prétrachéal. Cette complication doit être reconnue et traitée immédiatement en ouvrant la plaie et en évacuant l’hématome. S’il n’est pas traité, l’œdème du larynx peut progresser rapidement et provoquer une obstruction des voies respiratoires. De plus, l’œdème peut empêcher l’intubation endotrachéale, et l’ouverture de la plaie doit précéder toute tentative d’intubation.
La plupart des petits hématomes ne nécessitent pas de traitement. Une collection de liquide subplatysmique peut occasionnellement se former, et ceux-ci sont généralement traités de manière adéquate avec une seule aspiration. Dans quelques cas, l’aspiration peut devoir être répétée. Rarement, un drain peut devoir être placé pour des collections de liquide récurrentes.
Résultats du traitement
Les taux de guérison après une chirurgie pour une hyperparathyroïdie primaire sont très élevés dans des mains expertes, environ 97-98%. Une guérison est généralement définie comme une normalisation du calcium sérique. Les taux d’hormone parathyroïdienne peuvent cependant être élevés après l’opération chez 20 à 40 % des patients. Si le calcium sérique reste dans la plage de référence, cet état élevé ne suggère généralement pas une maladie persistante mais peut indiquer un risque plus élevé de récidive. De nombreux patients atteints d’hyperparathyroïdie primaire présentent une carence en vitamine D, et son remplacement peut corriger la concentration élevée d’hormone parathyroïdienne. Il existe également quelques preuves faibles que la supplémentation en calcium peut diminuer une élévation isolée de l’hormone parathyroïdienne après une parathyroïdectomie.
Il a été démontré à plusieurs reprises que la qualité de vie s’améliore après une parathyroïdectomie. Notamment, on a également constaté que la qualité de vie subissait une amélioration mesurable chez les patients « asymptomatiques », ce qui souligne le fait que certains symptômes légers peuvent passer inaperçus aux yeux des patients et des cliniciens.
Suivi
Les patients sont revus une à deux semaines après l’opération, et on obtient les taux sériques de calcium, de 25-hydroxyvitamine D et de parathormone. La carence en vitamine D est particulièrement fréquente chez les patients atteints d’hyperparathyroïdie. De nombreux praticiens ajoutent systématiquement une supplémentation en calcium et en vitamine D en postopératoire pour aider à restaurer la perte osseuse et compléter un mauvais apport alimentaire.
Une analyse a montré que le taux de récidive après une parathyroïdectomie réussie est d’environ 10-15% avec un suivi à long terme, ce qui est beaucoup plus élevé que ce que l’on pensait historiquement. Un suivi à long terme est donc recommandé, avec des déterminations annuelles du calcium et de l’hormone parathyroïdienne.