Abstract
L’hémithyroïdectomie, ou lobectomie thyroïdienne unilatérale, désigne l’ablation de la moitié de la glande thyroïde. L’intervention est généralement réalisée pour des nodules thyroïdiens suspects ou de petits cancers différenciés de la thyroïde basés sur une biopsie par aspiration à l’aiguille fine (FNA) et occasionnellement pour des nodules thyroïdiens bénins symptomatiques. Dans la plupart des établissements, l’opération peut être réalisée en toute sécurité en ambulatoire et le patient peut quitter l’hôpital le jour même. Elle est généralement réalisée par une incision du col transcervical, mais des voies endoscopiques et transorales ont été décrites. L’intervention implique la mobilisation du lobe thyroïdien, la ligature des vaisseaux thyroïdiens, la préservation des parathyroïdes, la protection du nerf laryngé récurrent et la dissection à distance de la trachée. Chez ce patient, un nodule thyroïdien a été détecté et s’est avéré avoir des caractéristiques indéterminées lors de la biopsie par FNA. Une hémithyroïdectomie a alors été réalisée à des fins de diagnostic.
Synthèse du cas
Contexte
Les nodules thyroïdiens sont une découverte clinique fréquente ; près de 20 à 70 % des individus qui subissent une échographie cervicale peuvent avoir des nodules thyroïdiens1,2. Bien que la majorité de ces nodules soient bénins, 7 à 15 % des patients peuvent avoir un cancer de la thyroïde3,4 dont plus de 90 % sont différenciés (cancers papillaires ou folliculaires).5 Sur la base des caractéristiques échographiques, les nodules thyroïdiens peuvent être classés comme bénins, à faible suspicion, à suspicion intermédiaire ou à forte suspicion de malignité6. Les cliniciens se basent sur les caractéristiques échographiques du nodule ainsi que sur les analyses de laboratoire de la fonction thyroïdienne pour déterminer si un nodule doit être biopsié par aspiration à l’aiguille fine (FNA). Une fois qu’un nodule radiologiquement suspect a été biopsié, un cytopathologiste classe les cellules selon le système de classification de Bethesda, qui fournit aux endocrinologues et aux chirurgiens endocriniens une estimation du risque de malignité7,8. Cette information peut ensuite être utilisée pour déterminer quels patients ont besoin d’une hémithyroïdectomie ou peuvent bénéficier d’un profilage moléculaire.9
Histoire ciblée du patient
Le patient est un homme de 51 ans chez qui on a découvert fortuitement un nodule thyroïdien droit lors d’une tomodensitométrie du thorax qui a été obtenue après un accident de voiture. Il ne présentait aucun symptôme ou signe d’hyper- ou d’hypothyroïdie. Il s’est ensuite présenté chez son médecin traitant qui a procédé à un examen physique, demandé des analyses de la fonction thyroïdienne, une imagerie et, finalement, une biopsie FNA. Les examens de laboratoire étaient normaux. L’échographie a révélé un nodule de 2,3 cm dans le lobe droit de la thyroïde, avec des caractéristiques très suspectes. La biopsie a été jugée compatible avec une » atypie de signification indéterminée » ou AUS. Le patient avait également des antécédents familiaux de cancer de la thyroïde ; sa sœur et son grand-père paternel avaient tous deux été traités pour un carcinome papillaire de la thyroïde. Compte tenu de ses antécédents familiaux et des résultats de l’échographie et de la biopsie, une hémithyroïdectomie diagnostique a été recommandée.
Examen physique
L’évaluation des nodules thyroïdiens commence par un examen physique axé sur la glande thyroïde ainsi que sur les ganglions cervicaux adjacents.6 La glande thyroïde doit être évaluée pour détecter d’autres nodules. Les nodules supplémentaires peuvent finalement influencer l’opération pratiquée. La texture du nodule et sa mobilité doivent être évaluées. Des nodules fixes et fermes peuvent indiquer une pathologie plus agressive. Toute lymphadénopathie ou cicatrice d’opérations antérieures du cou doit être notée. Une lymphadénopathie peut signifier la propagation métastatique d’un cancer. Les anomalies de la voix du patient notées par le patient, les membres de sa famille ou le médecin doivent faire l’objet d’une évaluation plus approfondie et peuvent nécessiter une laryngoscopie pour exclure une atteinte du nerf laryngé récurrent. L’habitus du patient, la largeur du cou, la longueur du cou, les plis naturels de la peau et la taille de la thyroïde et du nodule aident le chirurgien à décider où l’incision doit être placée.
Pour ce patient particulier, il y avait un nodule de 2,3 cm découvert accidentellement dans le lobe thyroïdien droit. C’était un homme maigre et donc, le nodule était palpable à l’examen physique. Il était mobile et caoutchouteux. Il n’y avait pas d’autres nodules palpables dans la thyroïde. Il n’y avait aucun signe d’adénopathie cervicale, aucune modification de la voix et aucune cicatrice chirurgicale antérieure. L’IMC du patient était de 23 et la largeur et la longueur de son cou étaient adaptées à sa taille. Tous les repères habituels, y compris les limites des muscles sterno-cléido-mastoïdiens, les cartilages thyroïde et cricoïde, et l’échancrure suprasternale étaient facilement discernables et palpables.
Imagerie
L’échographie thyroïdienne est la modalité d’imagerie de choix pour les patients présentant une suspicion de nodule thyroïdien ou un résultat radiographique suggérant un nodule thyroïdien vu fortuitement sur une autre imagerie (scanner, etc.).6 L’échographie peut aider à caractériser la taille du nodule ainsi qu’à obtenir des données importantes concernant les caractéristiques du nodule. L’échographie peut aider à caractériser la taille du nodule et à obtenir des données importantes sur ses caractéristiques, notamment sa composition, son échogénicité, ses marges, la présence de calcifications et sa forme. L’ensemble de ces informations peut ensuite être utilisé pour stratifier le risque d’un nodule et déterminer si une FNA est indiquée. En général, les constatations d’hypoéchogénicité, d’irrégularité, de nodules plus hauts que larges et la présence de microcalcifications à l’intérieur du nodule augmentent le risque d’une éventuelle malignité.6 D’autres modalités d’imagerie telles que la tomodensitométrie ou l’IRM du cou sont généralement réservées aux patients dont la maladie est plus avancée, comme les carcinomes agressifs avec une extension ganglionnaire locale ou étendue6.
Pour ce patient, l’échographie a révélé un nodule hétérogène mesurant 2,3 cm dans sa plus grande dimension avec des microcalcifications, comme le montrent les figures 1 et 2.
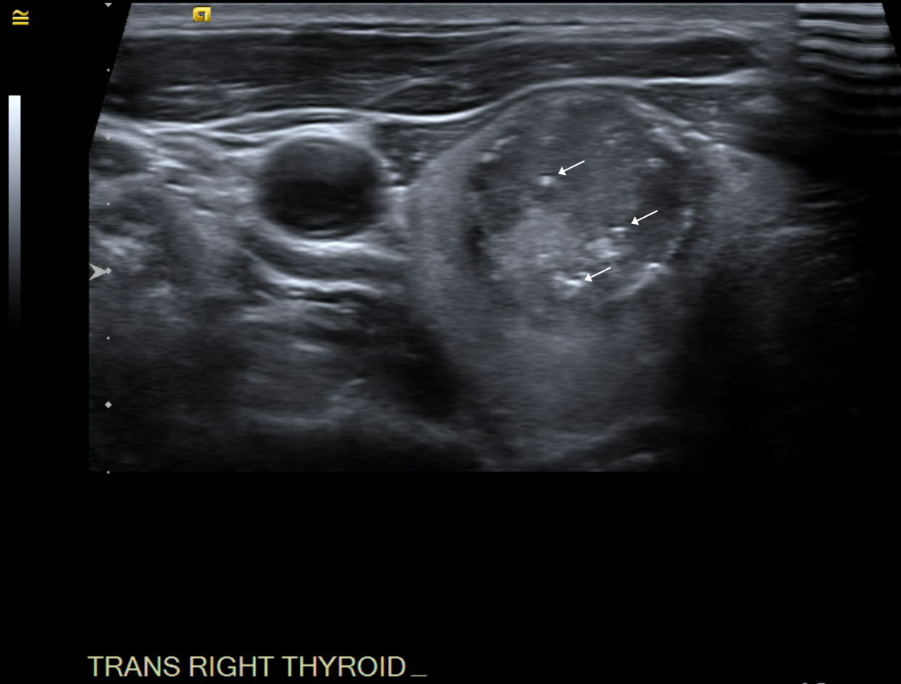 Figure 1. Vue transversale d’un nodule à l’intérieur du lobe thyroïdien droit ; les flèches blanches dénotent des microcalcifications.
Figure 1. Vue transversale d’un nodule à l’intérieur du lobe thyroïdien droit ; les flèches blanches dénotent des microcalcifications. 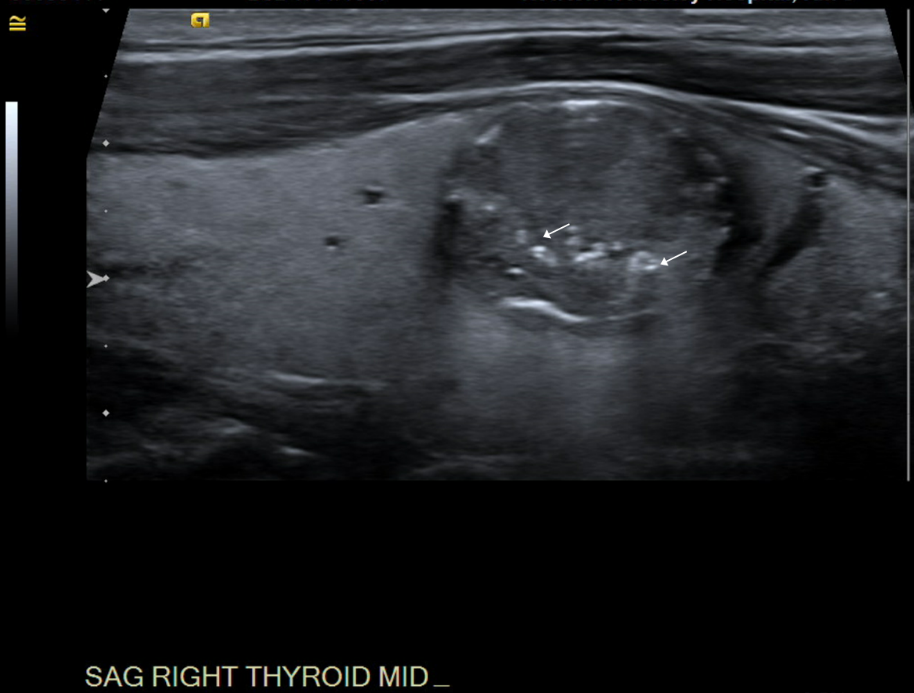 Figure 2. Vue sagittale d’un nodule.
Figure 2. Vue sagittale d’un nodule. Histoire naturelle
L’histoire naturelle des nodules cytologiquement bénins n’est pas entièrement comprise ; cependant, les données disponibles suggèrent qu’une majorité de nodules augmentent effectivement en taille dans les 3 à 5 années suivantes après la détection initiale.10,11 En fin de compte, cela peut nécessiter une intervention chirurgicale en raison des symptômes ou une biopsie répétée. Cependant, il ne semble pas que la croissance d’un nodule soit corrélée à un risque accru de malignité.10-12
L’histoire naturelle du cancer différencié de la thyroïde non traité et prouvé par biopsie est plus difficile à comprendre, étant donné que la plupart de ces patients sont opérés. Cependant, l’observation de petits cancers papillaires de la thyroïde de moins de 1 cm a suscité un intérêt récent, tant qu’il n’y a pas de facteurs de risque de maladie plus avancée ou agressive. Avec des données limitées, il semble que ces petits carcinomes papillaires ne progressent pas de façon spectaculaire avec le temps et que beaucoup d’entre eux peuvent être observés sans traitement.13
Options de traitement
Les options de traitement des nodules thyroïdiens dépendent des résultats radiographiques, des résultats de la biopsie, des études de la fonction thyroïdienne et des symptômes locaux. Si un nodule semble bénin à l’échographie, ne provoque pas de symptômes et n’entraîne pas d’hyperthyroïdie, il peut être observé. Les nodules d’apparence bénigne qui sont compatibles avec un adénome toxique ou un goitre multinodulaire toxique peuvent être traités par chirurgie, thérapie par radio-iode ou thionamides. Les nodules suspects à l’échographie doivent être biopsiés. Si les résultats de la biopsie sont bénins, l’observation peut être poursuivie. Une biopsie répétée peut être indiquée si la FNA initiale n’est pas diagnostique. Pour les patients dont les résultats de la biopsie sont indéterminés ou suspects, une stratification supplémentaire du risque peut être obtenue par des tests de profilage moléculaire, ou les patients peuvent envisager de subir une hémithyroïdectomie diagnostique.6 L’observation est également une option, selon les facteurs de risque du patient. Pour ceux qui ont des résultats de biopsie indéterminés/suspicieux et plusieurs nodules dans les lobes thyroïdiens bilatéraux ou avec une hypothyroïdie sous-jacente, une thyroïdectomie totale pourrait être envisagée comme traitement initial.
Raison d’être du traitement
Ce patient a plusieurs raisons de procéder à la chirurgie, et spécifiquement à une hémithyroïdectomie diagnostique. Premièrement, le nodule présentait des caractéristiques suspectes d’après l’échographie. Deuxièmement, les résultats de la biopsie étaient indéterminés. Troisièmement, il a des antécédents familiaux de cancer de la thyroïde, ce qui augmente son risque global. S’il voulait vraiment éviter la chirurgie, il aurait pu envisager d’établir le profil moléculaire du nodule, afin de stratifier davantage le risque de sa lésion. Cependant, étant donné qu’il est par ailleurs en forme et en bonne santé, une procédure à faible risque comme une hémithyroïdectomie est une voie très raisonnable et définitive à poursuivre par rapport au profilage moléculaire.
Discussion
L’histoire de la chirurgie de la thyroïde remonte aux années 1800, lorsque Theodor Billroth a commencé à pratiquer l’opération en Suisse. À cette époque, les résultats étaient médiocres et plusieurs de ses assistants chirurgicaux et stagiaires ont donc tenté de les améliorer. Le plus grand succès a été celui de Theodor Kocher, qui a été le premier à décrire la lobectomie unilatérale dans le but de minimiser l’hypothyroïdie postopératoire.14
Depuis cette époque, la thyroïdectomie est devenue une opération très sûre avec des taux de complications très faibles. Dans de nombreux centres, une hémithyroïdectomie est réalisée en ambulatoire. Les patients peuvent généralement rentrer chez eux quelques heures après l’opération.
Historiquement, le cancer de la thyroïde était traité de manière agressive, la plupart des patients subissant une thyroïdectomie totale. La littérature actuelle suggère qu’il n’y a que peu ou pas de différence de survie chez certains patients atteints de petits cancers à faible risque qui subissent une hémithyroïdectomie par rapport à une thyroïdectomie totale.6,15 Ainsi, de plus en plus de patients se voient offrir l’option d’une hémithyroïdectomie, en particulier dans le cas d’un nodule indéterminé ou suspect basé sur une biopsie. En outre, un nombre important de recherches sont menées sur les bases génétiques et moléculaires du cancer de la thyroïde, ce qui pourrait conduire à la création de cibles génétiques pour le traitement. Collectivement, ces découvertes pourraient conduire à la nécessité d’une chirurgie thyroïdienne moins agressive à l’avenir. En fin de compte, la décision pour la chirurgie l’étendue de l’opération est une discussion entre le chirurgien, les endocrinologues, et le patient.
Pour ce patient, la pathologie finale a révélé un carcinome thyroïdien papillaire mesurant 2,1 cm dans la dimension maximale. Il n’y avait pas d’autres caractéristiques suggérant une maladie agressive ; cependant, le patient a soigneusement examiné les risques et les avantages de l’observation du lobe controlatéral par rapport à la thyroïdectomie complète. Compte tenu de ses antécédents familiaux, il a finalement choisi de procéder à une thyroïdectomie d’achèvement, qui a été réalisée sans complication. Il se porte maintenant bien avec une surveillance continue.
Équipement
Localisateur de nerfs Nerveana, Neurovision Medical Products
Disclosions
Les auteurs n’ont aucune divulgation à signaler.
Déclaration de consentement
Le patient mentionné dans cet article vidéo a donné son consentement éclairé pour être filmé et est conscient que les informations et les images seront publiées en ligne.
Citations
- Tan GH, Gharib H. Incidentalomes thyroïdiens : approches de gestion des nodules non palpables découverts fortuitement sur l’imagerie thyroïdienne. Ann Intern Med. 1997;126(3):226-231. doi:10.7326/0003-4819-126-3-199702010-00009.
- Guth S, Theune U, Aberle J, Galach A, Bamberger CM. Prévalence très élevée des nodules thyroïdiens détectés par un examen échographique à haute fréquence (13 MHz). Eur J Clin Invest. 2009;39(8):699-706. doi:10.1111/j.1365-2362.2009.02162.x.
- Hegedüs L. Le nodule thyroïdien. N Engl J Med. 2004;351(17):1764-1771. doi:10.1056/NEJMcp031436.
- Mandel SJ. Une femme de 64 ans avec un nodule thyroïdien. JAMA. 2004;292(21):2632-2642. doi:10.1001/jama.292.21.2632.
- Sherman SI. Carcinome de la thyroïde. Lancet. 2003;361(9356):501-511. doi:10.1016/S0140-6736(03)12488-9.
- Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer : Le groupe de travail des directives de l’American Thyroid Association sur les nodules thyroïdiens et le cancer différencié de la thyroïde. Thyroïde. 2016;26(1):1-133. doi:10.1089/thy.2015.0020.
- Cibas ES, Ali SZ. Le système Bethesda pour la déclaration de la cytopathologie thyroïdienne. Am J Clin Catholic. 2009;132(5):658-665. doi:10.1309/AJCPPHLWMI3JV4LA.
- Bongiovanni M, Spitale A, Faquin WC, Mazzucchelli L, Baloch ZW. Le système Bethesda pour la déclaration de la cytopathologie thyroïdienne : une méta-analyse. Acta Cytol. 2012;56(4):333-339. doi:10.1159/000339959.
- Ferris RL, Baloch Z, Bernet V, et al ; American Thyroid Association Surgical Affairs Committee. Déclaration de l’American Thyroid Association sur l’application chirurgicale du profilage moléculaire pour les nodules thyroïdiens : Current Impact on Perioperative Decision Making. Thyroïde. 2015;25(7):760-768. doi:10.1089/thy.2014.0502.
- Alexander EK, Hurwitz S, Heering JP, et al. Histoire naturelle des nodules thyroïdiens solides et kystiques bénins. Ann Intern Med. 2003;138(4):315-318. doi:10.7326/0003-4819-138-4-200302180-00010.
- Ajmal S, Rapoport S, Ramirez Batlle H, Mazzaglia PJ. L’histoire naturelle du nodule thyroïdien bénin : quelle est la stratégie de suivi appropriée ? J Am Coll Surg. 2015;220(6):987-992. doi:10.1016/j.jamcollsurg.2014.12.010.
- Durante C, Costante G, Lucisano G, et al. L’histoire naturelle des nodules thyroïdiens bénins. JAMA. 2015;313(9):926-935. doi:10.1001/jama.2015.0956.
- Miyauchi A. Essais cliniques de la surveillance active du microcarcinome papillaire de la thyroïde. World J Surg. 2016;40(3):516-522. doi:10.1007/s00268-015-3392-y.
- Hannan SA. Les sept magnifiques : une histoire de la chirurgie moderne de la thyroïde. Int J Surg. 2006;4(3):187-191. doi:10.1016/j.ijsu.2006.03.002.
- Welch HG, Doherty GM. Sauver les thyroïdes – le surtraitement des petits cancers papillaires. N Engl J Med. 2018;379(4):310-312. doi:10.1056/NEJMp1804426.