Introduction : Définition des termes
Des données antérieures sur la taxonomie du Cannabis ont été précédemment examinées (Russo, 2007), qui seront ici résumées et complétées. Cannabis est une annuelle dioïque de la famille des Cannabaceae qui comprend traditionnellement le houblon, Humulus spp. Alternativement, Cannabis a également été assigné aux Moraceae, Urticaceae, ou même dans les familles Celtidaceae sur la base des cartes des sites de restriction du chloroplaste (Weigreffe et al., 1998), et des séquences du gène mat K du chloroplaste (Song et al., 2001). Plus récemment, les Cannabaceae ont subsumé huit genres : Celetis, Pteroceltis, Aphananthe, Chaetachme, Gironniera, Lozanella, Trema et Parasponia, comprenant 170 espèces (McPartland, 2018), une conclusion soutenue par l’analyse génétique de quatre loci plastidiques (Yang et al., 2013). Les recherches actuelles sur les échantillons de pollen fossile associés aux associations écologiques de Cannabis avec des espèces compagnes des steppes (Poaceae, Artemisia, Chenopodiaceae), et Humulus (houblon) avec des genres forestiers (Alnus, Salix, Populus), ont établi que, bien que Cannabis semble être originaire du plateau tibétain il y a au moins 19,6 millions d’années, il est également indigène en Europe depuis au moins un million d’années (McPartland et al, 2018), et réfuté l’idée reçue selon laquelle ce » suiveur de camp » y aurait été apporté par l’homme.
L’assignation d’espèce du Cannabis lui-même est sujette à de grands débats. Cannabis sativa, signifiant « Cannabis cultivé », a été ainsi nommé par Fuchs, entre autres, en 1542 (Fuchs, 1999), une assignation 211 ans avant la systématisation des binômes botaniques Linnaeus dans son Species Plantarum (Linnaeus, 1753). Par la suite, Lamarck a suggéré que Cannabis indica, une plante indienne enivrante plus petite et originaire d’Inde, constituait une espèce distincte (Lamarck, 1783). La question est restée sans réponse au cours des siècles suivants, avec deux philosophies opposées. Ernest Small a défendu le concept d’espèce unique (Small et Cronquist, 1976). Les traitements polytypiques de Cannabis ont également gagné des adhérents (Schultes et al., 1974 ; Anderson, 1980) sur la base de critères morphologiques suggérant la séparation de Cannabis sativa L. Cannabis indica Lam. et Cannabis ruderalis Jan., un schéma soutenu par la chimiotaxonomie systématique. Une analyse en composantes principales (ACP) de 157 accessions de Cannabis provenant du monde entier, évaluant les fréquences des allozymes à 17 loci génétiques, a suggéré une séparation (Hillig, 2005b). Les pools génétiques « Sativa » des échantillons rudéraux d’Europe de l’Est étaient liés aux plantes à fibres et à graines à feuilles étroites d’Europe et d’Asie centrale, tandis qu’un groupement « indica » englobait les plantes à graines et à fibres d’Extrême-Orient et les plantes à drogues à feuilles larges de la plupart des autres pays du monde, ainsi que les accessions sauvages du sous-continent indien. Les échantillons de bord de route d’Asie centrale (Cannabis ruderalis) étaient censés représenter un troisième groupe. Des études de chromatographie en phase gazeuse (GC) et d’électrophorèse sur gel d’amidon ont également suggéré la séparation des espèces sativa et indica (Hillig et Mahlberg, 2004).
Les facteurs agronomiques dans 69 échantillons ont suggéré l’inclusion du chanvre oriental et des plantes à drogue dans Cannabis indica (Hillig, 2005a), une division soutenue par les polymorphismes de longueur de fragment (Datwyler et Weiblen, 2006).
Plus récemment, l’ACP a semblé indiquer que la teneur en terpénoïdes était le marqueur chimiotaxonomique distinctif le plus convaincant entre les espèces putatives sativa et indica (Elzinga et al, 2015). De même, l’ACP a été ressentie comme permettant de séparer la drogue Cannabis du chanvre (Sawler et al., 2015). Une étude récente a démontré la démarcation du Cannabis drogue des accessions de chanvre via le génotypage de 13 loci microsatellites sur l’ensemble du génome, et pas seulement des gènes affectant la production de cannabinoïdes ou de fibres (Dufresnes et al., 2017). Le professeur Giovanni Appendino a signalé la présence du stéréo-isomère cis-Δ9-THC uniquement dans les accessions de chanvre (Giovanni Appendino, communication personnelle). Cependant, ces distinctions pourraient bien passer à la trappe étant donné la tendance actuelle à croiser le chanvre avec des cultivars de drogue pour éviter les restrictions législatives sur la teneur en THC.
La controverse sur les espèces de cannabis, Cannabis sativa vs indica vs afghanica, s’est poursuivie sans relâche jusqu’à aujourd’hui avec des arguments passionnés avancés par les protagonistes (Clarke et Merlin, 2013, 2016 ; Small, 2015 ; McPartland et Guy, 2017 ; Small, 2017). Cet auteur, qui a été de tous les côtés de la question à un moment ou à un autre, a choisi d’éviter le débat taxonomique irréconciliable comme une distraction inutile (Piomelli et Russo, 2016), et de souligner plutôt que seules les distinctions biochimiques et pharmacologiques entre les accessions de Cannabis sont pertinentes. Dans sa récente étude fondamentale, McPartland est d’accord : » Classer le Cannabis en ‘Sativa’ et ‘Indica’ est devenu un exercice futile. Le métissage et l’hybridation omniprésents rendent leur distinction dénuée de sens. » (McPartland, 2018) (p. 210).
Une autre controverse de nomenclature non sensée concerne dans le langage courant les » souches » de Cannabis, une appellation qui convient aux bactéries et aux virus, mais pas aux plantes (Bailey et Bailey, 1976 ; Usher, 1996 ; Brickell et al., 2009), surtout avec le Cannabis où la variété chimique, abrégée » chemovar » est l’appellation la plus appropriée (Lewis et al, 2018).
Le génome du Cannabis et la production biochimique de l’hôte alternatif
2011 a été une année charnière pour la génomique du Cannabis, car Medical Genomics et Nimbus Informatics ont publié un rapport en ligne sur la séquence génomique complète de 400 millions de paires de bases, qui a été rejoint peu après par une ébauche de génome et de transcriptome (van Bakel et al., 2011).
Ce développement a suscité une publicité proéminente et une controverse quant à ce qu’il pourrait présager. Alors que, le génome humain a été analysé une vingtaine d’années plus tôt, les implications pour le Cannabis ont fait l’objet de grandes spéculations.
La nouvelle a catalysé une rafale de nouvelles recherches, mais des progrès considérables avaient déjà été réalisés dans la génétique appliquée du Cannabis. L’identification et la synthèse du Δ9-tétrahydrocannabinol (THC) ont été accomplies en Israël en 1964 (Gaoni et Mechoulam, 1964), mais ce n’est que bien plus tard que le clonage réussi de son enzyme biosynthétique, l’acide tétrahydrocannabinolique synthase (THCA synthase), a été réalisé (Sirikantaramas et al., 2004 ; Figure 1). La cristallisation de l’enzyme a suivi (Shoyama et al., 2005). L’acide cannabidiolique synthase, qui catalyse l’acide cannabidiolique (CBDA), le précurseur du cannabidiol (CBD), avait déjà été identifié et produit sous forme pure (Taura et al., 1996 ; Figure 1). Ces développements ont stimulé d’autres découvertes, notamment la découverte archéologique phytochimique de la THCA synthase dans une cachette de Cannabis vieille de 2700 ans provenant d’une tombe en Asie centrale, ainsi que deux polymorphismes mononucléotidiques (SNP) non signalés auparavant dans la séquence du gène de l’enzyme (Russo et al., 2008).
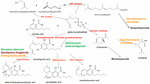
Figure 1. Voies de biosynthèse et enzymes (en rouge) de Cannabis sativa, indication de l’espèce naturelle Helichrysum umbraculigerum, et espèces alternatives (en couleur) qui ont été génétiquement modifiées pour produire des produits ultérieurs.
En 2011, les enzymes pour la production des principaux phytocannabinoïdes avaient été identifiées. De même, la sélection mendélienne avancée a donné des variétés de Cannabis riches en composants uniques spécifiques. Ainsi, des plantes à forte teneur en THC et en CBD ont été produites pour le développement pharmaceutique (de Meijer et al., 2003 ; de Meijer, 2004), avec une sélection analogue de lignées à forte teneur en cannabigérol (CBG) (de Meijer et Hammond, 2005) et en cannabichromène (CBC) (de Meijer et al., 2009a). La sélection s’est également étendue aux analogues propyliques des phytocannabinoïdes, la tétrahydrocannabivarine (THCV), la cannabidivarine (CBDV), la cannabigerivarine (CBGV) et la cannabichromivarine (CBCV) (de Meijer, 2004). La disponibilité de plantes avec des titres élevés de ces « cannabinoïdes mineurs » laisse présager de nouvelles applications pharmaceutiques intéressantes (Russo, 2011 ; Russo et Marcu, 2017).
L’accès au génome du Cannabis pourrait simplifier la production de plantes knock-out THC via la technologie CRISPR (clustered regularly-interspaced short palindromic repeats). Bien que cela puisse être intéressant pour la sélection de chanvre industriel, une génération précédente de culture de plantes a déjà produit des cultivars de chanvre qui répondent facilement aux restrictions internationales exigeant une teneur en THC de 0,1 % ou moins (Wirtshafter, 1997 ; McPartland et al., 2000 ; Small et Marcus, 2003). En fait, du Cannabis sans cannabinoïdes, sans synthase d’acide cannabigérolique fonctionnelle (Figure 1), a également été produit de manière conventionnelle (de Meijer et al., 2009b). Il n’est donc pas certain que le génie génétique du cannabis soit nécessaire pour cette plante dont l’incroyable plasticité présente déjà une grande diversité biochimique. L’introduction d’un organisme génétiquement modifié (OGM) dans le Cannabis susciterait une controverse considérable parmi certains segments de la population, et provoquerait probablement une avalanche de démêlés juridiques concernant les brevets et les droits de reproduction.
On peut facilement imaginer une variété de scénarios de science-fiction supplémentaires. Dans les années 1990, un canular sur Internet a répandu la rumeur qu’un professeur Nanofsky apocryphe avait introduit des gènes de production de THC dans les oranges (Citrus x. sinensis (L.) Osbeck). Bien que cela puisse être technologiquement réalisable, un tel effort ne serait rien de plus qu’un acte de carnaval de laboratoire à la lumière de la prodigieuse production de cannabinoïdes du Cannabis lui-même. Une chimiovar furtive de menthe poivrée (Menthax piperita Lamiaceae) arborant des phytocannabinoïdes illicites dans les trichomes glandulaires de ses feuilles pourrait être un choix plus logique pour de telles rêveries subversives souterraines et envoyer des rhizomes et des stolons le long des cours d’eau du monde entier.
Les revendications antérieures de production de cannabidiol à partir du houblon (Humulus lupulus L. Cannabaceae) et du lin (Linum usitatissimum L. Linaceae) ne sont pas étayées, mais l’acide cannabigérolique et le cannabigérol ont été détectés dans l’Helichrysum umbraculigerum Less. d’Afrique du Sud. Asteraceae (Bohlmann et Hoffmann, 1979 ; Appendino et al., 2015 ; Russo, 2016 ; Figure 1), mais sans référence à sa concentration. Cette affirmation a été confirmée récemment avec des traces observées dans des échantillons séchés de parties aériennes (Mark Lewis, communication personnelle).
Parce que la complexité de la synthèse biochimique purement de novo des cannabinoïdes a été jugée non rentable (Carvalho et al., 2017), des hôtes microbiens alternatifs ont été suggérés (Zirpel et al., 2017). En 2004, le clonage de l’ADNc de la THCA synthase a été réalisé, permettant la conversion de l’acide cannabigérolique (CBGA) en THC (Sirikantaramas et al., 2004), et une production de 8% de THCA dans les racines ciliées du tabac (Nicotiana tabacum cv.Xanthi Solanaceae) a été démontrée lors de l’alimentation en CBGA (Figure 1). L’enzyme a également été exprimée dans l’insecte Spodoptera frugiperda (J.E. Smith) Noctuidae (chenille légionnaire d’automne) via un baculovirus recombinant. Par la suite, ce groupe de recherche s’est tourné vers les levures, Pichia pastoris (maintenant Komagataella phaffii Phaff Saccharomycetaceae) (Taura et al., 2007 ; Figure 1), et a obtenu une conversion de CBGA en THCA de 98% sur 24 h, avec un rendement de 32,6 mg/L de milieu. Une forme recombinante de THCA synthase s’est avérée 4,5 fois plus efficace que chez Cannabis et 12 fois plus efficace que chez S. frugiperda. Ce processus a ensuite été optimisé avec une amélioration de l’activité de 64,5 fois (Zirpel et al., 2018), avec une production rapportée chez K. phaffii de 3,05 g/L de THCA après 8 h d’incubation à 37°C. Un simple calcul fournit que ce rendement pourrait également être atteint à partir de l’extraction de seulement 15 g de 20 % de THCA d’herbe de Cannabis.
La production de terpénoïdes de cannabis est pareillement possible dans des hôtes alternatifs. Les mutants Saccharomyces cerevisiae Meyen ex E.C. Hansen Saccharomycetaceae déficients en enzyme farnesyl diphosphate synthase accumulent à la place du geranyl pyrophosphate, qui est shunté dans la production de terpénoïde médicalement utile, le linalol (Oswald et al., 2007 ; Figure 1). De même, d’autres chercheurs ont exploité les capacités biosynthétiques des mitochondries de S. cerevisiae pour augmenter la production de sesquiterpénoïdes par le farnésyl diphosphate (Farhi et al., 2011), mais pas ceux qui sont communs au Cannabis.
À l’heure actuelle, les séquences génomiques existantes du Cannabis ne sont pas entièrement annotées. Par conséquent, des connaissances préalables appliquées et un travail de détective seront nécessaires pour acquérir des données pratiques sur la fonction génétique du Cannabis. Le plus grand potentiel de ces recherches réside dans le domaine de l’épigénétique, qui sous-tend les changements héréditaires dans l’expression des gènes ou le phénotype de la plante. La lacune la plus importante est le manque de connaissances sur la régulation de la production de cannabinoïdes. La compréhension des voies de biosynthèse et de la régulation des synthases terpéniques produisant les terpénoïdes du cannabis a à peine été initiée (Booth et al., 2017) et reste des cibles mûres pour des recherches supplémentaires (Russo, 2011).
Un problème supplémentaire dans l’élevage du cannabis reste le manque de spécimens de référence (qui sont interdits par la US Drug Enforcement Administration sans licence de l’annexe I) et les dépôts formels d’accessions chimiovar dans les dépôts de graines et de tissus. Ce dernier point a été réalisé par GW Pharmaceuticals, et indépendamment par NaPro Research (Lewis et al., 2018) dans la National Collection of Industrial, Food and Marine Bacteria (NCIMB) en Écosse. De nombreuses entreprises privées ont évité de partager le germoplasme en raison de restrictions légales et de la crainte de perdre leur propriété intellectuelle.
Synergie du cannabis
En 1998, les professeurs Raphael Mechoulam et Shimon Ben-Shabat ont postulé que le système endocannabinoïde démontrait un « effet d’entourage » dans lequel une variété de métabolites « inactifs » et de molécules étroitement liées augmentaient de façon marquée l’activité des cannabinoïdes endogènes primaires, l’anandamide et le 2-arachidonoylglycérol (Ben-Shabat et al, 1998). Ils ont également postulé que cela permettait d’expliquer pourquoi les médicaments botaniques étaient souvent plus efficaces que leurs composants isolés (Mechoulam et Ben-Shabat, 1999). Bien que la synthèse de molécules uniques reste le modèle dominant pour le développement pharmaceutique (Bonn-Miller et al, 2018), le concept de synergie botanique a été amplement démontré en même temps, invoquant les contributions pharmacologiques des « cannabinoïdes mineurs » et des terpénoïdes du cannabis à l’effet pharmacologique global de la plante (McPartland et Pruitt, 1999 ; McPartland et Mediavilla, 2001 ; McPartland et Russo, 2001, 2014 ; Russo et McPartland, 2003 ; Wilkinson et al., 2003 ; Russo, 2011). Plusieurs exemples pertinents de l’effet d’entourage dans le Cannabis sont illustratifs :
Dans un essai contrôlé randomisé d’extraits oromucosaux à base de cannabis chez des patients souffrant de douleurs rebelles malgré un traitement opioïde optimisé, un extrait à prédominance de THC n’a pas réussi à se démarquer favorablement du placebo, tandis qu’un extrait de plante entière (nabiximols, vide infra) contenant à la fois du THC et du cannabidiol (CBD) s’est avéré statistiquement significativement meilleur que les deux (Johnson et al, 2010), la seule différence saillante étant la présence de CBD dans ce dernier.
Dans les études animales sur l’analgésie, le CBD pur produit une courbe dose-réponse biphasique telle que des doses plus faibles réduisent les réponses à la douleur jusqu’à ce qu’un pic soit atteint, après quoi d’autres augmentations de dose sont inefficaces. Fait intéressant, l’application d’un extrait de Cannabis à spectre complet avec des doses équivalentes de CBD élimine la réponse biphasique au profit d’une courbe dose-réponse linéaire telle que l’extrait botanique est analgésique à n’importe quelle dose, sans effet plafond observé (Gallily et al, 2014).
Une étude récente de plusieurs lignées cellulaires humaines de cancer du sein en culture et de tumeurs implantées a démontré la supériorité d’un traitement à base d’extrait de Cannabis par rapport au THC pur, apparemment attribuable dans le premier cas à la présence de faibles concentrations de cannabigérol (CBG) et d’acide tétrahydrocannabinolique (THCA) (Blasco-Benito et al, 2018).
Les effets anticonvulsivants du cannabidiol ont été notés chez l’animal dans les années 1970 avec les premiers essais chez l’homme en 1980 (Cunha et al., 1980). Une expérience récente sur des souris présentant des crises induites par le pentylène-tétrazole a employé cinq extraits de cannabis différents avec des concentrations égales de CBD (Berman et al., 2018). Bien que tous les extraits aient montré des avantages par rapport aux contrôles non traités, des différences saillantes ont été observées dans les profils biochimiques des cannabinoïdes non-CBD, qui, à leur tour, ont conduit à des différences significatives dans le nombre de souris développant des crises tonico-cloniques (21,5-66,7 %) et les taux de survie (85-100 %), soulignant la pertinence de ces composants » mineurs « . Cette étude met en évidence la nécessité de la normalisation dans le développement pharmaceutique, et bien qu’elle puisse être interprétée comme soutenant le modèle thérapeutique à molécule unique (Bonn-Miller et al., 2018), elle nécessite de souligner que les plantes botaniques complexes peuvent répondre aux normes de la FDA américaine (Food and Drug Administration, 2015). Plus précisément, deux médicaments à base de Cannabis ont atteint l’approbation réglementaire, le Sativex®(nabiximols, nom adopté par les États-Unis) dans 30 pays, et l’Epidiolex® aux États-Unis.
La question se pose alors : Une préparation de cannabis ou une molécule unique peut-elle être trop pure, réduisant ainsi le potentiel synergique ? Des données récentes indiquent qu’il s’agit d’une possibilité distincte. Des informations anecdotiques provenant de cliniciens utilisant des extraits de cannabis à forte teneur en CBD pour traiter des épilepsies sévères, comme les syndromes de Dravet et de Lennox-Gastaut, ont montré que leurs patients présentaient une amélioration notable de la fréquence des crises (Goldstein, 2016 ; Russo, 2017 ; Sulak et al., 2017) avec des doses bien inférieures à celles rapportées dans les essais cliniques formels d’Epidiolex, une préparation à 97 % de CBD pur dont le THC a été retiré (Devinsky et al., 2016, 2017, 2018 ; Thiele et al., 2018). Cette observation a récemment fait l’objet d’une méta-analyse portant sur 11 études regroupant 670 patients (Pamplona et al., 2018). Ces résultats ont montré que 71% des patients se sont améliorés avec des extraits de cannabis à prédominance de CBD contre 36% sous CBD purifié (p < 0,0001). Le taux de réponse à 50% d’amélioration de la fréquence des crises n’était pas statistiquement différent dans les deux groupes et les deux groupes ont atteint un statut sans crise chez environ 10% des patients. Cependant, les doses quotidiennes moyennes étaient très différentes dans les deux groupes : 27,1 mg/kg/j pour le CBD purifié contre seulement 6,1 mg/kg/j pour les extraits de cannabis riches en CBD, soit une dose représentant seulement 22,5 % de celle du CBD seul. En outre, l’incidence des effets indésirables légers et graves était manifestement plus élevée chez les patients traités par la CBD purifiée que chez ceux traités par les extraits riches en CBD (p < 0,0001), un résultat que les auteurs ont attribué à la dose plus faible utilisée, obtenue selon eux grâce aux contributions synergiques d’autres composés de l’entourage. De telles observations soutiennent l’hypothèse d’une plus grande efficacité des extraits de Cannabis combinant plusieurs composants anticonvulsivants, tels que le CBD, le THC, le THCA, le THCV, le CBDV, le linalol et même le caryophyllène (Lewis et al, 2018).
Ces études et d’autres fournissent une base solide pour la synergie du cannabis, et un soutien au développement de médicaments botaniques par rapport à celui de composants uniques (Bonn-Miller et al., 2018), ou à la production via des méthodes de fermentation dans la levure ou d’autres micro-organismes. Un exemple de la puissance de la sélection conventionnelle est illustré (Figure 2), sous la forme d’un chimovar de Cannabis nommé CaryodiolTM pour sa teneur accrue en caryophyllène (0,83%) en tant qu’agoniste CB2, ainsi qu’un rapport THC:CBD de type III très favorable de 1:39,4. Une telle préparation semble pouvoir être appliquée au traitement de nombreuses affections cliniques, notamment la douleur, l’inflammation, les troubles fibrotiques, la dépendance, l’anxiété, la dépression, les maladies auto-immunes, les affections dermatologiques et le cancer (Pacher et Mechoulam, 2011 ; Russo, 2011 ; Xi et al., 2011 ; Russo et Marcu, 2017 ; Lewis et al., 2018). La production d’une telle combinaison à partir de sources microbiennes pourrait nécessiter des combinaisons de cannabinoïdes provenant de plusieurs espèces de levure et, par conséquent, elle représenterait un produit combiné soumis à un parcours réglementaire difficile par rapport aux préparations de Cannabis provenant d’extraits d’une seule espèce (par exemple, les nabiximols) qui ont été acceptées comme une formulation unitaire dans 30 pays à travers le monde (Food and Drug Administration, 2015).
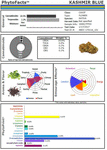
Figure 2. Représentation PhytoFactsTM de la teneur en cannabinoïdes et terpénoïdes de CaryodiolTM, alias » Kashmir Blue « , un chémovar de type III, prédominant en cannabidiol et en caryophyllène. Voir (Lewis et al., 2018) pour plus de détails sur PhytoFacts et la méthodologie de sélection conventionnelle. Copyright© 2016 BHC Group, LLC. Tous droits réservés. Toute utilisation non autorisée de ce document ou des images ou marques ci-dessus peut violer les droits d’auteur, les marques commerciales et d’autres lois applicables.
Cet article a brièvement décrit les tentatives récemment technologiques de « réinventer la roue des phytocannabinoïdes. » Des arguments convaincants soutiendraient que cela peut être fait, mais faut-il le faire ? Les données soutenant l’existence de la synergie du Cannabis et la plasticité stupéfiante du génome du Cannabis suggèrent une réalité qui évite le besoin d’hôtes alternatifs, ou même le génie génétique du Cannabis sativa, prouvant ainsi que, « La plante le fait mieux. »
Contributions de l’auteur
L’auteur confirme être le seul contributeur de ce travail et l’a approuvé pour publication.
Déclaration de conflit d’intérêts
Je suis directeur de la recherche de l’Institut international du cannabis et des cannabinoïdes. Nous servons des clients engagés dans le commerce du cannabis.
Reconnaissance
L’auteur a apprécié l’aide du personnel du bureau de prêt interbibliothèque de l’Université du Montana de la bibliothèque Mansfield pour la fourniture de matériel de recherche.
Anderson, L. C. (1980). Variation des feuilles parmi les espèces de Cannabis d’un jardin contrôlé. Bot. Mus. Lealf. Harv. Univ. 28, 61-69.
Google Scholar
Appendino, G., Taglialatela-Scafati, O., Minassi, A., Pollastro, F., Ballero, L. M., Maxia, A., et al. (2015). Helichrysum italicum : le géant endormi de la phytothérapie méditerranéenne. Herbalgram 105, 34-45.
Google Scholar
Bailey, L. H., et Bailey, E. Z. (1976). Hortus Third : un dictionnaire concis des plantes cultivées aux États-Unis et au Canada. New York, NY : Macmillan.
Google Scholar
Ben-Shabat, S., Fride, E., Sheskin, T., Tamiri, T., Rhee, M. H., Vogel, Z., et al. (1998). An entourage effect : inactive endogenous fatty acid glycerol esters enhance 2-arachidonoyl-glycerol cannabinoid activity. Eur. J. Pharmacol. 353, 23-31. doi : 10.1016/S0014-2999(98)00392-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Berman, P., Futoran, K., Lewitus, G. M., Mukha, D., Benami, M., Shlomi, T., et al. (2018). Une nouvelle approche ESI-LC/MS pour le profilage métabolique complet des phytocannabinoïdes dans le Cannabis. Sci. Rep. 8:14280. doi : 10.1038/s41598-018-32651-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Blasco-Benito, S., Seijo-Vila, M., Caro-Villalobos, M., Tundidor, I., Andradas, C., Garcia-Taboada, E., et al. (2018). Appréciation de l' »effet entourage » : action antitumorale d’un cannabinoïde pur par rapport à une préparation médicamenteuse botanique dans des modèles précliniques de cancer du sein. Biochem. Pharmacol. 157, 285-293. doi : 10.1016/j.bcp.2018.06.025
PubMed Abstract | CrossRef Full Text | Google Scholar
Bohlmann, F., et Hoffmann, E. (1979). Cannabigerol-ahnliche verbindungen aus Helichrysum umbraculigerum. Phytochemistry 18, 1371-1374. doi : 10.1016/0031-9422(79)83025-3
CrossRef Full Text | Google Scholar
Bonn-Miller, M. O., ElSohly, M. A., Loflin, M. J. E., Chandra, S., et Vandrey, R. (2018). Développement de médicaments à base de cannabis et de cannabinoïdes : évaluation des approches botaniques versus molécule unique. Int. Rev. Psychiatry 30, 277-284. doi : 10.1080/09540261.2018.1474730
PubMed Abstract | CrossRef Full Text | Google Scholar
Booth, J. K., Page, J. E., et Bohlmann, J. (2017). Les terpènes synthases de Cannabis sativa. PLoS One 12:e0173911. doi : 10.1371/journal.pone.0173911
PubMed Abstract | CrossRef Full Text | Google Scholar
Brickell, C. D., Alexander, C., David, J. C., Hetterscheid, W. L. A., Leslie, A. C., Malecot, V., et al. (2009). Code International de Nomenclature des Plantes Cultivées. Leuven : Société internationale de la science horticole.
Google Scholar
Carvalho, A., Hansen, E. H., Kayser, O., Carlsen, S., et Stehle, F. (2017). Conception de micro-organismes pour la biosynthèse hétérologue de cannabinoïdes. FEMS Yeast Res. 17:fox037. doi : 10.1093/femsyr/fox037
PubMed Abstract | CrossRef Full Text | Google Scholar
Clarke, R. C., et Merlin, M. D. (2013). Cannabis : Evolution et ethnobotanique. Berkeley, CA : University of California Press.
Google Scholar
Clarke, R. C., et Merlin, M. D. (2016). Domestication du cannabis, histoire de la sélection, diversité génétique actuelle et perspectives d’avenir. Crit. Rev. Plant Sci. 35, 293-327. doi : 10.1080/07352689.2016.1267498
CrossRef Full Text | Google Scholar
Cunha, J. M., Carlini, E. A., Pereira, A. E., Ramos, O. L., Pimentel, C., Gagliardi, R., et al. (1980). Administration chronique de cannabidiol à des volontaires sains et à des patients épileptiques. Pharmacology 21, 175-185. doi : 10.1159/000137430
PubMed Abstract | CrossRef Full Text | Google Scholar
Datwyler, S. L., et Weiblen, G. D. (2006). Variation génétique dans le chanvre et la marijuana (Cannabis sativa L.) selon les polymorphismes de longueur de fragment amplifié. J. Forensic Sci. 51, 371-375. doi : 10.1111/j.1556-4029.2006.00061.x
PubMed Abstract | CrossRef Full Text | Google Scholar
de Meijer, E. (2004). « La sélection de cultivars de cannabis pour les utilisations finales pharmaceutiques », dans Medicinal Uses of Cannabis and Cannabinoids, eds G. W. Guy, B. A. Whittle, et P. Robson (Londres : Pharmaceutical Press), 55-70.
Google Scholar
de Meijer, E. P., Bagatta, M., Carboni, A., Crucitti, P., Moliterni, V. M., Ranalli, P., et al. (2003). The inheritance of chemical phenotype in Cannabis sativa L. Genetics 163, 335-346.
PubMed Abstract | Google Scholar
de Meijer, E. P. M., and Hammond, K. M. (2005). L’héritage du phénotype chimique chez Cannabis sativa L. (II) : les plantes à prédominance de cannabigérol. Euphytica 145, 189-198. doi : 10.1007/s10681-005-1164-8
CrossRef Full Text | Google Scholar
de Meijer, E. P. M., Hammond, K. M., and Micheler, M. (2009a). L’héritage du phénotype chimique dans Cannabis sativa L. (III) : variation dans la proportion de cannabichromène. Euphytica 165, 293-311.
Google Scholar
de Meijer, E. P. M., Hammond, K. M., et Sutton, A. (2009b). L’héritage du phénotype chimique dans Cannabis sativa L. (IV) : plantes sans cannabinoïdes. Euphytica 168, 95-112.
Google Scholar
Devinsky, O., Cross, J. H., Laux, L., Marsh, E., Miller, I., Nabbout, R., et al. (2017). Essai du cannabidiol pour les crises résistantes aux médicaments dans le syndrome de Dravet. N. Engl. J. Med. 376, 2011-2020. doi : 10.1056/NEJMoa1611618
PubMed Abstract | CrossRef Full Text | Google Scholar
Devinsky, O., Marsh, E., Friedman, D., Thiele, E., Laux, L., Sullivan, J., et al. (2016). Cannabidiol chez les patients atteints d’épilepsie résistante au traitement : un essai interventionnel ouvert. Lancet Neurol. 15, 270-278. doi : 10.1016/S1474-4422(15)00379-8
CrossRef Full Text | Google Scholar
Devinsky, O., Patel, A. D., Thiele, E. A., Wong, M. H., Appleton, R., Harden, C. L., et al. (2018). Essai de sécurité randomisé et à dose variable du cannabidiol dans le syndrome de Dravet. Neurologie 90, e1204-e1211. doi : 10.1212/WNL.0000000000005254
PubMed Abstract | CrossRef Full Text | Google Scholar
Dufresnes, C., Jan, C., Bienert, F., Goudet, J., et Fumagalli, L. (2017). Diversité génétique à grande échelle du Cannabis pour les applications médico-légales. PLoS One 12:e0170522. doi : 10.1371/journal.pone.0170522
PubMed Abstract | CrossRef Full Text | Google Scholar
Elzinga, S., Fischedick, J., Podkolinski, R., et Raber, J. C. (2015). Cannabinoïdes et terpènes comme marqueurs chimiotaxonomiques dans le cannabis. Nat. Prod. Chem. Res. 3:181.
Google Scholar
Farhi, M., Marhevka, E., Masci, T., Marcos, E., Eyal, Y., Ovadis, M., et al. (2011). Harnessing yeast subcellular compartments for the production of plant terpenoids. Metab. Eng. 13, 474-481. doi : 10.1016/j.ymben.2011.05.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Food and Drug Administration (2015). Guide du développement des médicaments botaniques pour l’industrie, éd. U.S.D.o.H.a.H. Services (Washington, DC : Food and Drug Administration). doi : 10.1016/j.ymben.2011.05.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Fuchs, L. (1999). La grande herbe de Leonhart Fuchs : De Historia Stirpium Commentarii Insignes, 1542 (Commentaires notables sur l’histoire des plantes). Stanford, CA : Stanford University Press.
Google Scholar
Gallily, R., Yekhtin, Z., et Hanus, L. (2014). Surmonter la dose-réponse en cloche du cannabidiol en utilisant un extrait de cannabis enrichi en cannabidiol. Pharmacol. Pharm. 6, 75-85. doi : 10.4236/pp.2015.62010
CrossRef Full Text | Google Scholar
Gaoni, Y., et Mechoulam, R. (1964). Isolement, structure et synthèse partielle d’un constituant actif du haschisch. J. Am. Chem. Soc. 86, 1646-1647. doi : 10.1021/ja01062a046
CrossRef Full Text | Google Scholar
Goldstein, B. (2016). Le cannabis dans le traitement de l’épilepsie pédiatrique. Chicago, IL : O’Shaughnessy’s, 7-9.
Google Scholar
Hillig, K. W. (2005a). Une analyse combinée des traits agronomiques et des fréquences des allèles allozymes pour 69 accessions de Cannabis. J. Ind. Hemp 10, 17-30. doi : 10.1300/J237v10n01_03
CrossRef Full Text | Google Scholar
Hillig, K. W. (2005b). Preuve génétique pour la spéciation dans le Cannabis (Cannabaceae). Genet. Resour. Crop Evol. 52, 161-180. doi : 10.1007/s10722-003-4452-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Hillig, K. W., et Mahlberg, P. G. (2004). Une analyse chimiotaxonomique de la variation des cannabinoïdes dans le Cannabis (Cannabaceae). Am. J. Bot. 91, 966-975. doi : 10.3732/ajb.91.6.966
PubMed Abstract | CrossRef Full Text | Google Scholar
Johnson, J. R., Burnell-Nugent, M., Lossignol, D., Ganae-Motan, E. D., Potts, R., et Fallon, M. T. (2010). Multicenter, double-blind, randomized, placebo-controlled, parallel-group study of the efficacy, safety, and tolerability of THC:CBD extract and THC extract in patients with intractable cancer-related pain. J. Pain Symptom Manage. 39, 167-179. doi : 10.1016/j.jpainsymman.2009.06.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Lamarck, J. B. (1783). Encyclopédie Méthodique Botanique. Paris : Chez Panckoucke.
Lewis, M. A., Russo, E. B., et Smith, K. M. (2018). Les fondements pharmacologiques des chémovars du cannabis. Planta Med. 84, 225-233. doi : 10.1055/s-0043-122240
PubMed Abstract | CrossRef Full Text | Google Scholar
Linnaeus, C. (1753). Species Plantarum. Holmiae : Laurentii Salvii.
Google Scholar
McPartland, J., Guy, G. W., et Hegman, W. (2018). Le cannabis est indigène en Europe et la culture a commencé pendant l’âge du cuivre ou du bronze : une synthèse probabiliste des études de pollen fossile. Veg. His. Archaeobot. 27, 635-648. doi : 10.1007/s00334-018-0678-7
CrossRef Full Text | Google Scholar
McPartland, J. M. (2018). La systématique du cannabis aux niveaux de la famille, du genre et de l’espèce. Cannabis Cannabinoid Res. 3, 203-212. doi : 10.1089/can.2018.0039
PubMed Abstract | CrossRef Full Text | Google Scholar
McPartland, J. M., Clarke, R. C., et Watson, D. P. (2000). Maladies et ravageurs du chanvre : Management and Biological Control. Wallingford : CABI. doi : 10.1079/9780851994543.0000
CrossRef Full Text | Google Scholar
McPartland, J. M., et Guy, G. W. (2017). Modèles de taxonomie du cannabis, biais culturels et conflits entre les noms scientifiques et vernaculaires. Bot. Rev. 83, 327-381. doi : 10.1007/s12229-017-9187-0
CrossRef Full Text | Google Scholar
McPartland, J. M., and Mediavilla, V. (2001). « Non-cannabinoids in cannabis », in Cannabis and Cannabinoids, eds F. Grotenhermen and E. B. Russo (Binghamton, NY : Haworth Press), 401-409.
Google Scholar
McPartland, J. M., and Pruitt, P. L. (1999). Effets secondaires des produits pharmaceutiques qui ne sont pas provoqués par des plantes médicinales comparables : le cas du tétrahydrocannabinol et de la marijuana. Altern. Ther. Health Med. 5, 57-62.
Google Scholar
McPartland, J. M., et Russo, E. B. (2001). Cannabis et extraits de cannabis : plus grands que la somme de leurs parties ? J. Cannabis Ther. 1, 103-132. doi : 10.1300/J175v01n03_08
CrossRef Full Text | Google Scholar
McPartland, J. M., et Russo, E. B. (2014). « Les constituants non-phytocannabinoïdes du cannabis et la synergie des plantes », dans Handbook of Cannabis, ed. R. G. Pertwee (Oxford : Oxford University Press), 280-295.
Google Scholar
Mechoulam, R., et Ben-Shabat, S. (1999). Du gan-zi-gun-nu à l’anandamide et au 2-arachidonoylglycérol : l’histoire continue du cannabis. Nat. Prod. Rep. 16, 131-143. doi : 10.1039/a703973e
PubMed Abstract | CrossRef Full Text | Google Scholar
Oswald, M., Fischer, M., Dirninger, N., et Karst, F. (2007). Biosynthèse des monoterpénoïdes dans Saccharomyces cerevisiae. FEMS Yeast Res. 7, 413-421. doi : 10.1111/j.1567-1364.2006.00172.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Pacher, P., et Mechoulam, R. (2011). La signalisation des lipides par les récepteurs cannabinoïdes 2 fait-elle partie d’un système de protection ? Prog. Lipid Res. 50, 193-211. doi : 10.1016/j.plipres.2011.01.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Pamplona, F. A., da Silva, L. R., et Coan, A. C. (2018). Avantages cliniques potentiels des extraits de cannabis riches en CBD par rapport au CBD purifié dans l’épilepsie résistante au traitement : méta-analyse de données observationnelles. Front. Neurol. 9:759. doi : 10.3389/fneur.2018.00759
PubMed Abstract | CrossRef Full Text | Google Scholar
Piomelli, D., et Russo, E. B. (2016). Le débat Cannabis sativa contre Cannabis indica : une interview avec Ethan Russo, MD. Cannabis Cannabinoid Res. 1, 44-46. doi : 10.1089/can.2015.29003.ebr
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B. (2007). Histoire du cannabis et de ses préparations en saga, science et sobriquet. Chem. Biodivers. 4, 1614-1648. doi : 10.1002/cbdv.200790144
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B. (2011). Apprivoiser le THC : synergie potentielle du cannabis et effets de l’entourage des phytocannabinoïdes-terpénoïdes. Br. J. Pharmacol. 163, 1344-1364. doi : 10.1111/j.1476-5381.2011.01238.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B. (2016). Au-delà du cannabis : les plantes et le système endocannabinoïde. Trends Pharmacol. Sci. 37, 594-605. doi : 10.1016/j.tips.2016.04.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B. (2017). Cannabis et épilepsie : un traitement ancien revient sur le devant de la scène. Epilepsy Behav. 70(Pt B), 292-297. doi : 10.1016/j.yebeh.2016.09.040
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B., Jiang, H. E., Li, X., Sutton, A., Carboni, A., del Bianco, F., et al. (2008). Phytochemical and genetic analyses of ancient cannabis from Central Asia. J. Exp. Bot. 59, 4171-4182. doi : 10.1093/jxb/ern260
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B., et Marcu, J. (2017). Pharmacologie du cannabis : les suspects habituels et quelques pistes prometteuses. Adv. Pharmacol. 80, 67-134. doi : 10.1016/bs.apha.2017.03.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Russo, E. B., et McPartland, J. M. (2003). Le cannabis est plus que le simple Delta(9)-tétrahydrocannabinol. Psychopharmacologie 165, 431-432. doi : 10.1007/s00213-002-1348-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Sawler, J., Stout, J. M., Gardner, K. M., Hudson, D., Vidmar, J., Butler, L., et al. (2015). La structure génétique de la marijuana et du chanvre. PLoS One 10:e0133292. doi : 10.1371/journal.pone.0133292
PubMed Abstract | CrossRef Full Text | Google Scholar
Schultes, R., Klein, W., Plowman, T., et Lockwood, T. (1974). Cannabis : un exemple de négligence taxonomique. Bot. Mus. Lealf. Harv. Univ. 23, 337-367.
Google Scholar
Shoyama, Y., Takeuchi, A., Taura, F., Tamada, T., Adachi, M., Kuroki, R., et al. (2005). Crystallization of Delta1-tetrahydrocannabinolic acid (THCA) synthase from Cannabis sativa. Acta Crystallogr. Sect. F Struct. Biol. Cryst. Commun. 61(Pt 8), 799-801. doi : 10.1107/S1744309105023365
PubMed Abstract | CrossRef Full Text | Google Scholar
Sirikantaramas, S., Morimoto, S., Shoyama, Y., Ishikawa, Y., Wada, Y., Shoyama, Y., et al. (2004). The gene controlling marijuana psychoactivity : molecular cloning and heterologous expression of Delta1-tetrahydrocannabinolic acid synthase from Cannabis sativa L. J. Biol. Chem. 279, 39767-39774. doi : 10.1074/jbc.M403693200
PubMed Abstract | CrossRef Full Text | Google Scholar
Small, E. (2015). Évolution et classification de Cannabis sativa (marijuana, chanvre) en relation avec l’utilisation humaine. Bot. Rev. 81, 189-294. doi : 10.1007/s12229-015-9157-3
CrossRef Full Text | Google Scholar
Small, E. (2017). Cannabis : Un guide complet. Boca Raton, FL : CRC Press.
Google Scholar
Small, E., et Cronquist, A. (1976). Une taxonomie pratique et naturelle pour le Cannabis. Taxon 25, 405-435. doi : 10.2307/1220524
CrossRef Full Text | Google Scholar
Small, E., et Marcus, D. (2003). Niveaux de tétrahydrocannabinol dans les ressources du germoplasme du chanvre (Cannabis sativa). Econ. Bot. 57, 545-558. doi : 10.1663/0013-0001(2003)0572.0.CO;2
CrossRef Full Text | Google Scholar
Song, B.-H., Wang, X.-Q., Li, F.-Z., and Hong, D.-Y.. (2001). Furnter evidence for the paraphyly of the Celtidaceae from the chloroplast gene mat K. Plant Syst. Evol. 228, 107-115. doi : 10.1007/s006060170041
CrossRef Full Text | Google Scholar
Sulak, D., Saneto, R., et Goldstein, B. (2017). Le statut actuel du cannabis artisanal pour le traitement de l’épilepsie aux États-Unis. Epilepsy Behav. 70(Pt B), 328-333. doi : 10.1016/j.yebeh.2016.12.032
PubMed Abstract | CrossRef Full Text | Google Scholar
Taura, F., Dono, E., Sirikantaramas, S., Yoshimura, K., Shoyama, Y., et Morimoto, S. (2007). Production d’acide Delta(1)-tétrahydrocannabinolique par l’enzyme biosynthétique sécrétée par Pichia pastoris transgénique. Biochem. Biophys. Res. Commun. 361, 675-680. doi : 10.1016/j.bbrc.2007.07.079
PubMed Abstract | CrossRef Full Text | Google Scholar
Taura, F., Morimoto, S., et Shoyama, Y. (1996). Purification et caractérisation de l’acide cannabidiolique synthase de Cannabis sativa L. Analyse biochimique d’une nouvelle enzyme qui catalyse l’oxydocyclisation de l’acide cannabigérolique en acide cannabidiolique. J. Biol. Chem. 271, 17411-17416. doi : 10.1074/jbc.271.29.17411
PubMed Abstract | CrossRef Full Text | Google Scholar
Thiele, E. A., Marsh, E. D., French, J. A., Mazurkiewicz-Beldzinska, M., Benbadis, S. R., Joshi, C., et al. (2018). Cannabidiol chez les patients présentant des crises associées au syndrome de Lennox-Gastaut (GWPCARE4) : un essai de phase 3 randomisé, en double aveugle, contrôlé par placebo. Lancet 391, 1085-1096. doi : 10.1016/S0140-6736(18)30136-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Usher, G. (1996). The Wordsmith Dictionary of Botany. Ware : Wordsworth Reference.
van Bakel, H., Stout, J. M., Cote, A. G., Tallon, C. M., Sharpe, A. G., Hughes, T. R., et al. (2011). Le projet de génome et de transcriptome de Cannabis sativa. Genome Biol. 12:R102. doi : 10.1186/gb-2011-12-10-r102
PubMed Abstract | CrossRef Full Text | Google Scholar
Weigreffe, S. J., Sytsma, K. J., et Guries, R. P. (1998). Les Ulmaceae, une famille ou deux ? Evidence from chloroplast DNA restriction site mapping. Plant Syst. Evol. 210, 249-270. doi : 10.1007/BF00985671
CrossRef Full Text | Google Scholar
Wilkinson, J. D., Whalley, B. J., Baker, D., Pryce, G., Constanti, A., Gibbons, S., et al. (2003). Medicinal cannabis : is delta9-tetrahydrocannabinol necessary for all its effects ? J. Pharm. Pharmacol. 55, 1687-1694. doi : 10.1211/0022357022304
PubMed Abstract | CrossRef Full Text | Google Scholar
Wirtshafter, D. (1997). « Valeur nutritionnelle de la graine de chanvre et de l’huile de graine de chanvre », dans Cannabis in Medical Practice, ed. M. L. Mathre (Jefferson, NC : McFarland and Company), 181-191.
Google Scholar
Xi, Z. X., Peng, X. Q., Li, X., Song, R., Zhang, H. Y., Liu, Q. R., et al. (2011). Les récepteurs cannabinoïdes CB(2) du cerveau modulent les actions de la cocaïne chez les souris. Nat. Neurosci. 14, 1160-1166. doi : 10.1038/nn.2874
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, M.-Q., van Velzen, R., Bakker, F. T., Sattarian, A., Li, D.-Z. et Yi, T.-S. (2013). Phylogénétique moléculaire et évolution des caractères des Cannabaceae. Taxon 62, 473-485. doi : 10.12705/623.9
CrossRef Full Text | Google Scholar
Zirpel, B., Degenhardt, F., Martin, C., Kayser, O., et Stehle, F. (2017). Levures d’ingénierie comme organismes de plate-forme pour la biosynthèse des cannabinoïdes. J. Biotechnol. 259, 204-212. doi : 10.1016/j.jbiotec.2017.07.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Zirpel, B., Degenhardt, F., Zammarelli, C., Wibberg, D., Kalinowski, J., Stehle, F., et al. (2018). Optimisation de la production de l’acide Delta(9)-tétrahydrocannabinolique synthase dans Komagataella phaffii via l’identification du goulot d’étranglement post-traductionnel. J. Biotechnol. 272-273, 40-47. doi : 10.1016/j.jbiotec.2018.03.008
PubMed Abstract | CrossRef Full Text
.