- Introduction
- Matériels et méthodes
- Induction de l’HIC
- Western Blotting
- Immunohistochimie
- Enzyme Linked Immunosorbent Assay
- Nockage génétique de la Galectine-3
- Analyse statistique
- Résultats
- Patron d’expression temporelle de la Galectine-1 et de la Galectine-3 après une HIC
- Localisation cellulaire de la Galectine-1 et de la Galectine-3 après l’HIC
- Régulation de la réponse inflammatoire médiée par la Galectine-1 et la Galectine-3
- Discussion
- Conclusion
- Déclaration d’éthique
- Contributions des auteurs
- Funding
- Déclaration de conflit d’intérêts
- Matériel supplémentaire
- Abréviations
Introduction
L’hémorragie intracérébrale est un sous-type d’accident vasculaire cérébral fatal (Qureshi et al, 2001a) qui représente un taux de mortalité hospitalière et un taux d’invalidité de 40 et 80 %, respectivement (van Asch et al., 2010). L’HIC est responsable de 10 à 15 % de tous les accidents vasculaires cérébraux et son incidence mondiale est de 2 millions de cas par an (van Asch et al., 2010), dont environ 120 000 cas par an aux États-Unis (Ribo et Grotta, 2006 ; Broderick et al., 2007 ; Aguilar et Freeman, 2010). Cependant, l’incidence devrait avoir doublé d’ici 2050 (Qureshi et al., 2001b) en raison du vieillissement et de la généralisation de l’utilisation des anticoagulants (Wang, 2010). Notamment, il n’existe pas de traitement efficace pour l’HIC et la physiopathologie de la maladie est mal définie.
La neuroinflammation caractérisée par l’activation de la microglie, les cellules neuro-immunes du SNC, est un contributeur clé des lésions cérébrales secondaires induites par l’HIC et de la perte de la fonction neurologique (Wang et Dore, 2007 ; Carmichael et al., 2008 ; Wang, 2010). L’introduction de composants sanguins, dont la thrombine, l’Hb et les métabolites de l’Hb tels que l’hémine, dans le cerveau crée la base des réponses neuroinflammatoires après une HIC (Wang et Dore, 2007 ; Carmichael et al., 2008 ; Robinson et al., 2009 ; Wang, 2010 ; Cai et al., 2011 ; Dang et al., 2011 ; Babu et al., 2012 ; Lin et al., 2012 ; Weng et al., 2015 ; Min et al., 2017). Notamment, l’activation pro-inflammatoire de la microglie après une HIC est corrélée à la détérioration de la barrière hémato-encéphalique, au gonflement/œdème cérébral, à l’expansion de l’hématome, à la détérioration neurologique et à la faible récupération fonctionnelle (Platt et al., 1998 ; Hickenbottom et al., 1999 ; Leira et al., 2004 ; Zhao et al., 2007). En outre, la réponse inflammatoire après une HIC régule également le recrutement cérébral des monocytes/macrophages dérivés du sang qui sont connus pour réguler les lésions cérébrales induites par l’HIC et ainsi la récupération fonctionnelle (Tessier et al., 1997 ; Shiratori et al., 2010 ; Starossom et al., 2012).
Les galectines sont une famille de protéines de liaison aux hydrates de carbone conservées au cours de l’évolution (Barondes et al, 1994a,b ; Kasai et Hirabayashi, 1996) impliquées dans l’activation, la différenciation, la prolifération, la migration et l’apoptose des cellules (Perillo et al., 1995 ; Yang et al., 1996 ; Perillo et al., 1998 ; Moiseeva et al., 1999 ; Vespa et al., 1999 ; Yamaoka et al., 2000 ; Goldring et al., 2002). Parmi les différents membres de la famille des galectines, des preuves émergentes impliquent les rôles clés de la Galectine-1 et de la Galectine-3 dans les réponses neuro-immunes dans plusieurs conditions neuropathologiques (Jeon et al., 2010 ; Starossom et al., 2012 ; Parikh et al., 2015). Cependant, il existe une lacune critique dans la compréhension de leur expression cellulaire et de leur fonction après une HIC. L’objectif du présent manuscrit est d’élucider la modulation induite par la blessure hémorragique et l’expression cellulaire de la Galectine-1 et de la Galectine-3 dans le cerveau dans un modèle préclinique d’HIC.
Matériels et méthodes
Induction de l’HIC
Une hémorragie intracérébrale a été induite chez des souris CD-1 mâles adultes (8-12 semaines ; n = 43), comme rapporté précédemment (Sukumari-Ramesh et al, 2012a,b, 2016 ; Bonsack et al., 2016 ; Sukumari-Ramesh et Alleyne, 2016 ; Ahmad et al., 2017 ; Chen-Roetling et al., 2017). En bref, la souris a été anesthésiée (kétamine et xylazine) et une petite incision a été pratiquée pour exposer le crâne. À l’aide d’une perceuse à grande vitesse, un trou de bavure (0,5 mm) a été réalisé sur le crâne à environ 2,2 mm latéralement au bregma. Puis la souris a été placée sur un cadre de tête stéréotaxique et une seringue de Hamilton 26-G a été utilisée pour injecter 0,04U de collagénase bactérienne de type IV (Sigma, St. Louis, MO, États-Unis) dans 0,5 μL de solution saline tampon phosphate (pH 7,4 ; PBS) dans le striatum gauche (3,0 mm) sous guidage stéréotaxique. Après avoir retiré l’aiguille, de la cire osseuse a été utilisée pour sceller le trou de bavure. Les souris ont été maintenues à 37 ± 0,5°C à l’aide d’un régulateur de température pour petits animaux tout au long de la procédure. Le schéma temporel de l’hématome après l’HIC est fourni (figure supplémentaire S1).
Western Blotting
Les souris ont été anesthésiées et perfusées transcardialement avec du PBS. Le tissu cérébral ipsilatéral (régions cérébrales hématomes et péri-hématomes) a été recueilli dans un tampon RIPA contenant des inhibiteurs de protéase et de phosphatase et soumis à une sonication. Les échantillons ont ensuite été centrifugés à 14 000 rpm pendant 5 minutes à 4°C pour recueillir le surnageant. À l’aide d’un kit de dosage des protéines BCA (Pierce, Rockford, IL, États-Unis), les concentrations de protéines ont été estimées et 30 à 50 microgrammes d’échantillons ont été passés sur un gel de dodécylsulfate de sodium-polyacrylamide à 4-20% et transférés sur une membrane de difluorure de polyvinylidène (PVDF). Les taches ont été incubées avec l’anticorps primaire respectif, pendant la nuit à 4°C. Cette incubation a été suivie d’une incubation de 2 heures avec un anticorps secondaire correspondant marqué à l’Alexa Fluor. Les blots ont été lus à l’aide d’un système d’imagerie proche infrarouge Li-Cor Odyssey et la quantification a été effectuée à l’aide du logiciel Quantity One (Bio-Rad, Foster City, CA, États-Unis).
Immunohistochimie
Les souris ont été anesthésiées et perfusées par voie transcardiaque avec du PBS. Les cerveaux ont été prélevés et placés dans du paraformaldéhyde à 4% pendant une nuit à 4°C, puis congelés instantanément. Les cerveaux ont ensuite été coupés en sections coronales de 25 mm à l’aide d’un cryostat et montés sur des lames de verre. Les sections ont été incubées pendant 2 heures dans du sérum d’âne normal à 10 % à température ambiante. Cette incubation a été suivie d’une nuit d’incubation avec l’anticorps primaire respectif à 4°C. Après lavage, les sections ont été incubées avec l’anticorps secondaire correspondant marqué au fluor Alexa pendant 1 h à température ambiante. L’immunofluorescence a été déterminée à l’aide d’un microscope confocal laser Zeiss LSM510 Meta et la co-localisation cellulaire a été déterminée, comme décrit précédemment (Laird et al., 2010). Nous avons analysé trois sections non consécutives par animal et un minimum de 3 champs aléatoires autour de l’hématome.
Enzyme Linked Immunosorbent Assay
RAW 264.7, une lignée cellulaire de macrophages murins, ont été placées sur une plaque de 24 puits et laissées à incuber pendant 48 h dans du DMEM (Dulbecco’s Modified Eagle Medium) contenant 5 % de sérum fœtal bovin, 5 % de sérum de croissance bovin et 1 % de pénicilline/Streptomycine. Les cellules ont ensuite été incubées avec de la Galectine-1 recombinante de souris (6,25 ou 12,5 μg/ml ; R&D Systems, Minneapolis, MN, États-Unis) pendant 1 h, puis elles ont été suivies d’un traitement de 18 h avec du LPS (100 ng/ml) ou de l’hémine (30 μg/ml). Le surnageant a été recueilli et utilisé pour la détection de l’IL-6, par ELISA selon les instructions du fabricant (Biolegend, San Diego, CA, États-Unis). En bref, une plaque de 96 puits a été recouverte pendant une nuit à 4°C avec un anticorps de capture spécifique. Après un blocage d’une heure, le surnageant de la culture cellulaire a été ajouté aux puits et incubé pendant 2 heures à température ambiante. Tout matériel non lié a été éliminé par lavage et une solution d’anticorps de détection a été ajoutée aux puits et laissée à incuber pendant 1 h à température ambiante. Après un nouveau lavage, 100 μl de solution d’avidine-peroxydase de radis de cheval (HRP) ont été ajoutés à chaque puits pendant 30 min à température ambiante. La solution de substrat a été ajoutée aux puits après le lavage pour le développement de la couleur. Une solution d’arrêt a été utilisée, et la plaque a été lue à 450 nm à l’aide d’un lecteur de plaques de microtitration (Bio-Tek, Epoch).
Nockage génétique de la Galectine-3
Les cellules RAW 264.7 ont été transfectées avec un siRNA de contrôle (ON-TARGET plus Pool non ciblé ; GE Dharmacon) ou un siRNA de la Galectine-3 (ON-TARGET plus Mouse Lgals3 siRNA ; GE Dharmacon) en utilisant le réactif de transfection HiPerFect (QIAGEN) selon les instructions du fabricant. Le knockdown de la galectine-3 a été vérifié 48h après la transfection par western blotting comme décrit précédemment.
Analyse statistique
Les données ont été analysées à l’aide d’un test t ou d’une analyse de variance à sens unique suivie d’un test post hoc de Student-Newman-Keuls et ont été exprimées en moyenne ± Erreur standard (SE). Une valeur p de < 0,05 a été considérée comme significative.
Résultats
Patron d’expression temporelle de la Galectine-1 et de la Galectine-3 après une HIC
Pour évaluer si une lésion hémorragique entraîne une modulation de l’expression de la Galectine-1 et de la Galectine-3 dans le cerveau, une HIC ou un Sham a été induit chez des souris en utilisant la méthode d’injection de collagénase. Compte tenu du rôle émergent de la Galectine-1 et de la Galectine-3 dans les réponses neuro-immunitaires, les sections de cerveau ipsilatéral des souris sham ou ICH ont été soumises à une évaluation utilisant à la fois le western blotting et l’analyse immunohistochimique à différents moments allant du jour 1 au jour 7 après la chirurgie, une période post-lésionnelle, qui a montré une induction remarquable de l’activation pro- et anti-inflammatoire des microglies/macrophages ainsi que des astrocytes après ICH (Sukumari-Ramesh et al, 2012b, 2016 ; Bonsack et al., 2016).
Notamment, les coupes de cerveau provenant de zones de cerveau sham ou controlatérales à l’HIC présentaient une expression très marginale ou indétectable de la Galectine-1 et de la Galectine-3 alors qu’une expression accrue de la Galectine-1 et de la Galectine-3 a été observée au jour 3, jour 5 et jour 7-post HIC (Figures 1, 2). Dans le même ordre d’idées, le nombre de cellules immunopositives pour la Galectine-1 a augmenté de façon significative d’environ 4, 6 et 4 fois au jour 3, au jour 5 et au jour 7 après l’HIC, respectivement, par rapport à l’état simulé (Figure 1B). Cette observation a été validée par une analyse par transfert de l’Ouest, qui a révélé une induction remarquable et significative de la Galectine-1 à partir du 3e jour après l’HIC, par rapport à l’échantillon simulé (Figures 1C, D). En outre, l’induction de la Galectine-3 (figure 2) a reflété l’expression de la Galectine-1 après l’HIC et les cellules immunopositives pour la Galectine-3 étaient environ 15, 28 et 24 fois plus nombreuses au jour 3, au jour 5 et au jour 7 après l’HIC (figure 2B) par rapport à l’échantillon simulé et l’analyse par western blot suivie d’une analyse densitométrique a confirmé l’augmentation de l’expression de la Galectine-3 induite par la blessure après l’HIC (figures 2C, D).
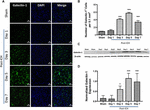
Figure 1. Augmentation de l’expression de la Galectine-1 après une HIC. (A) Images confocales illustrant le schéma d’expression temporelle de la Galectine-1 après une HIC (barre d’échelle = 20 μm ; n = 3-5 par groupe). (B) Le nombre moyen de cellules positives à la Galectine-1 par 0,1 mm2 dans le striatum ipsilatéral. (C) L’augmentation de l’expression de la Galectine-1 a été confirmée par transfert de western du tissu cérébral du striatum ipsilatéral. (D) Analyse densitométrique (n = 3-5 par groupe) des données de western blotting. ∗p < 0,05, ∗∗p < 0,001 vs sham.
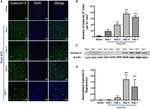
Figure 2. Expression accrue de la Galectine-3 après une HIC. (A) Schéma d’expression temporelle de la Galectine-3 dans la zone périhématomique après une HIC. Les images confocales représentatives montrent une augmentation remarquable de l’expression de la Galectine-3 après l’HIC par rapport à Sham (barre d’échelle = 20 μm ; n = 3-5 par groupe). (B) Nombre moyen de cellules positives pour la Galectine-3 par 0,1 mm2 dans le striatum ipsilatéral. (C) L’expression temporelle de la Galectine-3 a été confirmée par western blotting. (D) Analyse densitométrique (n = 3-5 par groupe) des données de western blotting. ∗∗p < 0,01, ∗∗p < 0,001 vs sham.
Localisation cellulaire de la Galectine-1 et de la Galectine-3 après l’HIC
Pour déterminer la localisation cellulaire de la Galectine-1 et de la Galectine-3 après l’HIC, les coupes de cerveau ont été soumises à une immunocoloration à double marque. L’expression de la Galectine-1 a été principalement observée dans les astrocytes GFAP-positifs (Figure 3A) et le comptage stéréotaxique des cellules a révélé que 85% des cellules positives à la Galectine-1 co-exprimaient la GFAP après l’HIC. En outre, l’expression de la Galectine-1 a également été observée dans les microglies/macrophages positifs pour Iba1- après l’HIC (figure 3B), mais seulement 12% des cellules positives pour la Galectine-1 co-expriment Iba1.
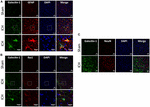
Figure 3. L’expression de la galectine-1 est principalement observée dans les cellules gliales après une HIC. Des sections de cerveau ont été doublement immunocolorées pour (A) Galectin-1 et GFAP, (B) Galectin-1 et Iba1, (le panneau inférieur représente les images à fort grossissement) et (C) Galectin-1 et NeuN (barre d’échelle = 20 μm ; n = 3 par groupe). L’expression de la galectine-1 a été observée principalement dans les cellules positives à la GFAP et dans un sous-ensemble de cellules positives à l’Iba1. Les cellules positives au NeuN n’exprimaient pas la Galectine-1 (n = 3 par groupe).
En revanche, l’expression de la Galectine-3 était principalement confinée aux cellules positives à l’Iba1 (figure 4A) et l’expression de la Galectine-3 était absente des cellules positives à la GFAP (figure 5A), indiquant une expression cellulaire différentielle de la Galectine-1 et de la Galectine-3 après une HIC. En outre, l’expression de la Galectine-3 a été observée dans les cellules CD16/32 positives, marqueurs pro-inflammatoires M1 des microglies ou des macrophages (Figure 4B), ce qui implique un nouveau rôle de la Galectine-3 dans les réponses neuro-inflammatoires après une HIC. Notamment, 88 et 92 % des cellules positives pour la Galectine-3 coexprimaient Iba1 et les cellules positives pour CD16/32, respectivement. Il convient de noter que les microglies ou les macrophages exprimant la Galectine-3 présentaient un phénotype phagocytaire (Figures 4A, B), ce qui implique son rôle inexploré dans la phagocytose médiée par les microglies ou les macrophages après une HIC. De plus, les cellules NeuN-positives n’exprimaient ni la Galectine-1 ni la Galectine-3 (Figures 3C, 5B).
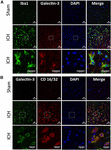
Figure 4. Expression de la galectine-3 dans les microglies/macrophages après une HIC. Des coupes de cerveau ont été immunocolorées pour (A) Galectin-3 et Iba1, et (B) Galectin-3 et CD 16/32. Les cellules positives pour Iba1 (un marqueur de la microglie/macrophages) ainsi que pour CD16/32 (un marqueur de la microglie ou des macrophages M1 pro-inflammatoires), co-expriment la Galectine-3 (n = 3 par groupe).
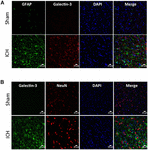
Figure 5. Localisation cellulaire de la Galectine-3 après une HIC. Des sections de cerveau ont été doublement immunocolorées avec (A) Galectin-3 et GFAP, et (B) Galectin-3 et NeuN. L’expression de la Galectine-3 était absente dans les cellules positives à la GFAP ou à la NeuN. Barre d’échelle = 20 μm ; n = 3 par groupe.
Régulation de la réponse inflammatoire médiée par la Galectine-1 et la Galectine-3
Pour établir le rôle fonctionnel possible de la Galectine-1 et de la Galectine-3 après une HIC, nous avons réalisé des études in vitro. La Galectine-1 recombinante (6,25 et 12,5 μg/ml) a significativement atténué la libération induite par le LPS d’une cytokine pro-inflammatoire, l’Interleukine -6 (IL-6) des cellules RAW 264,7 estimée par ELISA par rapport aux contrôles (Figure 6) impliquant un rôle régulateur négatif de la Galectine-1 dans l’inflammation.

Figure 6. Galectine-1 recombinante et réponse inflammatoire. Avant la stimulation par le LPS (100 ng/ml), les cellules Raw 264.7 ont été traitées par la Galectine-1 recombinante, et la libération d’IL-6 a été mesurée par ELISA, comme détaillé dans les méthodes. La Galectine-1 recombinante a significativement réduit la libération d’IL-6 induite par le LPS dans les cellules RAW 246.7 (n = 4 par groupe). ∗∗∗∗p < 0,001 vs LPS.
Pour tester le rôle fonctionnel de la Galectine-3, nous avons effectué un knockdown génétique médié par siRNA de la Galectine-3 dans les cellules RAW 264.7 et examiné la réponse inflammatoire. L’inhibition génétique à l’aide d’un siRNA a réduit de manière significative l’expression de la Galectine-3 dans les cellules RAW 264.7 de 52,95 %, comme le montre le transfert de western (Figures 7A, B). En particulier, l’élimination génétique de la Galectine-3 par le siRNA n’a pas modulé la libération d’IL-6 induite par le LPS (Figure 7C), alors que l’élimination génétique de la Galectine-3 a augmenté de manière significative la libération d’IL-6 induite par l’hémine (un métabolite de l’hémoglobine qui s’accumule à une concentration élevée dans les hématomes intracrâniens) (Figure 7D), ce qui implique un rôle inexploré de la Galectine-3 dans la modulation de la réponse inflammatoire après une HIC.
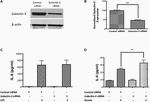
Figure 7. Galectine-3 et réponse inflammatoire (A) Les cellules RAW 246.7 ont été traitées avec soit un siRNA de contrôle, soit un siRNA de Galectine-3 comme détaillé dans les méthodes et le knockdown génétique de la Galectine-3 a été vérifié en utilisant (A) un western blotting suivi par (B) une analyse densitométrique. ∗∗∗p < 0,001 vs siRNA de contrôle. (C) Le knockdown de la galectine-3 n’a pas modulé la libération d’IL-6 induite par le LPS (D) alors qu’il a significativement dérégulé la libération d’IL-6 induite par l’hémine des cellules RAW 246,7 par rapport au contrôle (n = 3 par groupe). ∗∗p < 0,01 vs hémines.
Discussion
Les galectines sont une famille de protéines endogènes liant les glucides qui jouent des rôles critiques dans des conditions physiologiques et pathologiques en interagissant avec des récepteurs glycosylés à la surface des cellules et en modulant les voies de signalisation intracellulaires (Perillo et al, 1995, 1998 ; Yang et al., 1996 ; Moiseeva et al., 1999 ; Vespa et al., 1999 ; Yamaoka et al., 2000 ; Goldring et al., 2002 ; Laaf et al., 2019). Les galectines présentent une importante similitude de séquence dans leur domaine de reconnaissance des glucides (CRD) avec une affinité accrue pour les β-galactosides et sont définies à l’origine par leur capacité à reconnaître le disaccharide N-acétyllactosamine (Barondes et al., 1994a,b ; Kasai et Hirabayashi, 1996). Cependant, des études récentes démontrent des différences substantielles dans leurs propriétés de liaison aux hydrates de carbone (Hirabayashi et al., 2002 ; Leffler et al., 2002 ; Carlsson et al., 2007).
La galectine-1, le membre le plus ubiquitairement exprimé de la famille des galectines (Stillman et al., 2006) a été impliquée dans la régulation de l’immunité innée et adaptative et est présente dans des emplacements intracellulaires et extracellulaires (Verschuere et al., 2014). Les fonctions extracellulaires de la Galectine-1 reposent en grande partie sur les propriétés de liaison aux glucides, tandis que les fonctions intracellulaires impliquent principalement des interactions indépendantes des glucides (Verschuere et al., 2014). Conformément au rôle de la Galectine-1 dans la réponse immunitaire en périphérie, la Galectine-1 est connue pour supprimer l’activation des macrophages (Barrionuevo et al., 2007), promouvoir l’apoptose sélective des cellules T (Toscano et al., 2007), induire la sécrétion de la cytokine anti-inflammatoire, IL-10 (van der Leij et al., 2004 ; Cedeno-Laurent et al., 2012), et atténue la production d’oxyde nitrique (NO) par les macrophages (Correa et al., 2003).
La galectine-1 est largement exprimée dans les tissus nerveux aux stades embryonnaires, mais devient principalement limitée aux tissus périphériques lors de la maturation (Horie et Kadoya, 2002). De manière cohérente, le striatum du cerveau non lésé présente une expression marginale de la Galectine-1. Cependant, après une lésion cérébrale hémorragique, une expression très remarquable de la Galectine-1 a été observée dans les astrocytes GFAP-positifs. Dans cette optique, la Galectine-1 est impliquée dans la différenciation des astrocytes et la libération ultérieure de BDNF (Brain Derived Neurotrophic factor) après une lésion cérébrale, ce qui implique un rôle de la Galectine-1 dans la neuroprotection (Sasaki et al., 2004 ; Qu et al., 2010). En outre, la galectine-1 est l’un des principaux régulateurs de la neurogenèse adulte grâce à sa capacité de liaison aux glucides et favorise la récupération fonctionnelle après un accident vasculaire cérébral (Ishibashi et al., 2007). L’administration de la galectine-1 réduit l’apoptose des neurones, diminue le volume de l’infarctus cérébral et améliore la fonction neurologique induite par l’ischémie cérébrale (Qu et al., 2011). De même, la galectine-1 native et recombinante a protégé les neurones cérébelleux de souris et de rat des effets neurotoxiques du glutamate (Lekishvili et al., 2006). Il convient de noter que la galectine-1 désactive la microglie inflammatoire et protège de la neurodégénérescence induite par l’inflammation (Starossom et al., 2012). De plus, nos études ont démontré que la Galectine-1 recombinante atténue la libération d’une cytokine pro-inflammatoire, IL-6, à partir de macrophages murins stimulés par le LPS, RAW 264.7, par rapport aux contrôles, impliquant un rôle régulateur négatif de la Galectine-1 dans l’inflammation.
La Galectine-1 est l’un des ligands endogènes du CD45 (Walzel et al., 1999), qui régule l’activation des microglies/macrophages. De plus, l’interaction de la Galectine-1 avec le CD45 conduit à la rétention de cette glycoprotéine sur la membrane plasmique et à l’augmentation de son activité phosphatase. Des études récentes ont démontré que le CD45 régule négativement l’activation de la microglie M1 proinflammatoire mais favorise le phénotype M2 anti-inflammatoire par la modulation des voies de signalisation de la protéine kinase p38 (p38MAPK) activée par des agents mitogènes, de la liaison de l’élément de réponse à l’AMPc (CREB) et du facteur nucléaire kappa-chaîne légère-enhancer des cellules B activées (NF-kB) (Starossom et al., 2012). Cet effet implique la liaison de la Galectine-1 aux O-glycanes du noyau 2 du CD45, ce qui suggère que l’expression des groupements glycaniques sur les microglies/macrophages activés est nécessaire pour la liaison et la fonction de la Galectine-1 (Starossom et al., 2012). En outre, la Galectine-1 a supprimé la neuroinflammation induite par la méthamphétamine dans les cellules endothéliales microvasculaires du cerveau humain (Parikh et al., 2015) et il est suggéré que la Galectine-1 soit impliquée dans la croissance des neurites et la connectivité synaptique. Dans l’ensemble, les données suggèrent que l’induction de la Galectine-1 dans les astrocytes réactifs après une HIC pourrait être un mécanisme de communication intercellulaire facilitant la régulation médiée par les astrocytes de la neuroprotection après une HIC, ce qui justifie une étude plus approfondie.
La Galectine-3 est une protéine de type chimérique de 25-35 kDa dont les fonctions dépendent étroitement de la localisation (Thomas et Pasquini, 2018). L’expression de la Galectine-3 a été trouvée dans le noyau, et le cytoplasme (Liu et al., 2002). En outre, les macrophages et la microglie activée peuvent libérer la Galectine-3 dans l’espace extracellulaire, ce qui entraîne un remodelage de la matrice extracellulaire et une modification de la réponse inflammatoire, respectivement (Li et al., 2008 ; Jeon et al., 2010). Au lieu de suivre la voie de sécrétion classique du réticulum endoplasmique et du Golgi, la Galectine-3 suit une voie sécrétoire alternative pour la sécrétion et l’exportation (Mehul et Hughes, 1997) et lors de sa libération, la Galectine-3 interagit avec plusieurs récepteurs extracellulaires. Bien que la Galectine-3 soit étroitement liée à la cascade de réactions inflammatoires, le rôle fonctionnel précis de la Galectine-3 dans la neuroinflammation est largement controversé. Cependant, il a été signalé que la galectine-3 libérée par la microglie agissait comme un ligand TLR-4 (Toll Like Receptor-4) endogène (Burguillos et al., 2015). De plus, la délétion génétique de la galectine-3 a réduit la perte neuronale et l’administration d’anticorps anti-galectine-3 a exercé des effets neuroprotecteurs dans un modèle préclinique de lésion cérébrale traumatique (Yip et al., 2017), ce qui implique un rôle néfaste de la galectine-3 après une lésion cérébrale. En revanche, la délétion ciblée de la Galectine-3 a exacerbé les lésions cérébrales ischémiques et la neurodégénérescence après une ischémie cérébrale (Lalancette-Hebert et al., 2012), ce qui suggère un rôle neuroprotecteur de la Galectine-3 après une lésion cérébrale. En outre, la Galectine-3 contribue à l’angiogenèse et à la neurogenèse, ce qui implique son rôle possible dans la réparation du cerveau post-ischémique (Yan et al., 2009). La galectine-3 a également favorisé la différenciation des oligodendroglies, contribuant ainsi à la récupération fonctionnelle après des troubles démyélinisants (Pasquini et al., 2011). Ces rôles fonctionnels contradictoires de la Galectine-3 après une neuropathologie pourraient être dus à l’expression subcellulaire différentielle de la Galectine-3 ou à la différence de physiopathologie des troubles cérébraux, ce qui justifie une étude plus approfondie.
Conformément à d’autres conditions neuropathologiques, nous avons observé une expression élevée de la Galectine-3 après une HIC et l’expression était principalement observée dans les cellules positives Iba1, les cellules inflammatoires du SNC. Les cellules positives Iba1 après une HIC pourraient être soit des microglies, soit des macrophages infiltrants, qui jouent un rôle dans la réponse immunitaire innée. Des études récentes démontrent que la microglie et les macrophages peuvent avoir des rôles différentiels après une pathologie cérébrale (Gao et al., 2017). Dans le même ordre d’idées, des études sur des cultures primaires de microglies documentent un rôle pro-inflammatoire de la Galectine-3 (Burguillos et al., 2015), alors que des études sur des macrophages démontrent un rôle anti-inflammatoire (MacKinnon et al., 2008), ce qui justifie une étude plus approfondie. De plus, le knockdown génétique de la Galectine-3 dans les cellules RAW 246.7 a augmenté la libération d’IL-6, une cytokine pro-inflammatoire induite par l’hémoglobine, impliquant un rôle de la Galectine-3 dans les réponses inflammatoires après une HIC. En outre, les microglies ou les macrophages exprimant la Galectine-3 ont présenté un phénotype phagocytaire, ce qui implique son rôle inexploré dans la phagocytose médiée par les microglies ou les macrophages, qui joue un rôle clé dans la résolution de l’hématome et la récupération cérébrale ultérieure après une HIC. De manière cohérente, des rapports récents suggèrent que les macrophages qui s’accumulent dans le SNC pendant l’infection parasitaire expriment abondamment la Galectine-3 (Quenum Zangbede et al., 2018) et que la microglie activée phagocyte les cellules via la Galectine-3 (Nomura et al., 2017). En outre, des niveaux plasmatiques élevés de Galectin-3 ont été fortement associés à l’inflammation, à la gravité et aux mauvais résultats chez les patients atteints d’HIC aiguë (Yan et al., 2016). Par conséquent, des études supplémentaires sont nécessaires pour élucider les rôles fonctionnels de la Galectine-3 après une HIC.
Conclusion
La Galectine-1 et la Galectine-3 ont présenté une expression très profonde et accrue du jour 3 au jour 7-post-lésion, dans la région cérébrale périhématomique après une HIC par rapport à Sham. De plus, l’expression de la Galectine-1 a été principalement observée dans les astrocytes positifs au GFAP, tandis que l’expression de la Galectine-3 a été observée principalement dans les cellules Iba1 ainsi que dans les cellules positives au CD16/32, les cellules inflammatoires du SNC. En outre, des études génétiques ont révélé un rôle régulateur négatif de la Galectine-1 et de la Galectine-3 dans la libération d’une cytokine pro-inflammatoire, l’IL-6, en fonction du stimulus. Dans l’ensemble, les données suggèrent que la Galectine-1 et la Galectine-3 pourraient être ciblées dans la modulation des réponses gliales et, par conséquent, des lésions cérébrales après une HIC, ce qui justifie une étude plus approfondie.
Déclaration d’éthique
Les études sur les animaux ont été examinées et approuvées par le comité d’utilisation des animaux pour la recherche et l’éducation de l’Université d’Augusta, conformément aux directives du NIH et de l’USDA.
Contributions des auteurs
FB a réalisé les études immunohistochimiques, et de culture cellulaire et le western blotting et a participé à l’analyse des données. SS-R a conçu et dessiné les expériences, réalisé les opérations sur les animaux, les études génétiques et l’analyse des données, et a rédigé le manuscrit. Les deux auteurs ont lu et approuvé le manuscrit final.
Funding
Ce travail a été soutenu par des subventions des National Institutes of Health (R01NS107853) et de l’American Heart Association (14SDG18730034) à SS-R.
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Matériel supplémentaire
Le matériel supplémentaire pour cet article peut être trouvé en ligne à : https://www.frontiersin.org/articles/10.3389/fncel.2019.00157/full#supplementary-material
FIGURE S1 | Le schéma temporel de l’hématome après une HIC.
Abréviations
CD16/32, Cluster of Differentiation 16/32 ; CD45 : Cluster of Differentiation 45 ; SNC, système nerveux central ; ELISA, enzyme linked immunosorbent assay ; GFAP, glial fibrillary acidic protein ; Hb, hémoglobine ; Iba1, ionized calcium binding adaptor molecule 1 ; ICH, Intracerebral Hemorrhage ; LPS, lipopolysaccharide ; NeuN, neuronal nuclei ; PBS, phosphate buffer saline ; RIPA, radioimmunoprecipitation.
Aguilar, M. I., et Freeman, W. D. (2010). Hémorragie intracérébrale spontanée. Semin. Neurol. 30, 555-564.
Google Scholar
Ahmad, A. S., Mendes, M., Hernandez, D., et Dore, S. (2017). Efficacité du laropiprant pour minimiser les lésions cérébrales après une hémorragie intracérébrale expérimentale. Sci. Rep. 7:9489.
PubMed Abstract | Google Scholar
Babu, R., Bagley, J. H., Di, C., Friedman, A. H., et Adamson, C. (2012). La thrombine et l’hémine comme facteurs centraux dans les mécanismes des lésions cérébrales secondaires induites par les hémorragies intracérébrales et comme cibles potentielles d’intervention. Neurosurg. Focus 32:E8.
PubMed Abstract | Google Scholar
Barondes, S. H., Castronovo, V., Cooper, D. N., Cummings, R. D., Drickamer, K., Feizi, T., et al. (1994a). Galectins : a family of animal beta-galactoside-binding lectins. Cell 76, 597-598. doi : 10.1016/0092-8674(94)90498-7
CrossRef Full Text | Google Scholar
Barondes, S. H., Cooper, D. N., Gitt, M. A., and Leffler, H. (1994b). Galectins. Structure et fonction d’une grande famille de lectines animales. J. Biol. Chem. 269, 20807-20810.
Google Scholar
Barrionuevo, P., Beigier-Bompadre, M., Ilarregui, J. M., Toscano, M. A., Bianco, G. A., Isturiz, M. A., et al. (2007). A novel function for galectin-1 at the crossroad of innate and adaptive immunity : galectin-1 regulates monocyte/macrophage physiology through a nonapoptotic ERK-dependent pathway. J. Immunol. 178, 436-445. doi : 10.4049/jimmunol.178.1.436
PubMed Abstract | CrossRef Full Text | Google Scholar
Bonsack, F. T., Alleyne, C. H. Jr. et Sukumari-Ramesh, S. (2016). Expression accrue de la TSPO après une hémorragie intracérébrale : un rôle dans l’inflammation ? J. Neuroinflamm. 13:151.
PubMed Abstract | Google Scholar
Broderick, J., Connolly, S., Feldmann, E., Hanley, D., Kase, C., Krieger, D., et al. (2007). Guidelines for the management of spontaneous intracerebral hemorrhage in adults : 2007 update : a guideline from the American heart association/american stroke association stroke council, high blood pressure research council, and the quality of care and outcomes in research interdisciplinary working group. Circulation 116,e391-e413.
Google Scholar
Burguillos, M. A., Svensson, M., Schulte, T., Boza-Serrano, A., Garcia-Quintanilla, A., Kavanagh, E., et al. (2015). La galectine-3 sécrétée par la microglie agit comme un ligand du récepteur 4 de type péage et contribue à l’activation microgliale. Cell Rep. 10, 1626-1638. doi : 10.1016/j.celrep.2015.02.012
PubMed Abstract | CrossRef Full Text | Google Scholar
Cai, Y., Cho, G. S., Ju, C., Wang, S. L., Ryu, J. H., Shin, C. Y., et al. (2011). La microglie activée est moins vulnérable à la toxicité de l’hémine grâce à l’inhibition de l’activation de JNK et de p38 MAPK par l’oxyde nitrique. J. Immunol. 187, 1314-1321. doi : 10.4049/jimmunol.1002925
PubMed Abstract | CrossRef Full Text | Google Scholar
Carlsson, S., Oberg, C. T., Carlsson, M. C., Sundin, A., Nilsson, U. J., Smith, D., et al. (2007). Affinité de la galectine-8 et de ses domaines de reconnaissance des glucides pour les ligands en solution et à la surface des cellules. Glycobiologie 17, 663-676. doi : 10.1093/glycob/cwm026
PubMed Abstract | CrossRef Full Text | Google Scholar
Carmichael, S. T., Vespa, P. M., Saver, J. L., Coppola, G., Geschwind, D. H., Starkman, S., et al. (2008). Profils génomiques des dommages et de la protection dans l’hémorragie intracérébrale humaine. J. Cereb. Blood Flow Metab. 28, 1860-1875. doi : 10.1038/jcbfm.2008.77
PubMed Abstract | CrossRef Full Text | Google Scholar
Cedeno-Laurent, F., Opperman, M., Barthel, S. R., Kuchroo, V. K., et Dimitroff, C. J. (2012). La galectine-1 déclenche une signature immunorégulatrice dans les cellules Th définie fonctionnellement par l’expression de l’IL-10. J. Immunol. 188, 3127-3137. doi : 10.4049/jimmunol.1103433
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen-Roetling, J., Kamalapathy, P., Cao, Y., Song, W., Schipper, H. M., et Regan, R. F. (2017). L’hème oxygénase-1 astrocytaire réduit la mortalité et améliore le résultat après une hémorragie intracérébrale induite par la collagénase. Neurobiol. Dis. 102, 140-146. doi : 10.1016/j.nbd.2017.03.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Correa, S. G., Sotomayor, C. E., Aoki, M. P., Maldonado, C. A., et Rabinovich, G. A. (2003). Opposite effects of galectin-1 on alternative metabolic pathways of L-arginine in resident, inflammatory, and activated macrophages. Glycobiologie 13, 119-128. doi : 10.1093/glycob/cwg010
PubMed Abstract | CrossRef Full Text | Google Scholar
Dang, T. N., Robinson, S. R., Dringen, R., et Bishop, G. M. (2011). Absorption, métabolisme et toxicité de l’hémine dans les neurones en culture. Neurochem. Int. 58, 804-811. doi : 10.1016/j.neuint.2011.03.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Gao, H., Danzi, M. C., Choi, C. S., Taherian, M., Dalby-Hansen, C., Ellman, D. G., et al. (2017). Fonctions opposées du TNFR2 microglial et macrophagique dans la pathogenèse de l’encéphalomyélite auto-immune expérimentale. Cell Rep. 18, 198-212. doi : 10.1016/j.celrep.2016.11.083
PubMed Abstract | CrossRef Full Text | Google Scholar
Goldring, K., Jones, G. E., Thiagarajah, R., et Watt, D. J. (2002). L’effet de la galectine-1 sur la différenciation des fibroblastes et des myoblastes in vitro. J. Cell Sci. 115(Pt 2), 355-366.
PubMed Abstract | Google Scholar
Hickenbottom, S. L., Grotta, J. C., Strong, R., Denner, L. A., and Aronowski, J. (1999). Nuclear factor-kappaB and cell death after experimental intracerebral hemorrhage in rats. Stroke 30, 2472-2477.
Google Scholar
Hirabayashi, J., Hashidate, T., Arata, Y., Nishi, N., Nakamura, T., Hirashima, M., et al. (2002). Oligosaccharide specificity of galectins : a search by frontal affinity chromatography. Biochim. Biophys. Acta 1572, 232-254. doi : 10.1016/s0304-4165(02)00311-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Horie, H., et Kadoya, T. (2002). La galectine-1 joue des rôles essentiels dans les tissus nerveux des mammifères adultes. Rôles de la galectine-1 oxydée. Glycoconjugate J. 19, 479-489. doi : 10.1023/b:glyc.0000014077.84016.52
PubMed Abstract | CrossRef Full Text | Google Scholar
Ishibashi, S., Kuroiwa, T., Sakaguchi, M., Sun, L., Kadoya, T., Okano, H., et al. (2007). La galectine-1 régule la neurogenèse dans la zone subventriculaire et favorise la récupération fonctionnelle après un accident vasculaire cérébral. Exp. Neurol. 207, 302-313. doi : 10.1016/j.expneurol.2007.06.024
PubMed Abstract | CrossRef Full Text | Google Scholar
Jeon, S. B., Yoon, H. J., Chang, C. Y., Koh, H. S., Jeon, S. H., et Park, E. J. (2010). Galectin-3 exerce des actions régulatrices de type cytokine par la voie JAK-STAT. J. Immunol. 185, 7037-7046. doi : 10.4049/jimmunol.1000154
PubMed Abstract | CrossRef Full Text | Google Scholar
Kasai, K., et Hirabayashi, J. (1996). Galectines : une famille de lectines animales qui déchiffrent les glycocodes. J. Biochem. 119, 1-8. doi : 10.1093/oxfordjournals.jbchem.a021192
CrossRef Full Text | Google Scholar
Laaf, P., Elling, L., and Kren, V. (2019). Interactions galectine-glucides dans la biomédecine et la biotechnologie. Trends Biotechnol. 37, 402-415.
PubMed Abstract | Google Scholar
Laird, M. D., Sukumari-Ramesh, S., Swift, A. E., Meiler, S. E., Vender, J. R., et Dhandapani, K. M. (2010). La curcumine atténue l’œdème cérébral après une lésion cérébrale traumatique chez la souris : un rôle possible pour l’aquaporine-4 ? J. Neurochem. 113, 637-648. doi : 10.1111/j.1471-4159.2010.06630.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Lalancette-Hebert, M., Swarup, V., Beaulieu, J. M., Bohacek, I., Abdelhamid, E., Weng, Y. C., et al. (2012). La galectine-3 est nécessaire à l’activation et à la prolifération de la microglie résidente en réponse à une blessure ischémique. J. Neurosci. 32, 10383-10395. doi : 10.1523/jneurosci.1498-12.2012
PubMed Abstract | CrossRef Full Text | Google Scholar
Leffler, H., Carlsson, S., Hedlund, M., Qian, Y., et Poirier, F. (2002). Introduction aux galectines. Glycoconjugate J. 19, 433-440. doi : 10.1023/b:glyc.0000014072.34840.04
CrossRef Full Text | Google Scholar
Leira, R., Davalos, A., Silva, Y., Gil-Peralta, A., Tejada, J., Garcia, M., et al. (2004). Early neurologic deterioration in intracerebral hemorrhage : predictors and associated factors. Neurology 63, 461-467. doi : 10.1212/01.wnl.0000133204.81153.ac
CrossRef Full Text | Google Scholar
Lekishvili, T., Hesketh, S., Brazier, M. W., and Brown, D. R. (2006). La galectine-1 de souris inhibe la toxicité du glutamate en modifiant l’expression du récepteur NR1 NMDA. Eur. J. Neurosci. 24, 3017-3025. doi : 10.1111/j.1460-9568.2006.05207.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, Y., Komai-Koma, M., Gilchrist, D. S., Hsu, D. K., Liu, F. T., Springall, T., et al. (2008). Galectin-3 est un régulateur négatif de l’inflammation médiée par le lipopolysaccharide. J. Immunol. 181, 2781-2789. doi : 10.4049/jimmunol.181.4.2781
PubMed Abstract | CrossRef Full Text | Google Scholar
Lin, S., Yin, Q., Zhong, Q., Lv, F. L., Zhou, Y., Li, J. Q., et al. (2012). L’hème active les lésions inflammatoires médiées par TLR4 via la voie de signalisation MyD88/TRIF dans l’hémorragie intracérébrale. J. Neuroinflamm. 9:46.
PubMed Abstract | Google Scholar
Liu, F. T., Patterson, R. J., et Wang, J. L. (2002). Fonctions intracellulaires des galectines. Biochim. Biophys. Acta 1572, 263-273. doi : 10.1016/s0304-4165(02)00313-6
CrossRef Full Text | Google Scholar
MacKinnon, A. C., Farnworth, S. L., Hodkinson, P. S., Henderson, N. C., Atkinson, K. M., Leffler, H., et al. (2008). Regulation of alternative macrophage activation by galectin-3. J. Immunol. 180, 2650-2658. doi : 10.4049/jimmunol.180.4.2650
CrossRef Full Text | Google Scholar
Mehul, B., and Hughes, R. C. (1997). Ciblage de la membrane plasmique, bourgeonnement vésiculaire et libération de la galectine 3 du cytoplasme des cellules de mammifères pendant la sécrétion. J. Cell Sci. 110( Pt 10), 1169-1178.
PubMed Abstract | Google Scholar
Min, H., Choi, B., Jang, Y. H., Cho, I. H., et Lee, S. J. (2017). La molécule d’hème fonctionne comme un agoniste endogène du TLR2 des astrocytes pour contribuer aux dommages cérébraux secondaires après une hémorragie intracérébrale. Mol. Brain 10:27.
PubMed Abstract | Google Scholar
Moiseeva, E. P., Spring, E. L., Baron, J. H., et de Bono, D. P. (1999). La galectine 1 module l’attachement, l’étalement et la migration des cellules musculaires lisses vasculaires en culture via des interactions avec des récepteurs cellulaires et des composants de la matrice extracellulaire. J. Vasc. Res. 36, 47-58. doi : 10.1159/000025625
PubMed Abstract | CrossRef Full Text | Google Scholar
Nomura, K., Vilalta, A., Allendorf, D. H., Hornik, T. C., et Brown, G. C. (2017). La microglie activée désialyle et phagocyte les cellules via la neuraminidase. Galectin-3, et Mer Tyrosine Kinase. J. Immunol. 198, 4792-4801. doi : 10.4049/jimmunol.1502532
PubMed Abstract | CrossRef Full Text | Google Scholar
Parikh, N. U., Aalinkeel, R., Reynolds, J. L., Nair, B. B., Sykes, D. E., Mammen, M. J., et al. (2015). Galectin-1 supprime la neuroinflammation induite par la méthamphétamine dans les cellules endothéliales microvasculaires du cerveau humain : rôle neuroprotecteur dans le maintien de l’intégrité de la barrière hémato-encéphalique. Brain Res. 1624, 175-187. doi : 10.1016/j.brainres.2015.07.033
PubMed Abstract | CrossRef Full Text | Google Scholar
Pasquini, L. A., Millet, V., Hoyos, H. C., Giannoni, J. P., Croci, D. O., Marder, M., et al. (2011). Galectin-3 conduit la différenciation des oligodendrocytes pour contrôler l’intégrité et la fonction de la myéline. Cell Death. Diff. 18, 1746-1756. doi : 10.1038/cdd.2011.40
PubMed Abstract | CrossRef Full Text | Google Scholar
Perillo, N. L., Marcus, M. E., et Baum, L. G. (1998). Galectins : modulateurs polyvalents de l’adhésion cellulaire, de la prolifération cellulaire et de la mort cellulaire. J. Mol. Med. (Berl.) 76, 402-412. doi : 10.1007/s001090050232
PubMed Abstract | CrossRef Full Text | Google Scholar
Perillo, N. L., Pace, K. E., Seilhamer, J. J., and Baum, L. G. (1995). Apoptosis of T cells mediated by galectin-1. Nature 378, 736-739. doi : 10.1038/378736a0
PubMed Abstract | CrossRef Full Text | Google Scholar
Platt, N., da Silva, R. P., et Gordon, S. (1998). Reconnaître la mort : la phagocytose des cellules apoptotiques. Trends Cell Biol. 8, 365-372. doi : 10.1016/s0962-8924(98)01329-4
CrossRef Full Text | Google Scholar
Qu, W. S., Wang, Y. H., Ma, J. F., Tian, D. S., Zhang, Q., Pan, D. J., et al. (2011). La galectine-1 atténue les lésions associées à l’astrogliose et améliore la récupération des rats après une ischémie cérébrale focale. J. Neurochem. 116, 217-226. doi : 10.1111/j.1471-4159.2010.07095.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Qu, W. S., Wang, Y. H., Wang, J. P., Tang, Y. X., Zhang, Q., Tian, D. S., et al. (2010). Galectin-1 augmente la production astrocytaire de BDNF et améliore le résultat fonctionnel chez les rats après une ischémie. Neurochem. Res. 35, 1716-1724. doi : 10.1007/s11064-010-0234-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Quenum Zangbede, F. O., Chauhan, A., Sharma, J., et Mishra, B. B. (2018). La galectine-3 dans les macrophages M2 joue un rôle protecteur dans la résolution de la neuropathologie dans l’infection parasitaire du cerveau en régulant le turnover des neutrophiles. J. Neurosci. 38, 6737-6750. doi : 10.1523/jneurosci.3575-17.2018
PubMed Abstract | CrossRef Full Text | Google Scholar
Qureshi, A. I., Ling, G. S., Khan, J., Suri, M. F., Miskolczi, L., Guterman, L. R., et al. (2001a). Analyse quantitative des cellules blessées, nécrotiques et apoptotiques dans un nouveau modèle expérimental d’hémorragie intracérébrale. Crit. Care Med. 29, 152-157. doi : 10.1097/00003246-200101000-00030
PubMed Abstract | CrossRef Full Text | Google Scholar
Qureshi, A. I., Tuhrim, S., Broderick, J. P., Batjer, H. H., Hondo, H., et Hanley, D. F. (2001b). Spontaneous intracerebral hemorrhage. N. Engl. J. Med. 344, 1450-1460.
Google Scholar
Ribo, M., et Grotta, J. C. (2006). Dernières avancées dans l’hémorragie intracérébrale. Curr. Neurol. Neurosci. Rep. 6, 17-22. doi : 10.1007/s11910-996-0004-0
CrossRef Full Text | Google Scholar
Robinson, S. R., Dang, T. N., Dringen, R., and Bishop, G. M. (2009). La toxicité de l’hémine : une source évitable de dommages au cerveau après un accident vasculaire cérébral hémorragique. Redox Rep. 14, 228-235. doi : 10.1179/135100009×12525712409931
PubMed Abstract | CrossRef Full Text | Google Scholar
Sasaki, T., Hirabayashi, J., Manya, H., Kasai, K., and Endo, T. (2004). Galectin-1 induit la différenciation des astrocytes, ce qui conduit à la production du facteur neurotrophique dérivé du cerveau. Glycobiologie 14, 357-363. doi : 10.1093/glycob/cwh043
PubMed Abstract | CrossRef Full Text | Google Scholar
Shiratori, M., Tozaki-Saitoh, H., Yoshitake, M., Tsuda, M., et Inoue, K. (2010). L’activation du récepteur P2X7 induit la production de CXCL2 dans la microglie par les voies NFAT et PKC/MAPK. J. Neurochem. 114, 810-819. doi : 10.1111/j.1471-4159.2010.06809.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Starossom, S. C., Mascanfroni, I. D., Imitola, J., Cao, L., Raddassi, K., Hernandez, S. F., et al. (2012). La galectine-1 désactive la microglie classiquement activée et protège de la neurodégénérescence induite par l’inflammation. Immunity 37,249-263. doi : 10.1016/j.immuni.2012.05.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Stillman, B. N., Hsu, D. K., Pang, M., Brewer, C. F., Johnson, P., Liu, F. T., et al. (2006). La galectine-3 et la galectine-1 se lient à des récepteurs distincts de glycoprotéines de surface cellulaire pour induire la mort des lymphocytes T. J. Immunol. 176, 778-789. doi : 10.4049/jimmunol.176.2.778
PubMed Abstract | CrossRef Full Text | Google Scholar
Sukumari-Ramesh, S., et Alleyne, C. H. Jr. (2016). L’administration post-blessure de tert-butylhydroquinone atténue les lésions neurologiques aiguës après une hémorragie intracérébrale chez la souris. J. Mol. Neurosci. MN 58, 525-531. doi : 10.1007/s12031-016-0722-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Sukumari-Ramesh, S., Alleyne, C. H. Jr. et Dhandapani, K. M. (2012a). Expression de la survivine spécifique aux astrocytes après une hémorragie intracérébrale chez la souris : un rôle possible dans la gliose réactive ? J. Neurotrauma 29, 2798-2804. doi : 10.1089/neu.2011.2243
PubMed Abstract | CrossRef Full Text | Google Scholar
Sukumari-Ramesh, S., Alleyne, C. H. Jr. et Dhandapani, K. M. (2012b). L’astrogliose : une cible d’intervention dans l’hémorragie intracérébrale ? Transl. Stroke Res. 3(Suppl. 1), 80-87. doi : 10.1007/s12975-012-0165-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Sukumari-Ramesh, S., Alleyne, C. H. Jr. et Dhandapani, K. M. (2016). L’inhibiteur d’histone désacétylase acide suberoylanilide hydroxamique (SAHA) confère une neuroprotection aiguë après une hémorragie intracérébrale chez la souris. Transl. Stroke Res. 7, 141-148. doi : 10.1007/s12975-015-0421-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Tessier, P. A., Naccache, P. H., Clark-Lewis, I., Gladue, R. P., Neote, K. S., and McColl, S. R. (1997). Chemokine networks in vivo : involvement of C-X-C and C-C chemokines in neutrophil extravasation in vivo in response to TNF-alpha. J. Immunol. 159, 3595-3602.
PubMed Abstract | Google Scholar
Thomas, L., et Pasquini, L. A. (2018). Galectin-3-mediated glial crosstalk drives oligodendrocyte differentiation and (Re)myelination. Front. Cell. Neurosci. 12:297. doi : 10.3389/fncel.2018.00297
PubMed Abstract | CrossRef Full Text | Google Scholar
Toscano, M. A., Bianco, G. A., Ilarregui, J. M., Croci, D. O., Correale, J., Hernandez, J. D., et al. (2007). Differential glycosylation of TH1, TH2 and TH-17 effector cells selectively regulates susceptibility to cell death. Nat. Immunol. 8, 825-834. doi : 10.1038/ni1482
PubMed Abstract | CrossRef Full Text | Google Scholar
van Asch, C. J., Luitse, M. J., Rinkel, G. J., van der Tweel, I., Algra, A., et Klijn, C. J. (2010). Incidence, létalité et résultats fonctionnels de l’hémorragie intracérébrale au fil du temps, en fonction de l’âge, du sexe et de l’origine ethnique : examen systématique et méta-analyse. Lancet Neurol. 9, 167-176. doi : 10.1016/s1474-4422(09)70340-0
PubMed Abstract | CrossRef Full Text | Google Scholar
van der Leij, J., van den Berg, A., Blokzijl, T., Harms, G., van Goor, H., Zwiers, P., et al. (2004). Dimeric galectin-1 induces IL-10 production in T-lymphocytes : an important tool in the regulation of the immune response. J. Cathol. 204, 511-518. doi : 10.1002/path.1671
PubMed Abstract | CrossRef Full Text | Google Scholar
Verschuere, T., Toelen, J., Maes, W., Poirier, F., Boon, L., Tousseyn, T., et al. (2014). La galectine-1 dérivée du gliome régule l’immunité antitumorale innée et adaptative. Int. J. Cancer 134, 873-884. doi : 10.1002/ijc.28426
PubMed Abstract | CrossRef Full Text | Google Scholar
Vespa, G. N., Lewis, L. A., Kozak, K. R., Moran, M., Nguyen, J. T., Baum, L. G., et al. (1999). La galectine-1 module spécifiquement les signaux du TCR pour améliorer l’apoptose du TCR mais inhiber la production et la prolifération de l’IL-2. J. Immunol. 162, 799-806.
PubMed Abstract | Google Scholar
Walzel, H., Schulz, U., Neels, P., et Brock, J. (1999). Galectin-1, un ligand naturel pour la protéine tyrosine phosphatase de type récepteur CD45. Immunol. Lett. 67, 193-202. doi : 10.1016/s0165-2478(99)00012-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, J. (2010). Recherche préclinique et clinique sur l’inflammation après une hémorragie intracérébrale. Prog. Neurobiol. 92, 463-477. doi : 10.1016/j.pneurobio.2010.08.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, J., et Dore, S. (2007). Inflammation après une hémorragie intracérébrale. J. Cereb. Blood Flow Metab. 27, 894-908.
Google Scholar
Weng, X., Tan, Y., Chu, X., Wu, X. F., Liu, R., Tian, Y., et al. (2015). Le récepteur 1 de l’acide N-méthyl-D-aspartique (NMDAR1) aggrave les dommages inflammatoires secondaires induits par la voie de l’hémine-NLRP3 après une hémorragie intracérébrale. Chin. J. Traumatol. 18, 254-258. doi : 10.1016/j.cjtee.2015.11.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Yamaoka, K., Mishima, K., Nagashima, Y., Asai, A., Sanai, Y., et Kirino, T. (2000). L’expression de l’ARNm de la galectine-1 est en corrélation avec le potentiel malin des gliomes humains et l’expression de la galectine-1 antisens inhibe la croissance de 9 cellules de gliome. J. Neurosci. Res. 59, 722-730. doi : 10.1002/(sici)1097-4547(20000315)59:6<722::aid-jnr4>3.0.co;2-h
PubMed Abstract | CrossRef Full Text | Google Scholar
Yan, X. J., Yu, G. F., Jie, Y. Q., Fan, X. F., Huang, Q., et Dai, W. M. (2016). Rôle de la galectine-3 dans le plasma comme biomarqueur prédictif du résultat après une hémorragie intracérébrale aiguë. J. Neurol. Sci. 368, 121-127. doi : 10.1016/j.jns.2016.06.071
PubMed Abstract | CrossRef Full Text | Google Scholar
Yan, Y. P., Lang, B. T., Vemuganti, R., et Dempsey, R. J. (2009). Galectin-3 mediates post-ischemic tissue remodeling. Brain Res. 1288, 116-124. doi : 10.1016/j.brainres.2009.06.073
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, R. Y., Hsu, D. K., et Liu, F. T. (1996). L’expression de la galectine-3 module la croissance et l’apoptose des cellules T. Proc. Natl. Acad. Sci. U.S.A. 93, 6737-6742. doi : 10.1073/pnas.93.13.6737
PubMed Abstract | CrossRef Full Text | Google Scholar
Yip, P. K., Carrillo-Jimenez, A., King, P., Vilalta, A., Nomura, K., Chau, C. C., et al. (2017). La galectine-3 libérée en réponse à une lésion cérébrale traumatique agit comme une alarme orchestrant la réponse immunitaire du cerveau et favorisant la neurodégénération. Sci. Rep. 7:41689.
PubMed Abstract | Google Scholar
Zhao, X., Zhang, Y., Strong, R., Zhang, J., Grotta, J. C., et Aronowski, J. (2007). Distinct patterns of intracerebral hemorrhage-induced alterations in NF-kappaB subunit, iNOS, and COX-2 expression. J. Neurochem. 101, 652-663. doi : 10.1111/j.1471-4159.2006.04414.x
PubMed Abstract | CrossRef Full Text | Google Scholar