- Introduction
- Matériels et méthodes
- Animaux et logement
- Traitement au gaboxadol et calendrier expérimental
- Test en champ libre (OFT)
- Test de couloirs successifs (SAT)
- Test d’exploration lumière-obscurité (LDT)
- Interaction sociale (IS), comportements agressifs
- Stéréotypie
- Self-grooming
- Analyse statistique
- Résultats
- Le gaboxadol normalise l’hyperactivité observée chez les souris Fmr1 KO2
- Les comportements de type anxiété chez les souris Fmr1 KO2 sont normalisés par le gaboxadol
- L’irritabilité et les comportements agressifs chez les souris Fmr1 KO2 sont normalisés par le gaboxadol
- Le gaboxadol normalise les comportements répétitifs chez les souris Fmr1 KO2
- Discussion
- Déclaration éthique
- Contributions des auteurs
- Funding
- Déclaration de conflit d’intérêts
Introduction
Le syndrome du X fragile (SXF) est la forme héréditaire la plus courante de déficience intellectuelle et d’autisme avec une fréquence estimée à 1:4 000-5 000, touchant tous les groupes ethniques dans le monde entier (Gross et al., 2015). Les personnes atteintes du SXF présentent un risque accru pour une série de problèmes comportementaux associés, notamment : des problèmes d’attention, de l’hyperactivité, de l’anxiété et de nombreuses caractéristiques associées à l’autisme, y compris les stéréotypies motrices, l’évitement social, le comportement d’automutilation et l’agression (Hagerman et al., 2010). En outre, les personnes atteintes du SXF sont sujettes à des problèmes médicaux comorbides, notamment des crises, des troubles du sommeil, des difficultés gastro-intestinales et des problèmes de tissu conjonctif. Des interventions comportementales et une gestion pharmacologique des symptômes discrets sont proposées aux personnes atteintes du SXF, mais il n’existe actuellement aucune thérapie approuvée par la FDA pour traiter le syndrome dans son ensemble.
Le SXF résulte de mutations dans le gène FMR1 qui bloquent l’expression de la protéine de retard mental du X fragile (FMRP). La FMRP est une protéine de liaison à l’ARNm exprimée de manière ubiquitaire, nécessaire au transport et à la traduction de 4 à 8 % des protéines synaptiques, et régule ainsi une variété de fonctions synaptiques (Bassell et Warren, 2008). Le rôle de la FMRP dans le SXF et l’évaluation des thérapies candidates ont été étudiés en grande partie grâce à l’utilisation d’un modèle de souris knockout (KO) Fmr1 d’abord caractérisé par le Consortium néerlandais-belge sur le X fragile (Bakker et al., 1994). Le modèle Fmr1 KO a été généré par une insertion ciblée d’une cassette de néomycine dans l’exon 5 du gène FMR1, ce qui a donné une souris présentant des niveaux indétectables de protéine FMRP et de faibles niveaux d’ARNm Fmr1 résiduel (Bakker et al., 1994). La souris Fmr1 KO2 cible un nouvel allèle nul de Fmr1 généré par la délétion du promoteur et du premier exon de Fmr1 (Mientjes et al., 2006). Elle est nulle à la fois pour la protéine et l’ARNm. Ce modèle a été largement utilisé pour les tests médicamenteux (Deacon et al., 2015 ; Cheng et al., 2017 ; Gaudissard et al., 2017 ; Dahlhaus, 2018 ; Leboucher et al., 2019 ; Tranfaglia et al., 2019), et la batterie de tests comportementaux a été largement axée sur l’hyperactivité, la sensibilité accrue aux stimuli auditifs, la stéréotypie et les déficits d’apprentissage et de mémoire (Olmos-Serrano et al., 2011). Au niveau des cellules et des circuits, les études sur les souris SXF se sont largement concentrées sur la signalisation des récepteurs métabotropiques du glutamate 5 (mGluR5) hyperactifs (Dölen et al., 2007), la synthèse accrue des protéines (Osterweil et al…, 2010), et une potentialisation à long terme (LTP ; Auerbach et Bear, 2010).
Une hypothèse ergique de l’acide γ-aminobutyrique (GABA) du SXF a également émergé sur la base d’observations de personnes atteintes du SXF et de souris dépourvues d’une copie active du gène Fmr1. Le GABA est le principal neurotransmetteur inhibiteur du cerveau et émet des signaux post-synaptiques par le biais de récepteurs ionotropes rapides (GABAA) ou de récepteurs métabotropes lents (GABAB). Au sein de la population des récepteurs GABAA, une distinction supplémentaire est établie entre les récepteurs synaptiques et extrasynaptiques qui médient l’inhibition phasique et tonique, respectivement (Olmos-Serrano et al., 2010 ; Meera et al., 2011). En appui à l’hypothèse GABAergique, les personnes atteintes du SXF montrent une disponibilité réduite des récepteurs GABAA (D’Hulst et al., 2015). Les études moléculaires ont montré des diminutions de la machinerie GABAergique, y compris des altérations dans les sous-unités des récepteurs GABA, le transporteur GABA (Rotschafer et al., 2015), et l’acide glutamique décarboxylase (GAD ; D’Hulst et Kooy, 2007 ; Olmos-Serrano et al., 2010). Plus spécifiquement, il a été rapporté que les niveaux d’ARNm du gène codant pour la sous-unité delta des récepteurs GABAA – spécifique à la population extrasynaptique des récepteurs – étaient réduits (Gantois et al., 2006). En termes de fonction GABAergique, la libération de GABA synaptique a été réduite et l’inhibition phasique et tonique diminuée dans l’amygdale (Olmos-Serrano et al., 2010).
En ce qui concerne le comportement, l’hyperactivité, le sursaut auditif, l’apprentissage et la mémoire observés chez les souris FX ont été corrélés à la perte du tonus inhibiteur des entrées GABAergiques dans le cervelet et l’amygdale (Olmos-Serrano et al, 2010), deux régions du cerveau également liées au SXF humain (Lightbody et Reiss, 2009 ; Hall et al, 2013).
De manière plus critique, la potentialisation sélective des récepteurs GABAA extrasynaptiques contenant la sous-unité delta (dSEGA) avec le gaboxadol, également connu sous le nom d’OV101 et de 4,5,6,7-tétrahydroisoxazolo(5,4-c)pyridin-3-ol (THIP), a normalisé l’hyperactivité aberrante et les réponses de sursaut auditif chez les souris Fmr1 KO (Olmos-Serrano et al., 2010). De manière importante, ces résultats ont été observés à des expositions équivalentes à celles auxquelles le gaboxadol est bien toléré chez l’homme (Meera et al., 2011).
Parce que les premiers essais cliniques n’ont pas encore montré de bénéfice thérapeutique des inhibiteurs du mGluR5 (Scharf et al., 2015), dans la présente étude, nous avons cherché à explorer des approches qui pourraient informer plus directement un plan clinique, y compris des aspects plus larges du phénotype du SXF non rapportés précédemment. Plus précisément, nous avons étudié ici les effets de diverses doses de gaboxadol sur l’hyperactivité, l’anxiété, l’agression et les comportements répétitifs dans le modèle Fmr1 KO2 du SXF, démontrant le potentiel d’efficacité du gaboxadol pour traiter ces symptômes du SXF.
Matériels et méthodes
Animaux et logement
Les souris Fmr1 KO2, générées précédemment par la délétion du promoteur et du premier exon de Fmr1 résultant en des souris nulles en ARNm et en protéines (Mientjes et al, 2006), ont été utilisées pour toutes les expériences. Les souris Fmr1 floxées ont été accouplées à des souris exprimant une Cre-recombinase précoce exprimée de manière ubiquitaire, ce qui a entraîné l’élimination de Fmr1 de toutes les cellules. Les souris KO ont été rétrocroisées pendant au moins huit générations avec des C57BL/6J, et des compagnons de portée de type sauvage (WT) ont été utilisés comme témoins. Dix souris (mâles, âgées de 2 mois) ont été utilisées pour chaque groupe de traitement dans toutes les expériences comportementales. Des couples reproducteurs hétérozygotes ont été utilisés pour générer des compagnons de portée WT et KO pour toutes les études. Les mâles ont été retirés des cages d’élevage après la naissance, les femelles ont été éliminées des portées et le génotypage a été effectué à l’aide du système de génotypage automatisé TransnetXY (Transnetyx, Inc., Cordova, TN, USA) en utilisant les amorces et le protocole établis. Les souris de la même cage ont reçu la même dose de gaboxadol ou de véhicule, et les mutants et les témoins ont été logés séparément. Toutes les souris ont été logées en groupe dans des cages en plastique (35 × 30 × 12 cm), à raison de cinq par cage, et habituées à l’animalerie pendant au moins une semaine avant les tests. La température de la pièce (21 ± 2 °C), l’humidité relative (55 ± 5 %), un cycle lumière-obscurité de 12 heures (lumières allumées de 7 h à 19 h) et le renouvellement de l’air (16 fois par heure) étaient contrôlés automatiquement. Toutes les souris avaient un accès ad libitum à la nourriture et à l’eau. Tous les tests ont été effectués en phase de lumière par un investigateur aveugle au génotype et au traitement médicamenteux. Le logement et les expériences ont eu lieu à GeN DDI Limited (Londres, Royaume-Uni) conformément aux exigences de la loi britannique sur les animaux (procédures scientifiques) de 1986.
Traitement au gaboxadol et calendrier expérimental
Les souris Fmr1 KO2 ont été injectées avec le véhicule (0.9% de solution saline stérile) ou du gaboxadol (0,5, 1, 1,5, 2, 3, 4 ou 5 mg/kg, i.p.) 30 min avant les tests comportementaux de chaque jour de test, avec un intervalle de trois jours entre chaque test pour éviter tout effet cumulatif de l’administration du médicament. Des souris de type sauvage ayant reçu une injection de véhicule au même moment ont également été incluses dans toutes les expériences. Le dépistage comportemental des souris (n = 10 par groupe) a été effectué dans l’ordre suivant, avec un intervalle de 2 à 3 jours entre chaque test : Test en champ libre (OFT ; jour 1), allées successives (jour 4), boîte claire/obscure (jour 7), tests sociaux et agressivité (jour 10), et auto-toilettage et stéréotypie (jour 12).
Test en champ libre (OFT)
Le jour 1 du test, l’OFT a été réalisé dans une chambre à moniteur d’activité VersaMax (AccuScan Instruments, Columbus, OH, USA). L’activité locomotrice a été enregistrée pendant 30 minutes dans une grande chambre en plexiglas (40 × 40 cm) éclairée à 40 lux. L’activité a été surveillée par des pauses du faisceau infrarouge qui ont été combinées en tranches de 1 min et décodées à l’aide du logiciel VersaDat (AccuScan Instruments, Columbus, OH, USA) pour déterminer la distance parcourue (cm), la distance centrale parcourue (cm), les révolutions dans le sens des aiguilles d’une montre et dans le sens inverse (d’au moins 5.08 cm de diamètre), et les ruptures de faisceau répétitives.
Test de couloirs successifs (SAT)
Au jour 4 du test, les souris ont été soumises au test de couloirs successifs (SAT). Le SAT présente un avantage par rapport au labyrinthe plus élevé car il met entre parenthèses une plus large gamme de niveaux d’anxiété (Deacon, 2013). La chambre de test consistait en quatre couloirs successifs, disposés linéairement et de plus en plus anxiogènes (couleur plus claire, murs plus bas, plus étroits), qui mesuraient 25 cm de long et 50 cm de haut par rapport au sol. Les souris ont été observées pendant une période de 5 minutes sous une lumière rouge de 60 W placée au-dessus de l’appareil. Le nombre d’entrées dans chaque allée a été enregistré.
Test d’exploration lumière-obscurité (LDT)
Au jour 7 du test, les souris ont subi le test d’exploration lumière-obscurité (LDT). Le LDT est largement utilisé pour mesurer le comportement anxieux chez les souris en fonction de leur peur innée des espaces ouverts et lumineux (Prut et Belzung, 2003). La chambre d’essai en polypropylène (44 × 21 × 21 cm) a été divisée en un compartiment plus petit, sombre et couvert (14 cm) et un compartiment plus grand, lumineux et ouvert (28 cm) par une cloison sombre avec une petite ouverture (13 × 5 cm). Les transitions entre les compartiments étaient enregistrées par des cellules photoélectriques situées dans l’ouverture de la cloison. Chaque souris a été placée dans le côté lumineux tourné à l’opposé de la cloison, autorisée à explorer librement la chambre pendant 10 min, et les transitions entre les chambres ont été enregistrées.
Au jour 10 des tests, l’interaction sociale (IS) et les tests d’agression ont été effectués dans une cage de taille similaire à la cage d’origine (40 × 23 × 12 cm) avec un couvercle en Perspex pour faciliter la visualisation des souris. Les souris ont été habituées à la salle de test pendant 25 minutes. Deux sujets, une souris expérimentale et une souris « test » de type sauvage, ont ensuite été placés simultanément dans la cage de test. La durée totale et le nombre d’investigations sociales, le cliquetis de la queue, le nombre de morsures et le nombre de montages ont été enregistrés depuis le haut et mesurés pendant 3 min.
Stéréotypie
Au jour 12 du test, les taux de stéréotypie spontanée (mouvements de la tête) ont été évalués à l’aide d’un appareil photoélectrique automatisé modifié (Columbus Instruments, Columbus, OH, USA). Le protocole de test consistait à retirer les souris de leur cage d’origine et à les placer individuellement dans des cages de test en plexiglas (22 × 25 × 28 cm). Les souris n’ont pas été dérangées pendant 2 minutes pour s’habituer à la chambre de test. Ensuite, chaque souris a été surveillée pendant 3 minutes afin de générer un score de stéréotypie qui correspond à la fréquence moyenne des stéréotypies par heure. De la nourriture et de l’eau ont été fournies tout au long de la période de test. Le compte de stéréotypies est une quantification du nombre de fois qu’une souris interfère avec le même faisceau infrarouge dans un accès d’activité stéréotypique, tel que mesuré par l’appareil de test.
Self-grooming
Aussi le jour 12 du test, l’autogrooming a été surveillé. Chaque souris a été placée individuellement dans une cage à souris standard (46 × 23,5 × 20 cm) éclairée à 40-lux. Après une période d’accoutumance de 5 min dans la cage de test, le temps cumulé consacré au toilettage de n’importe quelle région du corps a été enregistré pendant 3 min afin de déterminer le temps cumulé (en secondes) de toilettage de n’importe quelle région du corps.
Analyse statistique
Puisque les souris Fmr1 KO2 ont été traitées avec du gaboxadol ou un véhicule, mais que les souris WT n’ont été traitées qu’avec un véhicule, les données paramétriques ont été analysées à l’aide d’une analyse de variance à sens unique (ANOVA) et du test post hoc de Tukey. Toutes les données ont été analysées à l’aide de GraphPad Prism v7.0 (GraphPad Software, San Diego, CA, USA). La signification statistique a été fixée à P < 0,05.
Résultats
Le gaboxadol normalise l’hyperactivité observée chez les souris Fmr1 KO2
L’hyperactivité est une caractéristique saillante du SXF humain (Bailey et al, 2008 ; Wheeler et al., 2014 ; Hagerman et al., 2017) et a été reproduite de manière fiable chez la souris Fmr1 KO néerlandaise-belge précédemment caractérisée (Olmos-Serrano et al., 2010 ; Kazdoba et al., 2014). Pour vérifier si les souris Fmr1 KO2 présentaient une hyperactivité locomotrice et si le gaboxadol pouvait normaliser ce comportement aberrant, les souris Fmr1 KO2 ont reçu une injection de véhicule ou de gaboxadol (0,5 à 5 mg/kg, par voie i.p.), et leurs congénères WT ont reçu une injection de véhicule 30 minutes avant le test dans l’OFT. La distance totale parcourue (cm) dans l’OFT a été enregistrée pendant 30 minutes. Les résultats ont montré que la distance parcourue par les souris Fmr1 KO2 était significativement plus élevée par rapport aux témoins de la portée WT (Figure 1, F(8,81) = 21,27, p < 0,0001), ce qui est cohérent avec les résultats d’autres modèles de SXF. Le traitement au gaboxadol (0,5 mg/kg) a normalisé la distance parcourue par les souris Fmr1 KO2 à des niveaux d’activité WT (Figure 1). Des doses plus élevées de gaboxadol (1-5 mg/kg, i.p.) n’ont eu aucun effet sur l’activité locomotrice des souris Fmr1 KO2 (Figure 1). Ces résultats ne sont pas attribuables aux effets sédatifs du gaboxadol, car chez les souris WT C57Bl/6 ou BALB/c, des doses de gaboxadol allant jusqu’à 2,0 mg/kg, i.p. n’ont aucun effet sur l’activité locomotrice lors d’un OFT de 60 min (données non présentées), ce qui est cohérent avec des travaux antérieurs montrant l’absence d’effet du gaboxadol sur la locomotion chez les souris WT (Olmos-Serrano et al, 2011) ou des rats (Silverman et al., 2016).
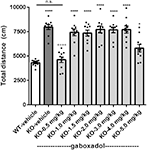
Figure 1. Le gaboxadol normalise l’hyperactivité chez les souris Fmr1 KO2. Distance totale parcourue pendant 30 min pour des souris de type sauvage-camarades de lit (WT) traitées avec un véhicule (barre blanche), des souris Fmr1 KO2 traitées avec un véhicule (knockout, KO barre gris foncé) et des souris Fmr1 KO2 traitées avec du gaboxadol (KO-0,5-5,0 mg/kg, barres gris clair). Les barres sont des moyennes ± SEM, les points sont des données brutes provenant de souris individuelles. *p < 0,05, ****p < 0,0001 vs. groupe WT-véhicule ; ns, non significatif vs. groupe WT-véhicule ; ++++p < 0,0001 vs. groupe Fmr1 KO2-véhicule. N = 10 par groupe.
Les comportements de type anxiété chez les souris Fmr1 KO2 sont normalisés par le gaboxadol
Pour évaluer l’effet du gaboxadol sur les comportements de type anxiété chez les souris Fmr1 KO2, trois tests comportementaux différents ont été employés : distance parcourue au centre dans l’OFT, le LDT et le SAT. L’augmentation de la distance parcourue au centre est interprétée comme une diminution de l’anxiété et tire parti de la préférence inhérente des souris à rester dans le périmètre lorsqu’elles sont introduites dans un nouvel environnement. Les souris Fmr1 KO2 ont reçu une injection de gaboxadol (0,5-5 mg/kg, i.p.), et les souris WT ont reçu une injection de véhicule 30 minutes avant d’être placées dans l’OFT pendant 30 minutes. La distance totale parcourue au centre était significativement plus élevée chez les souris Fmr1 KO2 que chez les témoins WT (Figure 2A, F(8,81) = 21,32, p < 0,0001). Le traitement au gaboxadol (0,5 mg/kg, i.p.) a normalisé l’effet de Fmr1 KO2 sur la distance centrale parcourue à des niveaux comparables à ceux des témoins WT (figure 2A). Des doses plus élevées de gaboxadol (1-5 mg/kg) n’ont eu aucun effet sur les souris Fmr1 KO2 dans ce test (Figure 2A).
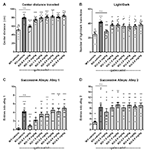
Figure 2. Le gaboxadol normalise les comportements liés à l’anxiété chez les souris Fmr1 KO2. Des souris WT traitées avec un véhicule (barre blanche), des souris Fmr1 KO2 traitées avec un véhicule (KO, barre gris foncé) ou des souris Fmr1 KO2 traitées avec du gaboxadol (KO-0,5-5,0 mg/kg, barres gris clair) ont été soumises au test du champ ouvert (OFT), au test d’exploration lumière/obscurité (LDT) et au test des allées successives (SAT). (A) Distance totale parcourue au centre de l’OFT. (B) Le nombre de transitions entre les compartiments lumineux et sombres dans le LDT. (C) Le nombre d’entrées dans le couloir 1 pendant le SAT. (D) Le nombre d’entrées dans le couloir 2 pendant le SAT. Les barres sont des moyennes ± SEM, les points sont des données brutes de souris individuelles. ****p < 0,0001, ***p < 0,001, **p < 0,01, *p < 0,05 vs. groupe véhicule WT ; ns, non significatif vs. groupe véhicule WT ; ++++p < 0,0001, +++p < 0,001, ++p < 0,01 vs. groupe véhicule Fmr1 KO2. N = 10 par groupe.
Puis, le LDT, qui tire parti de la préférence naturelle des souris pour les environnements sombres et protégés, a été utilisé comme autre test comportemental de l’anxiété. La volonté d’explorer le compartiment lumineux de la chambre, mesurée par le nombre de transitions entre les compartiments, est interprétée comme un comportement anxiolytique et est sensible au traitement par des agents anxiolytiques (Bourin et Hascoët, 2003). Les souris Fmr1 KO2 ont montré un nombre significativement plus élevé de transitions entre les compartiments dans le LDT par rapport aux souris WT (Figure 2B, F(8,81) = 5,819, p < 0,0001). Le gaboxadol (0,5 mg/kg, i.p.) a normalisé le phénotype comportemental des souris Fmr1 KO2 aux niveaux WT (figure 2B). Des doses plus élevées de gaboxadol n’ont eu aucun effet sur les transitions lumière/obscurité des souris Fmr1 KO2 (Figure 2B).
Enfin, les résultats du SAT ont renforcé le fait que le phénotype lié à l’anxiété observé chez les souris Fmr1 KO2 pouvait être normalisé par le traitement au gaboxadol. Ce test est utilisé comme une variante plus sensible du labyrinthe Plus élevé, et comprend quatre allées linéaires, successives et de plus en plus anxiogènes (Deacon, 2013). Le nombre d’entrées dans les allées 2 à 4 évalue le comportement anxieux (Deacon, 2013), tandis que l’augmentation des entrées dans l’allée 1 correspond à une hyperactivité générale (Deacon, 2013). Il est important de noter que des travaux antérieurs ont montré que l’hyperactivité locomotrice ne conduit pas à des résultats faussement positifs dans ce test (revu dans Deacon, 2013). Les souris Fmr1 KO2 ont présenté un nombre accru d’entrées dans le couloir 1 (figure 2C, F(8,81) = 11,50, p < 0,0001), ce qui est cohérent avec une activité locomotrice accrue et le phénotype d’hyperactivité présenté dans la figure 1. Les souris Fmr1 KO2 ont également montré un nombre significativement plus élevé d’entrées dans l’allée 2 par rapport aux contrôles WT (Figure 2D, F(8,81) = 4,925, p < 0,0001), soutenant un phénotype lié à l’anxiété. L’injection de gaboxadol (0,5 mg/kg) à des souris Fmr1 KO2 30 minutes avant le test a normalisé les entrées dans les couloirs 1 et 2 aux niveaux des témoins WT (figures 2C,D). Des doses plus élevées de gaboxadol n’ont eu aucun effet sur les souris Fmr1 KO2 dans le SAT (figures 2C,D). Les entrées dans les couloirs 3 et 4 étaient significativement augmentées chez les souris Fmr1 KO2 par rapport aux contrôles WT, mais aucun avantage évident du gaboxadol n’a été observé avec n’importe quelle dose testée (non montré).
L’irritabilité et les comportements agressifs chez les souris Fmr1 KO2 sont normalisés par le gaboxadol
Comme pour d’autres formes d’autisme syndromique, une grande proportion d’individus atteints du SXF présentent une irritabilité, une anxiété sociale et une agressivité. Ces comportements aberrants peuvent être modélisés chez les rongeurs par la caractérisation des SI entre une souris test et un nouveau compagnon de cage. Pour tester l’hypothèse selon laquelle l’irritabilité et l’agressivité sont accrues chez les mutants Fmr1 KO2, nous avons quantifié les cas de cliquetis de la queue, de comportement de morsure, de comportement de montage et de latence à l’attaque. Les souris ont reçu une injection de véhicule ou de gaboxadol (0,5-5 mg/kg, i.p.) 30 minutes avant d’être placées dans la cage de test.
Le cliquetis de la queue, ou vibrations rapides de la queue, reflète l’agressivité et la tendance au combat. Les souris Fmr1 KO2 ont montré une fréquence de cliquetis de la queue significativement accrue par rapport aux témoins WT (figure 3A, F(8,81) = 16,03, p < 0,0001). Le gaboxadol (0,5, 1,5 et 5,0 mg/kg) a normalisé cet effet chez les souris Fmr1 KO2 à des niveaux comparables aux témoins WT (figure 3A).
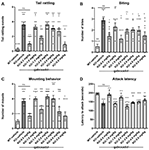
Figure 3. Le gaboxadol normalise les comportements d’irritabilité et d’agression chez les souris Fmr1 KO2. Le cliquetis de la queue (A), le comportement de morsure (B), le comportement de montage (C) et la latence pour attaquer un nouveau compagnon de cage (D) ont été mesurés chez des souris WT traitées avec un véhicule (barre blanche), des souris Fmr1 KO2 traitées avec un véhicule (KO, barre gris foncé) ou des souris Fmr1 KO2 traitées avec du gaboxadol (KO-0,5-5,0 mg/kg, barres gris clair). Les barres sont des moyennes ± SEM, les points sont des données brutes de souris individuelles. ****p < 0,0001,***p < 0,001,**p < 0,01, *p < 0,05 vs groupe véhicule WT ; ns, non significatif vs groupe véhicule WT ; ++++p < 0,0001, +++p < 0,001, ++p < 0,01, +p < 0,05 vs groupe véhicule Fmr1 KO2. N = 10 par groupe.
Comme le cliquetis de la queue, la morsure est une mesure de l’agressivité chez les souris. Les souris Fmr1 KO2 ont montré un nombre significativement accru de morsures par rapport aux contrôles WT (Figure 3B, F(8,81) = 5,446, p < 0,0001). Le gaboxadol (0,5, 1,5 et 5,0 mg/kg) a diminué de manière significative le nombre de morsures effectuées par les souris Fmr1 KO2 (figure 3B). Cependant, à certaines des doses testées (1,0, 3,0 et 4,0 mg/kg), le comportement de morsure est resté significativement augmenté par rapport aux groupes de véhicules WT et n’a pas été significativement modifié par rapport aux contrôles de véhicules KO (Figure 3B).
Chez les souris mâles, le comportement de montage est une affirmation agressive de la dominance sociale. Les souris Fmr1 KO2 ont montré un nombre significativement accru de montages par rapport aux contrôles WT (Figure 3C, F(8,81) = 9,008, p < 0,001). Le traitement au gaboxadol (0,5, 1,5, 4,0 et 5,0 mg/kg) a significativement diminué le comportement de montage chez les souris Fmr1 KO2, et les effets des doses de 0,5 et 5,0 mg/kg étaient statistiquement significatifs par rapport aux témoins traités par le véhicule KO (figure 3C). Chez les souris Fmr1 KO2 traitées par 1,5 et 4,0 mg/kg de gaboxadol, le comportement de montage n’était pas significativement différent de celui des souris traitées par véhicule WT, ce qui suggère une tendance à un effet à ces doses, même si leur comparaison avec le groupe traité par véhicule KO n’a pas atteint la signification statistique (figure 3C).
Enfin, la latence pour attaquer une souris nouvellement rencontrée a été enregistrée comme autre mesure de l’agressivité. Les souris Fmr1 KO2 ont montré une latence d’attaque significativement réduite par rapport à leurs congénères WT (Figure 3D, F(8,81) = 17,22, p < 0,0001). La latence réduite à l’attaque a été normalisée chez les souris Fmr1 KO2 traitées au gaboxadol (0,5, 1,5 mg/kg ; Figure 3D).
Le gaboxadol normalise les comportements répétitifs chez les souris Fmr1 KO2
La persévération et les comportements répétitifs sont courants chez les personnes atteintes du SXF et sont très perturbateurs (Arron et al., 2011 ; Leekam et al., 2011 ; Hall et al., 2016). Pour tester l’hypothèse selon laquelle de telles caractéristiques pourraient être observées chez les animaux Fmr1 KO2, nous avons quantifié l’encerclement, l’autogestion et la stéréotypie chez les souris WT et mutantes Fmr1 KO2. Les révolutions dans le sens inverse des aiguilles d’une montre (CCW) ont été mesurées dans la chambre d’essai après que les souris aient reçu une injection de véhicule ou de gaboxadol (0,5-5 mg/kg, i.p.). Les souris Fmr1 KO2 ont montré une augmentation significative des révolutions CCW pendant le test de 5 minutes par rapport aux contrôles WT (Figure 4A, F(8,81) = 25,46, p < 0,0001). L’injection de gaboxadol (0,5, 1,0 mg/kg) à des souris Fmr1 KO2 a rétabli le nombre de rotations CCW aux niveaux WT (figure 4A). Il n’y avait pas d’effet du génotype sur les révolutions dans le sens des aiguilles d’une montre (p = 0,386, données non présentées).

Figure 4. Le gaboxadol normalise les comportements répétitifs chez les souris Fmr1 KO2. Des souris WT traitées avec un véhicule (barre blanche), des souris Fmr1 KO2 traitées avec un véhicule (KO, barre gris foncé) ou des souris Fmr1 KO2 traitées avec du gaboxadol (KO-0,5-5,0 mg/kg, barres gris clair) ont été soumises à quatre tests mesurant les comportements répétitifs. (A) Les révolutions dans le sens contraire des aiguilles d’une montre (CCW) ont été mesurées par des ruptures de faisceau infrarouge pendant un test de 5 minutes en champ libre. (B) Après une accoutumance de 5 minutes à la cage de test, le temps passé à se toiletter pendant 3 minutes est indiqué. (C) Le nombre de stéréotypies (mouvements de la tête) pendant une période de test de 3 minutes est indiqué. Les barres sont des moyennes ± SEM, les points sont des données brutes de souris individuelles. ****p < 0,0001 vs groupe véhicule WT ; ns, non significatif vs groupe véhicule WT ; ++++p < 0,0001 vs groupe véhicule Fmr1 KO2. N = 10 par groupe.
Le temps passé à se toiletter était significativement augmenté chez les souris Fmr1 KO2 par rapport aux témoins WT (Figure 4B, F(8,81) = 41,99, p < 0,0001). Chez les souris Fmr1 KO2, l’injection de gaboxadol (0,5 mg/kg) a normalisé le temps passé à se toiletter aux niveaux WT (Figure 4B).
La stéréotypie est définie comme des mouvements répétitifs et ritualisés et est courante dans l’autisme et le SXF. Chez les souris, les activités stéréotypées telles que le balancement de la tête peuvent être mesurées en quantifiant les ruptures de faisceau infrarouge dans la cage d’essai. Le nombre de stéréotypies était significativement augmenté chez les souris Fmr1 KO2 par rapport aux contrôles WT (Figure 4C, F(8,81) = 19,93, p < 0,0001). Les souris Fmr1 KO2 auxquelles on a injecté du gaboxadol (0,5 mg/kg) ont vu leur comportement de stéréotypie normalisé revenir aux niveaux WT (Figure 4C).
Discussion
Les symptômes cliniques du SXF peuvent inclure l’hyperactivité, l’anxiété, les déficiences de mémoire et d’apprentissage, les anomalies sociales, l’agression et les comportements répétitifs. Dans tous les cas, le traitement avec 0,5 mg/kg de gaboxadol a rétabli le comportement des souris Fmr1 KO2 aux niveaux WT (résumé dans la Figure 5). Ces données apportent un soutien supplémentaire à l’augmentation de l’activité de la dSEGA et de l’inhibition tonique par le gaboxadol en tant que stratégie thérapeutique qui justifie une étude plus approfondie chez les personnes atteintes du SXF.

Figure 5. Effets comportementaux globaux du gaboxadol chez les souris Fmr1 KO2. Résumé des résultats de l’évaluation comportementale des souris Fmr1 KO2 traitées par le véhicule ou le gaboxadol (0,5-5,0 mg/kg) par rapport aux témoins de la portée WT. Les souris Fmr1 KO2 ont présenté des phénotypes significatifs en matière d’activité locomotrice, de comportements liés à l’anxiété, d’irritabilité et d’agressivité, et de comportements répétitifs. Tous ces phénotypes ont été systématiquement normalisés aux niveaux WT par le traitement au gaboxadol à la dose de 0,5 mg/kg. Le comportement « normal » (carrés verts) correspond aux souris WT traitées par véhicule et est statistiquement différent de celui des souris Fmr1 KO2 (KO) traitées par véhicule. Le comportement « anormal » (carrés rouges) correspond à celui des souris Fmr1 KO2 (KO) traitées par véhicule et est statistiquement différent de celui des souris WT traitées par véhicule. Les carrés jaunes indiquent une différence qui n’est pas significativement différente des souris WT ou statistiquement différente des souris Fmr1 KO2 (KO) traitées par véhicule.
L’hyperactivité locomotrice est une caractéristique du SXF humain (Bailey et al., 2008 ; Wheeler et al., 2014 ; Hagerman et al., 2017). Dans l’étude actuelle, les souris Fmr1 KO2 ont montré une activité locomotrice accrue qui a été normalisée par le gaboxadol. Des travaux antérieurs sur les souris Fmr1 KO néerlando-belges ont également montré un phénotype d’hyperactivité cohérent qui a été inversé par le traitement au gaboxadol, mais à une dose plus élevée (Olmos-Serrano et al., 2011). Cette différence peut s’expliquer par une régulation différentielle de l’ARNm de Gabrd (D’Hulst et al., 2006 ; Curia et al., 2009), une modification de l’expression de surface des récepteurs GABA extrasynaptiques (Zhang et al., 2017), des effets sur la structure du cerveau (Lai et al., 2016) ou des différences dans les manifestations comportementales de la mutation (Pietropaolo et al., 2011 ; Spencer et al., 2011). Chacune de ces différences pourrait être médiée par le résultat du bagage génétique, car les travaux précédents ont été réalisés avec des souris FVB alors que les animaux étudiés ici étaient des C57BL/6J. Des différences subtiles dans l’équipement de laboratoire, la manipulation des animaux et même les conditions de logement, qui sont des modificateurs bien établis du comportement des souris, peuvent également contribuer (Crabbe et al., 1999 ; Wahlsten et al., 2006).
Les résultats de trois tests d’anxiété, distance centrale dans l’OFT, boîte claire/obscure et SAT, démontrent un phénotype robuste chez la souris Fmr1 KO2 qui est inversé par le traitement au gaboxadol. Il convient de noter que l’hyperactivité pourrait fausser les résultats de l’OFT et de la boîte à lumière/obscurité. Cependant, le comportement lié à l’anxiété observé dans le SAT se produit indépendamment des changements de l’activité locomotrice (examiné dans Deacon, 2013) ; et bien que l’effet de l’anxiété dans le KO soit dans la direction opposée de ce qui est observé chez les patients atteints du SXF (Bailey et al., 2008), nos résultats sont cohérents avec les rapports précédents décrivant le phénotype de la souris SXF (examiné par Kazdoba et al., 2014). Néanmoins, il sera important que les études futures visent à élucider davantage l’effet de l’anxiété chez ces souris. Malgré cela, et surtout, nos données démontrent que le gaboxadol normalise le comportement anxieux aberrant observé dans le modèle de souris FXS ainsi que dans tous les autres comportements évalués dans nos analyses.
L’irritabilité et les comportements agressifs, modélisés par la mesure des IS avec un nouveau compagnon de cage, étaient également augmentés chez les souris Fmr1 KO2 et inversés par le gaboxadol. Une étude récente a rapporté que presque tous (>90%) les hommes et les femmes atteints du SXF interrogés ont eu des comportements agressifs au cours des 12 mois précédents. Parmi eux, 33 % des mâles et 20 % des femelles ont montré une agressivité sévère, suffisante pour causer des blessures aux soignants (Wheeler et al., 2016). L’automutilation et les comportements impulsifs sont également plus fréquents chez les personnes atteintes du SXF (Arron et al., 2011).
Les comportements répétitifs et la stéréotypie étaient constamment augmentés chez les souris Fmr1 KO2 et atténués par le traitement au gaboxadol. Les comportements répétitifs peuvent causer de graves problèmes pour le fonctionnement quotidien et peuvent devenir un obstacle à l’apprentissage et à l’IS (Leekam et al., 2011). Les paradigmes qui évaluent les comportements stéréotypés et les déficits socio-émotionnels pourraient donc être utiles pour évaluer l’efficacité de nouveaux médicaments pour améliorer les phénotypes autistiques dans le SXF.
Le gaboxadol a normalisé tous les déficits comportementaux testés des souris Fmr1 KO2 à une dose de 0,5 mg/kg. Si des doses plus élevées ont également normalisé l’irritabilité et les comportements agressifs, cela n’a pas été observé pour les autres domaines comportementaux évalués. Une explication de la fenêtre d’efficacité quelque peu étroite observée ici peut provenir de travaux antérieurs montrant que le traitement de l’information est compromis par une inhibition tonique insuffisante ou excessive, le processus physiologique que le gaboxadol potentialise. Selon ce modèle, le bénéfice comportemental du médicament à des doses élevées serait compensé par des déficits indépendants du SXF introduits pharmacologiquement (Duguid et al., 2012).
Nos résultats fournissent des preuves solides de l’avantage potentiel du gaboxadol dans l’inversion des comportements liés aux TSA, l’agressivité et la sociabilité. Pris ensemble, ces résultats soutiennent l’hypothèse que la potentialisation des récepteurs GABAA extrasynaptiques par le gaboxadol pourrait être bénéfique chez les personnes atteintes du SXF. En conclusion, ces données soutiennent l’évaluation future du gaboxadol chez les individus atteints du SXF, particulièrement en ce qui concerne les symptômes d’hyperactivité, d’anxiété, de stéréotypie liée au TSA, de sociabilité, d’irritabilité, d’agression et de cognition.
Déclaration éthique
Toutes les expériences ont été réalisées sous l’approbation du comité éthique de l’Institut d’écologie et de biodiversité, Université du Chili, Santiago, Chili.
Contributions des auteurs
BA et MD ont initié ce travail et ont travaillé avec PC et RD pour développer un plan expérimental. PC et RD ont rédigé un rapport technique résumant les résultats, que JW-S a utilisé pour produire un manuscrit prêt à être publié. MvS, comme les autres auteurs, a contribué à l’interprétation des résultats. Tous les auteurs ont fourni des commentaires sur le manuscrit avant sa soumission.
Funding
Cette étude a été sponsorisée et payée en totalité par Ovid Therapeutics Inc, New York, NY, USA.
Déclaration de conflit d’intérêts
PC et RD sont fondateur/CEO et CSO de Gen. DDI Limited, qui a été contracté par Ovid Therapeutics pour effectuer le travail expérimental décrit ici. PC et RD sont actuellement chef et membre de l’équipe de FRAXA-DVI. JW-S, par l’intermédiaire de NeuroJenic Consulting, LLC, a été engagé pour rédiger ce manuscrit en vue de sa publication. MvS, BA et MD sont des employés à temps plein chez Ovid Therapeutics et détiennent également des actions ou des options sur actions.
Arron, K., Oliver, C., Moss, J., Berg, K. et Burbidge, C. (2011). La prévalence et la phénoménologie des comportements d’automutilation et d’agressivité dans les syndromes génétiques. J. Intellect. Disabil. Res. 55, 109-120. doi : 10.1111/j.1365-2788.2010.01337.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Auerbach, B. D., et Bear, M. F. (2010). La perte de la protéine de retard mental fragile X découple l’amorçage de la potentialisation à long terme dépendant du récepteur de glutamate métabotropique de la synthèse des protéines. J. Neurophysiol. 104, 1047-1051. doi : 10.1152/jn.00449.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Bailey, D. B. Jr., Raspa, M., Olmsted, M., et Holiday, D. B. (2008). Conditions co-occurrentes associées aux variations du gène FMR1 : résultats d’une enquête nationale auprès des parents. Am. J. Med. Genet. A 146A, 2060-2069. doi : 10.1002/ajmg.a.32439
PubMed Abstract | CrossRef Full Text | Google Scholar
Bassell, G. J., and Warren, S. T. (2008). Syndrome du X fragile : la perte de la régulation locale de l’ARNm altère le développement et la fonction synaptiques. Neuron 60, 201-214. doi : 10.1016/j.neuron.2008.10.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Bourin, M., et Hascoët, M. (2003). Le test de la boîte à lumière/obscurité chez la souris. Eur. J. Pharmacol. 463, 55-65. doi : 10.1016/s0014-2999(03)01274-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Cheng, G. R., Li, X. Y., Xiang, Y. D., Liu, D., McClintock, S. M., and Zeng, Y. (2017). L’implication du récepteur AMPA dans l’altération de la plasticité synaptique et la déficience intellectuelle dans le syndrome du X fragile. Physiol. Res. 66, 715-727.
PubMed Abstract | Google Scholar
Crabbe, J. C., Wahlsten, D., et Dudek, B. C. (1999). Génétique du comportement de la souris : interactions avec l’environnement du laboratoire. Science 284, 1670-1672. doi : 10.1126/science.284.5420.1670
PubMed Abstract | CrossRef Full Text | Google Scholar
Curia, G., Papouin, T., Séguéla, P., et Avoli, M. (2009). Downregulation de l’inhibition tonique GABAergique dans un modèle murin du syndrome de l’X fragile. Cereb. Cortex 19, 1515-1520. doi : 10.1093/cercor/bhn159
PubMed Abstract | CrossRef Full Text | Google Scholar
Dahlhaus, R. (2018). Des hommes et des souris : modélisation du syndrome de l’X fragile. Front. Mol. Neurosci. 11:41. doi : 10.3389/fnmol.2018.00041
PubMed Abstract | CrossRef Full Text | Google Scholar
Deacon, R. M. (2013). Le test des allées successives de l’anxiété chez les souris et les rats. J. Vis. Exp. 76:e2705. doi : 10.3791/2705
PubMed Abstract | CrossRef Full Text | Google Scholar
Deacon, R. M., Glass, L., Snape, M., Hurley, M. J., Altimiras, F. J., Biekofsky, R. R., et al. (2015). NNZ-2566, un nouvel analogue de (1-3) IGF-1, comme agent thérapeutique potentiel pour le syndrome du X fragile. Neuromolecular Med. 17, 71-82. doi : 10.1007/s12017-015-8341-2
PubMed Abstract | CrossRef Full Text | Google Scholar
D’Hulst, C., De Geest, N., Reeve, S. P., Van Dam, D., De De Deyn, P. P., Hassan, B. A., et al. (2006). Decreased expression of the GABAA receptor in fragile X syndrome. Brain Res. 1121, 238-245. doi : 10.1016/j.brainres.2006.08.115
PubMed Abstract | CrossRef Full Text | Google Scholar
D’Hulst, C., Heulens, I., Van der Aa, N., Goffin, K., Koole, M., Porke, K., et al. (2015). Quantification par tomographie par émission de positons (TEP) des récepteurs GABAA dans le cerveau des patients X fragiles. PLoS One 10:e0131486. doi : 10.1371/journal.pone.0131486
PubMed Abstract | CrossRef Full Text | Google Scholar
D’Hulst, C., et Kooy, R. F. (2007). Le récepteur GABAA : une nouvelle cible pour le traitement de l’X fragile ? Trends Neurosci. 30, 425-431. doi : 10.1016/j.tins.2007.06.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Dölen, G., Osterweil, E., Rao, B. S., Smith, G. B., Auerbach, B. D., Chattarji, S., et al. (2007). Correction du syndrome du X fragile chez la souris. Neuron 56, 955-962. doi : 10.1016/j.neuron.2007.12.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Duguid, I., Branco, T., London, M., Chadderton, P., et Hausser, M. (2012). L’inhibition tonique améliore la fidélité de la transmission des informations sensorielles dans le cortex cérébelleux. J. Neurosci. 32, 11132-11143. doi : 10.1523/jneurosci.0460-12.2012
PubMed Abstract | CrossRef Full Text | Google Scholar
Gantois, I., Vandesompele, J., Speleman, F., Reyniers, E., D’Hooge, R., Severijnen, L. A., et al. (2006). Expression profiling suggests underexpression of the GABAA receptor subunit delta in the fragile X knockout mouse model. Neurobiol. Dis. 21, 346-357. doi : 10.1016/j.nbd.2005.07.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Gaudissard, J., Ginger, M., Premoli, M., Memo, M., Frick, A., et Pietropaolo, S. (2017). Anomalies comportementales dans le modèle de souris Fmr1-KO2 du syndrome du X fragile : la pertinence des phases précoces de la vie. Autism Res. 10, 1584-1596. doi : 10.1002/aur.1814
PubMed Abstract | CrossRef Full Text | Google Scholar
Gross, C., Hoffmann, A., Bassell, G. J., et Berry-Kravis, E. M. (2015). Stratégies thérapeutiques dans le syndrome du X fragile : du banc au chevet et retour. Neurotherapeutics 12, 584-608. doi : 10.1007/s13311-015-0355-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Hagerman, R. J., Berry-Kravis, E., Hazlett, H. C., Bailey, D. B. Jr., Moine, H., Kooy, R. F., et al. (2017). Fragile X syndrome. Nat. Rev. Dis. Primers 3:17065. doi : 10.1038/nrdp.2017.65
PubMed Abstract | CrossRef Full Text | Google Scholar
Hagerman, R., Hoem, G., et Hagerman, P. (2010). X fragile et autisme : entrelacés au niveau moléculaire menant à des traitements ciblés. Mol. Autism 1:12. doi : 10.1186/2040-2392-1-12
PubMed Abstract | CrossRef Full Text | Google Scholar
Hall, S. S., Barnett, R. P., et Hustyi, K. M. (2016). Comportement problématique chez les garçons adolescents atteints du syndrome de l’X fragile : prévalence relative, fréquence et sévérité. J. Intellect. Disabil. Res. 60, 1189-1199. doi : 10.1111/jir.12341
PubMed Abstract | CrossRef Full Text | Google Scholar
Hall, S. S., Jiang, H., Reiss, A. L., et Greicius, M. D. (2013). Identification des réseaux cérébraux à grande échelle dans le syndrome du X fragile. JAMA Psychiatry 70, 1215-1223. doi : 10.1001/jamapsychiatry.2013.247
PubMed Abstract | CrossRef Full Text | Google Scholar
Kazdoba, T. M., Leach, P. T., Silverman, J. L., et Crawley, J. N. (2014). Modélisation du syndrome du X fragile chez la souris knockout Fmr1. Intractable Rare Dis. Res. 3, 118-133. doi : 10.5582/irdr.2014.01024
PubMed Abstract | CrossRef Full Text | Google Scholar
Lai, J. K., Lerch, J. P., Doering, L. C., Foster, J. A., et Ellegood, J. (2016). Modifications des volumes cérébraux régionaux chez la souris adulte mâle FMR1-KO sur la souche FVB. Neuroscience 318, 12-21. doi : 10.1016/j.neuroscience.2016.01.021
PubMed Abstract | CrossRef Full Text | Google Scholar
Leboucher, A., Pisani, D. F., Martinez-Gili, L., Chilloux, J., Bermudez-Martin, P., Van Dijck, A., et al. (2019). Le régulateur traductionnel FMRP contrôle le métabolisme des lipides et du glucose chez la souris et l’homme. Mol. Metab. 21, 22-35. doi : 10.1016/j.molmet.2019.01.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Leekam, S. R., Prior, M. R., et Uljarevic, M. (2011). Comportements restreints et répétitifs dans les troubles du spectre autistique : une revue des recherches de la dernière décennie. Psychol. Bull. 137, 562-593. doi : 10.1037/a0023341
PubMed Abstract | CrossRef Full Text | Google Scholar
Lightbody, A. A., et Reiss, A. L. (2009). Relations entre le gène, le cerveau et le comportement dans le syndrome de l’X fragile : preuves des études de neuro-imagerie. Dev. Disabil. Res. Rev. 15, 343-352. doi : 10.1002/ddrr.77
PubMed Abstract | CrossRef Full Text | Google Scholar
Meera, P., Wallner, M., et Otis, T. S. (2011). Base moléculaire pour la haute sensibilité THIP/gaboxadol des récepteurs GABAA extrasynaptiques. J. Neurophysiol. 106, 2057-2064. doi : 10.1152/jn.00450.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Mientjes, E. J., Nieuwenhuizen, I., Kirkpatrick, L., Zu, T., Hoogeveen-Westerveld, M., Severijnen, L., et al. (2006). La génération d’un modèle de souris knock out conditionnel Fmr1 pour étudier la fonction Fmrp in vivo. Neurobiol. Dis. 21, 549-555. doi : 10.1016/j.nbd.2005.08.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Olmos-Serrano, J. L., Corbin, J. G., and Burns, M. P. (2011). L’agoniste des récepteurs GABAA THIP améliore les déficits comportementaux spécifiques dans le modèle murin du syndrome du X fragile. Dev. Neurosci. 33, 395-403. doi : 10.1159/000332884
PubMed Abstract | CrossRef Full Text | Google Scholar
Olmos-Serrano, J. L., Paluszkiewicz, S. M., Martin, B. S., Kaufmann, W. E., Corbin, J. G., et Huntsman, M. M. (2010). Neurotransmission GABAergique défectueuse et sauvetage pharmacologique de l’hyperexcitabilité neuronale dans l’amygdale dans un modèle murin du syndrome du X fragile. J. Neurosci. 30, 9929-9938. doi : 10.1523/JNEUROSCI.1714-10.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Osterweil, E. K., Krueger, D. D., Reinhold, K., et Bear, M. F. (2010). L’hypersensibilité au mGluR5 et à ERK1/2 entraîne une synthèse protéique excessive dans l’hippocampe d’un modèle murin du syndrome du X fragile. J. Neurosci. 30, 15616-15627. doi : 10.1523/JNEUROSCI.3888-10.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Pietropaolo, S., Guilleminot, A., Martin, B., D’Amato, F. R., et Crusio, W. E. (2011). Modulation par le fond génétique des symptômes centraux et variables de type autistique chez les souris knock-out Fmr1. PLoS One 6:e17073. doi : 10.1371/journal.pone.0017073
PubMed Abstract | CrossRef Full Text | Google Scholar
Prut, L., et Belzung, C. (2003). Le champ ouvert comme paradigme pour mesurer les effets des médicaments sur les comportements de type anxieux : une revue. Eur. J. Pharmacol. 463, 3-33. doi : 10.1016/s0014-2999(03)01272-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Rotschafer, S. E., Marshak, S., et Cramer, K. S. (2015). La délétion de Fmr1 modifie la fonction et les entrées synaptiques dans le tronc cérébral auditif. PLoS One 10:e0117266. doi : 10.1371/journal.pone.0117266
PubMed Abstract | CrossRef Full Text | Google Scholar
Scharf, S. H., Jaeschke, G., Wettstein, J. G., et Lindemann, L. (2015). Le récepteur métabotropique du glutamate 5 comme cible médicamenteuse du syndrome de l’X fragile. Curr. Opin. Pharmacol. 20, 124-134. doi : 10.1016/j.coph.2014.11.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Silverman, N. S., Popp, S., Vialou, V., Astafurov, K., Nestler, E. J., et Dow-Edwards, D. (2016). Effets du gaboxadol sur l’expression de la sensibilisation à la cocaïne chez le rat. Exp. Clin. Psychopharmacol. 24, 131-141. doi : 10.1037/pha0000069
PubMed Abstract | CrossRef Full Text | Google Scholar
Spencer, C. M., Alekseyenko, O., Hamilton, S. M., Thomas, A. M., Serysheva, E., Yuva-Paylor, L. A., et al. (2011). Modifier les phénotypes comportementaux chez les souris Fmr1KO : les différences de fond génétique révèlent des réponses de type autistique. Autism Res. 4, 40-56. doi : 10.1002/aur.168
PubMed Abstract | CrossRef Full Text | Google Scholar
The Dutch-Belgian Fragile X Consortium, Bakker, C. E., Verheij, C., Willemsen, R., van der Helm, R., Oerlemans, F., et al. (1994). Fmr1 knockout mice : a model to study fragile X mental retardation. Cell 78, 23-33. doi : 10.1016/0092-8674(94)90569-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Tranfaglia, M. R., Thibodeaux, C., Mason, D. J., Brown, D., Roberts, I., Smith, R., et al. (2019). Reprogrammer les médicaments disponibles pour les troubles neurodéveloppementaux : l’expérience de l’X fragile. Neuropharmacologie 147, 74-86. doi : 10.1016/j.neuropharm.2018.05.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Wahlsten, D., Bachmanov, A., Finn, D. A., et Crabbe, J. C. (2006). Stabilité des différences de souches de souris consanguines dans le comportement et la taille du cerveau entre les laboratoires et à travers les décennies. Proc. Natl. Acad. Sci. U S A 103, 16364-16369. doi : 10.1073/pnas.0605342103
PubMed Abstract | CrossRef Full Text | Google Scholar
Wheeler, A., Raspa, M., Bann, C., Bishop, E., Hessl, D., Sacco, P., et al. (2014). Anxiété, problèmes d’attention, hyperactivité et liste de contrôle du comportement aberrant dans le syndrome du X fragile. Am. J. Med. Genet. A 164A, 141-155. doi : 10.1002/ajmg.a.36232
PubMed Abstract | CrossRef Full Text | Google Scholar
Wheeler, A. C., Raspa, M., Bishop, E., et Bailey, D. B. Jr. (2016). L’agressivité dans le syndrome de l’X fragile. J. Intellect. Disabil. Res. 60, 113-125. doi : 10.1111/jir.12238
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, N., Peng, Z., Tong, X., Lindemeyer, A. K., Cetina, Y., Huang, C. S., et al. (2017). La diminution de l’expression de surface de la sous-unité delta du récepteur GABAA contribue à la réduction de l’inhibition tonique dans les cellules granulaires dentées dans un modèle murin du syndrome du X fragile. Exp. Neurol. 297, 168-178. doi : 10.1016/j.expneurol.2017.08.008
PubMed Abstract | CrossRef Full Text | Google Scholar
.