- Introduction
- Matériels et méthodes
- Participants
- Imagerie par résonance magnétique
- Acquisition et traitement des données
- Extraction de l’atlas
- Analyse statistique
- Résultats
- Les patients atteints de SCA3 ont révélé des lésions significatives dans les régions de lésions infratentorielles typiques
- Les patients atteints de SCA3 ont révélé des lésions cérébrales latéralisées supratentorielles
- Discussion
- Conclusions
- Data Availability Statement
- Ethics Statement
- Contributions des auteurs
- Funding
- Conflit d’intérêt
- Remerciements
- Matériel supplémentaire
Introduction
L’ataxie spinocérébelleuse de type 3 (SCA3) est une maladie neurodégénérative héréditaire causée par une expansion CAG dans la région codante du chromosome 14q32.1 (1, 2). Cliniquement, les patients atteints du SCA3 présentent un syndrome cérébelleux, un parkinsonisme, une démarche ataxique, une dysarthrie, une dysmétrie, un nystagmus, une neuropathie périphérique, des manifestations pyramidales et extrapyramidales (3-5). Les patients atteints du SCA3 souffrent également de troubles émotionnels, tels que la dépression et l’anxiété (6, 7). Ces dysfonctionnements d’ordre supérieur du SCA3 suggèrent une implication plus importante des structures extracérébelleuses plutôt que le schéma conventionnel de neurodégénérescence » olivopontocérébelleuse » (8-12). En outre, le trouble SCA3 a été décrit comme un syndrome cognitif affectif cérébelleux (CCAS) (6, 8).
Des études ont utilisé la tomographie par émission de positons (TEP) et la tomographie par émission monophotonique pour identifier des anomalies subcliniques dans le cortex cérébral (13, 14). Toutefois, ces études ont indiqué que la perturbation de la voie cérébro-cérébelleuse ne peut pas expliquer complètement les troubles cognitifs et affectifs des patients atteints de l’ACS3. Par exemple, les déficits visuospatiaux chez les patients atteints de SCA3 sont nettement associés au lobe pariétal et sont moins liés au cervelet. Peu d’études ont porté sur le rôle des régions supratentorielles dans le SCA3. La quantification de la dégénérescence dans les régions supratentorielles peut être cruciale pour évaluer le dysfonctionnement chez les patients atteints de SCA3. Dans les études de neuro-imagerie, la mesure de l’atrophie corticale régionale est cruciale pour évaluer son association avec la déficience cognitive et le dysfonctionnement émotionnel.
L’imagerie du tenseur de diffusion (DTI) peut faciliter la visualisation et la caractérisation de la matière blanche (MW), et la DTI est également une méthode efficace pour l’étude du SCA3 (15). Le SCA3 a été reconnu comme une maladie neurodégénérative à atrophie dominante de la substance blanche (16). Des études antérieures ont montré que les patients atteints de SCA3 présentent une diminution de l’anisotropie fractionnelle (AF) dans les zones du cervelet et du tronc cérébral, mais une augmentation de la diffusivité radiale (DR) dans le cervelet, le tronc cérébral, le thalamus et les lobes frontaux et temporaux (17). Une autre étude d’ITD a mis en évidence une réduction généralisée de la FA dans la MW cérébrale-frontale, pariétale, temporelle et occipitale bilatérale, la MW cérébelleuse, le thalamus et le tronc cérébral chez les patients atteints d’ACS3 (16). De plus, des augmentations de la diffusivité moyenne (DM) ont été détectées selon un schéma similaire et largement chevauchant dans la MW cérébrale-frontale, -pariétale, -temporale et -occipitale bilatérale ; la MW cérébelleuse ; le thalamus ; et le tronc cérébral (16).
Dans cette étude, nous avons évalué l’atrophie dans des régions relativement focales et expliqué l’implication supratentorielle dans le SCA3. Cette étude a utilisé la méthode de la dimension fractale (FD), qui a l’avantage de produire des résultats avec une variation minimale (18), pour quantifier les changements morphologiques corticaux et mesurer l’atrophie corticale régionale des régions supratentorielles. Dans la présente étude, nous avons mesuré les valeurs 3D-FD des 97 segments de la matière grise du cerveau entier pour chaque participant. Nous comparons ensuite ces résultats de lésions de la matière grise avec l’analyse DTI des lésions de la matière blanche dans le SCA3 de notre étude récente. Nous avons anticipé que les régions de lésions de la MG évaluées dans cette étude sont liées aux régions de lésions de la MM de l’étude DTI, et le résultat peut vérifier l’association entre la déficience liée à la motricité et l’atrophie des régions supratentorielles chez les patients atteints de SCA3.
Matériels et méthodes
Participants
Un total de 48 patients atteints de SCA3 et 50 individus sains appariés en termes de sexe et d’âge, comme groupe de contrôle, ont participé à cette étude. Cette étude a été menée conformément à la déclaration d’Helsinki et a été approuvée par le conseil d’examen institutionnel de l’hôpital général des vétérans de Taipei. Tous les participants ont fourni un consentement éclairé écrit avant de participer à cette étude. Tous les participants ont été recrutés dans le département de radiologie de l’hôpital général des vétérans de Taipei. Le SARA (scale for the assessment and rating of ataxia) a été appliqué pour l’évaluation clinique de l’ataxie des patients atteints de SCA3 (19). Les symptômes de l’évolution de la maladie de Parkinson chez les patients atteints de SCA3 ont été mesurés en utilisant la stadification modifiée de Hoehn et Yahr (20). Le score SARA, qui est une évaluation de la gravité des symptômes d’ataxie allant de 0 à 40, a été utilisé comme référence pour indiquer la progression de la gravité clinique par rapport à la dégénérescence cérébelleuse. Un âge d’apparition autodéclaré, c’est-à-dire l’âge auquel les patients ont montré le premier signe de tout symptôme ataxique, a été obtenu auprès de chaque patient (21). La longueur de la répétition CAG de chaque patient SCA3 a été déterminée par réaction en chaîne par polymérase, comme décrit précédemment (22). Le tableau 1 présente les données démographiques, cliniques et d’imagerie par RM des deux groupes. Les patients atteints de SCA3 répondaient aux critères d’inclusion s’ils présentaient une ataxie progressive et autrement inexpliquée et s’ils étaient testés positifs pour le génotype SCA3. La durée de la maladie chez les patients atteints de SCA3 était de 8,89 ± 6,432 ans. Les personnes du groupe témoin ne souffraient d’aucune maladie du système nerveux central et n’ont présenté aucune anomalie neurologique pendant la période d’étude. Un neuroradiologue expérimenté a examiné les images pondérées en T1 et T2 du groupe témoin pour s’assurer de l’absence de signes non découverts d’une autre maladie neurologique ou d’anomalies inattendues.
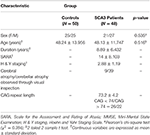
Tableau 1. Données démographiques, cliniques et images RM du groupe témoin et du groupe de patients.
Imagerie par résonance magnétique
Acquisition et traitement des données
Les images RM axiales du cerveau humain couvrant l’ensemble du cerveau et du cervelet ont été acquises à l’aide d’un scanner Siemens Vision 1,5-T (Erlangen, Allemagne). Les participants ont été scannés avec une bobine de tête à polarisation circulaire pour obtenir des images pondérées en T1 (TR = 14,4 ms ; TE = 5,5 ms ; taille de la matrice : 256 × 256 ; coupes axiales de 1,5 mm ; FOV = 256 × 256 mm2 ; taille du voxel, 1,0 × 1,0 × 1,5 mm3, nombre de coupes = 128). Les images acquises pondérées en T1 de chaque participant ont été reformatées en une image axiale et converties en un format d’analyse par le logiciel MRIcro (Chris Rorden, Université de Nottingham, UK ; www.sph.sc.edu/comd/rorden/mricro.html). La figure 1 illustre le schéma de traitement des données et d’analyse statistique. Afin d’améliorer la précision de l’extraction du tissu cérébral, une fonction automatisée d’enlèvement du crâne a été appliquée aux volumes d’image à l’aide de l’outil d’extraction du cerveau du logiciel MRIcro (figure 1B). Les processus suivants ont été réalisés à l’aide de DiffeoMap (Li, X. ; Jiang, H. ; et Mori, S. ; Johns Hopkins University, www.MriStudio.org). Dans cette procédure, une transformation affine à 12 paramètres (23) a été utilisée pour normaliser chaque image pondérée en T1 vers le modèle T1 JHU_MNI_SS_T_ss.
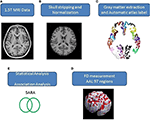
Figure 1. (A-E) Procédure du traitement de l’image et de l’analyse statistique.
Extraction de l’atlas
Les traitements des données d’image ont été effectués à l’aide de la boîte à outils SPM8 (Wellcome Department of Cognitive Neurology, Institute of Neurology, University College London, London, UK, http://www.fil.ion.ucl.ac.uk/spm/) et de la boîte à outils IBASPM (Individual Brain Atlases using Statistical Parametric Mapping, http://www.thomaskoenig.ch/Lester/ibaspm.htm), toutes deux exécutées à l’aide du logiciel MATLAB 2010 (Mathworks, Natick, MA, USA).
La procédure comporte trois étapes après normalisation : (1) la segmentation de l’image normalisée en matière grise, matière blanche et liquide céphalo-rachidien dans l’espace natif, (2) la parcellation de la matière grise en 116 régions basées sur l’étiquetage anatomique de l’atlas anatomique de l’Institut neurologique de Montréal (MNI) (24), et (3) la transformation des images de matière grise dans l’espace MNI et l’alignement anatomique de chaque voxel de matière grise sur les 116 structures d’étiquetage anatomique automatique en utilisant IBASPM (24), cerveau gauche : 45 régions, cerveau droit : 45 régions, cervelet : 26 régions ; (Figure 1C). Les 26 régions du cervelet ont été fusionnées en sept régions selon leurs structures anatomiques, et les volumes des 97 structures cérébrales étiquetées (45 pour chaque hémisphère cérébral et sept pour le cervelet, tableau supplémentaire 1) ont été extraits pour chaque personne (figure 1C).
La méthode FD a été proposée à l’origine par Mandelbrot pour la quantification de la complexité liée à la forme des objets en une seule valeur numérique (25). La méthode FD est utilisée pour la mesure topologique de la complexité ; une valeur FD plus élevée représente une plus grande complexité topologique du tissu étudié (18, 26). De nombreux neurologues ont démontré que la valeur FD peut servir de mesure quantitative pour décrire avec précision la complexité morphologique du pliage cérébral (18, 26, 27). L’analyse FD étant basée sur une échelle logarithmique, même une petite augmentation de la valeur FD peut correspondre à une augmentation considérable de la complexité (18). Cette étude a adopté la méthode de comptage de boîtes 3D pour mesurer les valeurs 3D-FD des 97 segments de matière grise du cerveau entier de chaque participant (figure 1D). Une étude connexe détaille l’algorithme de la méthode de comptage de boîtes (18).
Analyse statistique
Les différences liées au sexe et à l’âge entre les groupes ont été mesurées à l’aide du test du chi carré de Pearson (χ2 = 0,384, p = 0,535) et du test t à 2 échantillons bilatéraux (p = 0,516), séparément. Une régression linéaire a été appliquée pour éliminer les effets de l’âge et du sexe. Nous avons adopté un test t bilatéral pour déterminer si une différence significative existait entre le groupe témoin et le groupe de patients concernant les valeurs 3D-FD de chaque région corticale. La signification des résultats était basée sur le taux de fausse découverte (p = 0,05 corrigé par le FDR) (28). L’ampleur de l’association entre la valeur 3D-FD de chaque région cérébrale et les caractéristiques cliniques, telles que la durée de la maladie et le SARA, a été déterminée par la mesure du r de Pearson (figure 1E). Ces analyses ont été réalisées à l’aide de la Statistics Toolbox de MATLAB 2010.
Résultats
Les patients atteints de SCA3 ont révélé des lésions significatives dans les régions de lésions infratentorielles typiques
Des neuroradiologues expérimentés ont rapporté les résultats de l’IRM des patients atteints de SCA3 (tableau 1). La figure 2 illustre la comparaison des valeurs 3D-FD dans chaque lobe entre le groupe sain et le groupe SCA3. Globalement, les patients atteints de SCA3 présentaient des valeurs de 3D-FD significativement diminuées dans chaque lobe, et le cervelet était associé à la réduction la plus importante de la valeur de 3D-FD (figure 2). Les valeurs 3D-FD du cortex cérébelleux des patients SCA3 ont montré une corrélation significative avec leurs scores SARA (r = -0,3346 ; p = 0,023). Nous avons ensuite subdivisé le cortex cérébral et cérébelleux en 97 régions et quantifié l’atrophie dans chaque région. Les patients atteints de SCA3 présentaient des régions de lésions infratentorielles typiques, notamment les noyaux pontins, le cortex cérébelleux et les olives inférieures. Les détails des valeurs 3D-FD significativement diminuées des régions d’atrophie entre le groupe sain et le groupe SCA3 sont résumés dans le tableau 2.
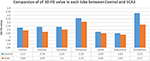
Figure 2. Comparaison des valeurs 3D-FD dans chaque lobe entre le groupe sain et le groupe SCA3. La valeur 3D-FD dans chaque lobe du SCA3 a montré une valeur significativement plus faible que celle du groupe témoin. La valeur p de la différence significative du cervelet, du lobe frontal, du lobe pariétal et du lobe occipital sont inférieurs à 0,01, et pour les autres lobes sont inférieurs à 0,05.
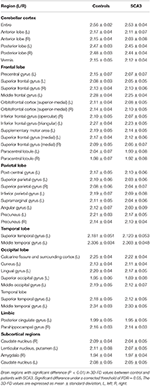
Tableau 2. Régions atrophiées significatives chez les patients atteints de SCA3 (p < 0,05).
Les patients atteints de SCA3 ont révélé des lésions cérébrales latéralisées supratentorielles
En plus des lésions infratentorielles, des lésions dans les régions supratentorielles ont également été observées chez tous les patients atteints de SCA3. Ils ont montré des lésions étendues dans 39 régions cérébrales parcellaires (p < 0,05), notamment le lobe frontal, le lobe pariétal, le lobe occipital et le lobe temporal. Ils ont révélé une atrophie latéralisée et prédominante dans l’hémisphère gauche (droite/gauche : 12/27). En particulier dans les lobes occipital et temporal, les patients atteints de SCA3 ont révélé des valeurs 3D-FD significativement diminuées uniquement dans l’hémisphère gauche. Les régions atrophiées significatives dans les régions frontales étaient le cortex prémoteur (gyrus précentral gauche, gyrus frontal supérieur bilatéral et gyrus frontal moyen gauche), le cortex moteur supplémentaire (aire motrice supplémentaire gauche) et le cortex moteur primaire (gyrus précentral gauche) (figure 3).
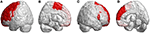
Figure 3. Régions du lobe frontal indiquant des valeurs 3D-FD plus faibles chez les patients atteints de SCA3 par rapport aux témoins. (A) Vue extérieure gauche, (B) vue intérieure gauche, (C) vue extérieure droite, et (D) vue intérieure droite. Les patients atteints de SCA3 présentaient des valeurs 3D-FD significativement diminuées dans les régions frontales, notamment le cortex prémoteur (gyrus précentral gauche, gyrus frontal supérieur bilatéral et gyrus frontal moyen gauche), le cortex moteur supplémentaire (aire motrice supplémentaire gauche) et le cortex moteur primaire (gyrus précentral gauche). D’autres régions atrophiées ont été observées dans le gyrus frontal inférieur gauche (operculaire), le gyrus frontal inférieur gauche (triangulaire), le cortex orbitofrontal bilatéral (supérieur-1 médial), le gyrus frontal supérieur bilatéral (médial) et le lobule paracentral bilatéral chez les patients atteints de SCA3. Toutes les régions aux valeurs 3D-FD significativement diminuées sont illustrées en rouge.
Les autres régions atrophiées se trouvaient dans le gyrus frontal inférieur gauche (operculaire), le gyrus frontal inférieur gauche (triangulaire), le cortex orbitofrontal bilatéral (supérieur-médial), le gyrus frontal supérieur bilatéral (médial) et le lobule paracentral bilatéral. Dans le lobe pariétal, des valeurs FD diminuées ont été détectées dans le gyrus postcentral gauche, le gyrus supramarginal gauche, le gyrus angulaire gauche, le gyrus pariétal supérieur bilatéral et le précunéus bilatéral des patients atteints de SCA3 (figure 4).
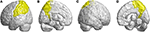
Figure 4. Régions du lobe pariétal indiquant une diminution de la valeur 3D-FD chez les patients atteints de SCA3 par rapport aux témoins. (A) Vue extérieure gauche, (B) vue intérieure gauche, (C) vue extérieure droite, et (D) vue intérieure droite. Par rapport aux témoins, les patients atteints d’ACS3 présentaient des valeurs de 3D-FD significativement plus faibles dans le gyrus postcentral gauche, le gyrus supramarginal gauche, le gyrus angulaire gauche, le gyrus pariétal supérieur bilatéral et le précuneus bilatéral du lobe pariétal. Toutes les régions aux valeurs 3D-FD significativement diminuées sont illustrées en jaune.
Dans le lobe occipital, les patients SCA3 ont révélé des valeurs FD significativement plus faibles dans la fissure calcarine et le cortex environnant, le cunéus, le gyrus lingual et les gyri occipitaux supérieur et moyen dans l’hémisphère gauche (figure 5A, couleur bleue). Dans le lobe temporal, les régions présentant des valeurs de FD réduites se trouvaient dans les gyres temporaux supérieur gauche et moyen gauche des patients atteints de SCA3 (figure 5A, couleur violette). Les valeurs 3D-FD dans le gyrus cingulaire postérieur gauche de la région limbique étaient également significativement diminuées chez les patients atteints de SCA3 (figures 5B,D, couleur verte). Des régions d’atrophie significative ont été observées dans les ganglions de la base, y compris le noyau caudé bilatéral et le putamen gauche, chez les patients atteints du SCA3 (figures 5B,D, couleur bleu aqua). Dans le lobe occipital extérieur droit, aucune région atrophiée significative n’a été observée chez les patients atteints de SCA3 (figure 5C).
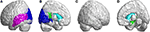
Figure 5. Régions du lobe occipital, du lobe temporal et du lobe sous-cortical indiquant des valeurs 3D-FD significativement plus faibles chez les patients atteints de SCA3 par rapport aux témoins. (A) Vue extérieure gauche, (B) vue intérieure gauche, (C) vue extérieure droite, et (D) vue intérieure droite. Les régions bleues indiquent des valeurs 3D-FD significativement plus faibles dans le lobe occipital, y compris la fissure calcarine et le cortex environnant, le cunéus et le gyrus lingual, ainsi que le gyrus occipital supérieur et moyen dans l’hémisphère gauche. Les régions violettes indiquent des valeurs 3D-FD plus faibles dans le gyrus temporal supérieur gauche et le gyrus temporal moyen gauche. Les régions bleu aqua représentent des valeurs de 3D-FD plus faibles dans les régions sous-corticales, y compris le caudate bilatéral et le putamen gauche. Les régions vertes représentent des valeurs 3D-FD significativement plus faibles dans le gyrus cingulaire postérieur gauche et le gyrus parahippocampique du système limbique.
Dans la figure 6, nous avons constaté que de nombreuses régions cérébrales atrophiées comprenaient le cervelet, les circuits de liaison cervelet-thalamocortical et ganglion basal-thalamocortical qui impliquaient les patients atteints de SCA3 ont révélé des lésions cérébelleuses-thalamocorticales et ganglion basal-thalamocorticales dans ces voies.

Figure 6. SCA3 est impliqué à la fois dans les voies cérébelleuse-thalamocorticale et ganglionnaire basale-thalamocorticale. (A) Vue extérieure gauche, (B) vue intérieure gauche, (C) vue extérieure droite, et (D) vue intérieure droite. Dans la boucle cérébelleuse-thalamocorticale, les patients atteints de SCA3 présentent des valeurs 3D-FD significativement plus faibles dans les cortex cérébelleux, prémoteur et moteur supplémentaire. La diminution des valeurs de 3D-FD dans le cortex cérébelleux et d’autres régions cérébrales liées à la motricité chez les patients atteints de SCA3 permet d’expliquer la présence de symptômes cliniques. Dans la boucle ganglionnaire basale-thalamocorticale, les patients atteints de SCA3 présentent des valeurs 3D-FD significativement plus faibles dans le cortex frontal, le cortex moteur primaire, le putamen et le caudate. Ces résultats révèlent des changements morphologiques dans la boucle ganglionnaire basale-thalamocorticale chez les patients atteints de SCA3.
Discussion
Cliniquement, les patients atteints de SCA3 présentent un syndrome cérébelleux et un parkinsonisme (3-5). Les régions atrophiées du cortex infratentoriel et supratentoriel énumérées dans le tableau 2, et ont montré un large éventail de zones superposées comme dans deux régions fonctionnelles, à savoir le cortex lié au cervelet (CB) (29) et le cortex lié aux ganglions de la base (BG) (30). Le cortex lié au CB comprend le cervelet, les cortex préfrontal et sensorimoteur, le cortex préfrontal et le lobe temporal, et le cortex lié au BG comprend le cortex moteur primaire, l’aire motrice supplémentaire, le cortex prémoteur et les ganglions de la base. Nos résultats sont conformes aux études antérieures de neuro-imagerie conventionnelle selon lesquelles le cervelet est la région la plus touchée et la plus atrophiée chez les patients atteints de SCA3 (4, 31, 32). De plus, la valeur 3D-FD dans le cortex cérébelleux des patients atteints de SCA3 avait une corrélation négative significative avec les scores SARA (r = -0,3346 ; p = 0,023) comme Rezende et al. l’avaient déjà signalé (33).
Dans les régions infratentorielles, les patients atteints de SCA3 avaient une valeur 3D-FD significativement réduite dans le putamen et le caudate. Des études neuropathologiques ont montré une perte neuronale dans le putamen et le caudate, ce qui peut conduire à une atrophie des ganglions de la base en association avec le parkinsonisme (34). Les caractéristiques parkinsoniennes constituent le phénotype prévalent de la mutation SCA3 et sont généralement accompagnées de symptômes des ganglions de la base (35-37). Dans les études nécropsiques, l’atteinte des ganglions de la base est fréquente chez les patients atteints de SCA3. L’imagerie fonctionnelle utilisant des études TEP a également démontré un déclin fonctionnel précoce du caudate et du putamen chez les patients atteints de SCA3. De plus, les patients atteints de SCA3 présentaient un volume des ganglions de la base significativement plus faible (35). Cependant, les études connexes ne se sont concentrées que sur les ganglions de la base et les régions infratentorielles. Dans la figure 6, nous avons vérifié que le SCA3 peut non seulement présenter des lésions des ganglions de la base, mais aussi des lésions des voies cérébelleuses-thalamocorticales et ganglionnaires-thalamocorticales.
Les patients atteints du SCA3 présentent des valeurs 3D-FD significativement diminuées du cortex prémoteur et du cortex moteur supplémentaire dans leur boucle cérébelleuse-thalamocorticale. Le cortex prémoteur et l’aire motrice supplémentaire sont associés au contrôle des mouvements, tels que la force musculaire et la direction du mouvement. Des lésions dans ces régions peuvent induire une ataxie de la démarche, de l’attitude et des membres, en plus de la décomposition des mouvements (38, 39). Les valeurs 3D-FD réduites du cortex cérébelleux et d’autres régions cérébrales liées à la motricité chez les patients atteints de SCA3 peuvent expliquer la présence de symptômes cliniques. De plus, dans la boucle ganglionnaire basale-thalamocorticale, les patients atteints de SCA3 présentent des valeurs 3D-FD significativement réduites dans les cortex frontaux et moteurs primaires. Le cortex moteur primaire est également une destination majeure de la production des ganglions de la base (40). Les perturbations de la boucle ganglionnaire basale-thalamocorticale peuvent également contribuer au dysfonctionnement moteur parkinsonien (41). Les résultats de cette étude soulignent les changements morphologiques de la boucle ganglionnaire basale-thalamocorticale chez les patients atteints de SCA3, que les études précédentes de neuro-imagerie n’ont pas réussi à aborder.
Récemment, nous avons utilisé l’imagerie du tenseur de diffusion (DTI) pour mesurer la diffusion moléculaire de l’eau de l’altération de la substance blanche (WM) dans SCA3 (15). Nous avons constaté que le SCA3 révélait des lésions étendues de la substance blanche dans la MW cérébrale-frontale, -pariétale, -temporale et -occipitale bilatérale ; la MW cérébelleuse ; le thalamus et le tronc cérébral. De manière identique, dans cette étude, nous avons observé que le SCA3 présentait presque dans les mêmes régions parcellaires de ces lésions de la MW que les lésions de la GM. Ces résultats actuels confirment l’implication des régions supratentorielles chez les patients atteints de SCA3. Braga et al. ont rapporté des résultats similaires, démontrant que le SCA3 cause le CCAS par l’altération des fonctions exécutives, de la fluidité verbale, du raisonnement abstrait et de la mémoire de travail (8). Des études neuropathologiques ont révélé que les CCAS résultent de la perturbation du circuit cérébelleux, qui est associé aux cortex préfrontal, pariétal supérieur, temporal supérieur et limbique (42, 43). Des études ont confirmé le rôle du cervelet dans les fonctions cognitives ; or, les fonctions cognitives, affectives et visuospatiales sont directement associées à la dégénérescence corticale. Les zones significativement atrophiées des régions supratentorielles chez les patients atteints de SCA3 étaient plus étendues que les régions associées au CCAS. L’atrophie du cortex supratentoriel pourrait être le principal facteur associé au dysfonctionnement des régions liées à l’ataxie et au parkinsonisme. Ces résultats suggèrent que le SCA3 ne doit plus être considéré comme une maladie limitée au cervelet et à ses connexions, mais plutôt comme une pathologie affectant l’ensemble du cerveau.
Cependant, cette étude présente encore certaines limites. Les principales limites de cette étude sont le manque d’évaluations cognitives spécifiques et de paramètres cliniques pour évaluer le CCAS dans l’ACS. D’autres investigations sont justifiées concernant la corrélation entre les présents résultats et les données cliniques, telles que les données d’IRM fonctionnelle. Cela pourrait contribuer à fournir une méthode plus précise pour évaluer l’association entre l’atteinte cognitive avec l’atteinte motrice et l’atrophie régionale chez les patients atteints de SCA3.
Conclusions
Dans cette étude, nous avons utilisé la méthode 3D-FD pour quantifier les variations morphologiques régionales chez les patients atteints de SCA3 et évaluer l’association entre l’atrophie supratentorielle et l’atteinte motrice chez les patients atteints de SCA3. Nos résultats ont révélé une dégénérescence significative du cortex cérébral dans des régions spécifiques, qui peuvent être liées au cervelet ou aux ganglions de la base. Nos résultats pourraient être corrélés aux symptômes communs du SCA3, tels que l’ataxie, le parkinsonisme, la dysarthrie et la dysmétrie. Le SCA3 ne devrait plus être considéré comme une maladie limitée au cervelet et à ses connexions ; il devrait plutôt être considéré comme une pathologie affectant l’ensemble du cerveau.
Data Availability Statement
Tous les ensembles de données générés pour cette étude sont inclus dans l’article/matériel supplémentaire.
Ethics Statement
Les études impliquant des participants humains ont été examinées et approuvées par le conseil d’examen institutionnel de l’hôpital général des vétérans de Taipei. Les patients/participants ont fourni leur consentement éclairé écrit pour participer à cette étude.
Contributions des auteurs
P-SW et Y-TW ont organisé le projet de recherche, revu et critiqué le manuscrit. T-YW a rédigé le manuscrit. H-MW a accédé aux données de recherche. B-WS a organisé la recherche et effectué la collecte des données. C-WJ a effectué l’analyse statistique, a rédigé et révisé le manuscrit.
Funding
Cette étude a été financée par le ministère de la Science et de la Technologie, Taiwan (MOST108-2634-F-010-002) ; National Health Research Institutes, Taiwan (NHRI-EX106-10526EI) ; National Yang-Ming University and Shin-Kong Wu-Ho Su Memorial Hospital Research Program (107GB006).
Conflit d’intérêt
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêt potentiel.
Remerciements
Les auteurs souhaitent remercier toutes les personnes qui ont participé à cette étude et remercier Wallace Academic Editing pour l’édition de ce manuscrit.
Matériel supplémentaire
Le matériel supplémentaire pour cet article peut être trouvé en ligne à : https://www.frontiersin.org/articles/10.3389/fneur.2020.00124/full#supplementary-material
1. Kawaguchi Y, Okamoto T, Taniwaki M, Aizawa M, Inoue M, Katayama S, et al. Expansions CAG dans un nouveau gène pour la maladie de Machado-Joseph au chromosome 14q32.1. Nat Genet. (1994) 8:221-8. doi : 10.1038/ng1194-221
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Riess O, Rub U, Pastore A, Bauer P, Schols L. SCA3 : caractéristiques neurologiques, pathogenèse et modèles animaux. Cerebellum. (2008) 7:125-37. doi : 10.1007/s12311-008-0013-4
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Stevanin G, Durr A, Brice A. Avancées cliniques et moléculaires dans les ataxies cérébelleuses autosomiques dominantes : du génotype au phénotype et à la physiopathologie. Eur J Hum Genet. (2000) 8:4-18. doi : 10.1038/sj.ejhg.5200403
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Schols L, Bauer P, Schmidt T, Schulte T, Riess O. Autosomal dominant cerebellar ataxias : clinical features, genetics, and pathogenesis. Lancet Neurol. (2004) 3:291-304. doi : 10.1016/S1474-4422(04)00737-9
PubMed Abstract | CrossRef Full Text
5. Roeske S, Filla I, Heim S, Amunts K, Helmstaedter C, Wüllner U, et al. Progressive cognitive dysfunction in spinocerebellar ataxia type 3. Trouble du mouvement. (2013) 28:1435-8. doi : 10.1002/mds.25512
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Braga-Neto P, Pedroso JL, Alessi H, Dutra LA, Felicio AC, Minett T, et al. Cerebellar cognitive affective syndrome in machado joseph disease : core clinical features. Cerebellum. (2012) 11:549-56. doi : 10.1007/s12311-011-0318-6
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Zawacki TM, Grace J, Friedman JH, Sudarsky L. Dysfonctionnement exécutif et émotionnel dans la maladie de Machado-Joseph. Movement Disord. (2002) 17:1004-10. doi : 10.1002/mds.10033
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Braga-Neto P, Dutra LA, Pedroso JL, Barsottini OGP. Dysfonctionnement cognitif dans l’ataxie spinocérébelleuse de type 3 : topographies et modèles variables. Movement Disord. (2014) 29:156-7. doi : 10.1002/mds.25756
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Lopes TM, D′Abreu A, Junior MCF, Yasuda CL, Betting LE, Samara AB, et al. Dommages neuronaux généralisés et dysfonctionnement cognitif dans l’ataxie spinocérébelleuse de type 3. J Neurol. (2013) 260:2370-9. doi : 10.1007/s00415-013-6998-8
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Roeske S, Filla I, Heim S, Amunts K, Helmstaedter C, Wüllner C, et al. Reply to : cognitive dysfunction in spinocerebellar ataxia type 3 : variable topographies and patterns. Movement Disord. (2014) 29:157-8. doi : 10.1002/mds.25755
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Barbas H. Base anatomique des interactions cognitives-émotionnelles dans le cortex préfrontal des primates. Neurosci Biobehav R. (1995) 19:499-510. doi : 10.1016/0149-7634(94)00053-4
PubMed Abstract | CrossRef Full Text | Google Scholar
12. D’Abreu A, Franca MC Jr, Yasuda CL, Campos BA, Lopes-Cendes I, Cendes F, et al. Neocortical atrophy in machado-joseph disease : a longitudinal neuroimaging study. J Neuroimaging. (2012) 22:285-91. doi : 10.1111/j.1552-6569.2011.00614.x
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Soong BW, Liu RS. Tomographie par émission de positons chez les porteurs de gènes asymptomatiques de la maladie de Machado-Joseph. J Neurol Neurosur PS. (1998) 64:499-504. doi : 10.1136/jnnp.64.4.499
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Wullner U, Reimold M, Abele M, Burk K, Minnerop M, Dohmen BM, et al. Tomographie par émission de positons du transporteur de la dopamine dans les ataxies spinocérébelleuses de type 1, 2, 3 et 6. Arc Neurol. (2005) 62:1280-5. doi : 10.1001/archneur.62.8.1280
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Jao CW, Soong BW, Huang CW, Duan CA, Wu CC, Wu YT, et al. Imagerie par résonance magnétique à tenseur de diffusion pour différencier l’atrophie du système multiple de type cérébelleux et l’ataxie spinocérébelleuse de type 3. Brain Sci. (2019) 9:354. doi : 10.3390/brainsci9120354
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Kang JS, Klein JC, Baudrexel S, Deichmann R, Nolte D, Hilker R. White matter damage is related to ataxia severity in SCA3. J Neurol. (2014) 261:291-9. doi : 10.1007/s00415-013-7186-6
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Guimarães RP, D’Abreu A, Yasuda CL, Franca MC Jr, Silva BH, Cappabianco FA, et al. Une évaluation multimodale des dommages microstructuraux de la substance blanche dans l’ataxie spinocérébelleuse de type 3. Mov Disord. (2013) 28:1125-32. doi : 10.1002/mds.25451
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Wu YT, Shyu KK, Jao CW, Wang ZY, Soong BW, Wu HM, et al. Analyse des dimensions fractales pour quantifier les changements morphologiques cérébelleux de l’atrophie systémique multiple de type cérébelleux (MSA-C). NeuroImage. (2010) 49:539-51. doi : 10.1016/j.neuroimage.2009.07.042
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Schmitz-Hübsch T, du Montcel ST, Baliko L, Berciano J, Boesch S, Depondt C, et al. Scale for the assessment and rating of ataxia. Développement d’une nouvelle échelle clinique. Neurologie. (2006) 66:1717-20. doi : 10.1212/01.wnl.0000219042.60538.92
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Hoehn MM, Yahr MD. Parkinsonisme : apparition, progression et mortalité. Neurology. (1998) 50:318. doi : 10.1212/WNL.50.2.318
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Jardim LB, Pereira ML, Silveira I, Ferro A, Sequeiros J, Giugliani R. Neurologic findings in Machado-Joseph disease : relation with disease duration, subtypes, and (CAG)n. Arch Neurol. (2001) 58:899-904. doi : 10.1001/archneur.58.6.899
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Soong B-W, Lu Y-C, Choo K-B, Lee H-Y. Analyse de fréquence des ataxies cérébelleuses autosomiques dominantes chez les patients taïwanais et caractérisation clinique et moléculaire de l’ataxie spinocérébelleuse de type 6. Arch Neurol. (2001) 58:1105-9. doi : 10.1001/archneur.58.7.1105
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Woods RP, Grafton ST, Holmes CJ, Cherry SR, Mazziotta JC. Enregistrement automatisé des images : I. General methods and intrasubject, intramodalitym validation. J Comput Assist Tomo. (1998) 22:139-52. doi : 10.1097/00004728-199801000-00027
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Tzourio-Mazoyer N, Landeau B, Papathanassiou D, Crivello F, Etard O, Delcroix N, et al. Automated anatomical labeling of activations in SPM using a macroscopic anatomical parcellation of the MNI MRI single-subject brain. NeuroImage. (2002) 15:273-89. doi : 10.1006/nimg.2001.0978
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Mandelbrot BB. Fractales : Forme, hasard et dimension. San Francisco, CA : Freeman (1977). p. 365.
Google Scholar
26. Esteban FJ, Sepulcre J, de Mendizabal NV, Goni J, Navas J, de Miras JR, et al. Fractal dimension and white matter changes in multiple sclerosis. NeuroImage. (2007) 36:543-9. doi : 10.1016/j.neuroimage.2007.03.057
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Ha TH, Yoon U, Lee KJ, Shin YW, Lee JM, Kim IY, et al. Fractal dimension of cerebral cortical surface in schizophrenia and obsessive-compulsive disorder. Neurosci Lett. (2005) 384:172-6. doi : 10.1016/j.neulet.2005.04.078
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Benjamini Y, Hochberg Y. Contrôler le taux de fausse découverte : une approche pratique et puissante des tests multiples. J R Stat Soc B. (1995) 57:289-300. doi : 10.1111/j.2517-6161.1995.tb02031.x
CrossRef Full Text | Google Scholar
29. Schmahmann JD, Pandya DN. Enquête anatomique sur les projections vers le pontis de base à partir des cortex d’association pariétaux postérieurs chez le singe rhésus. J Comp Neurol. (1989) 289:53-73. doi : 10.1002/cne.902890105
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Girard B, Tabareau N, Berthoz A, Slotine JJ. Amplification sélective à l’aide d’un modèle contractant du ganglion de la base. Pont A Mousson : NeuroComp (2006). p. 30-3.
Google Scholar
31. Burk K, Abele M, Fetter M, Dichgans J, Skalej M, Laccone F, et al. Autosomal dominant cerebellar ataxia type I clinical features and MRI in families with SCA1, SCA2 and SCA3. Brain. (1996) 119:1497-505. doi : 10.1093/brain/119.5.1497
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Dohlinger S, Hauser TK, Borkert J, Luft AR, Schulz JB. Imagerie par résonance magnétique dans les ataxies spinocérébelleuses. Cerebellum. (2008) 7:204-14. doi : 10.1007/s12311-008-0025-0
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Rezende TJ, D’Abreu A, Guimaraes RP, Lopes TM, Lopes-Cendesc I, Cendes F, et al. Cerebral cortex involvement in Machado-Joseph disease. Eur J Neurol. (2015) 22:277-83, e23-4. doi : 10.1111/ene.12559
CrossRef Full Text | Google Scholar
34. Lu CS, Chang HC, Kuo PC, Liu YL, Wu WS, Weng YH, et al. The parkinsonian phenotype of spinocerebellar ataxia type 3 in a Taiwanese family. Parkinsonism Relat D. (2004) 10:369-73. doi : 10.1016/j.parkreldis.2004.03.009
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Klockgether T, Skalej M, Wedekind D, Luft AR, Welte D, Schulz JB, et al. Autosomal dominant cerebellar ataxia type I. MRI-based volumetry of posterior fossa structures and basal ganglia in spinocerebellar ataxia types 1, 2 and 3. Brain. (1998) 121:1687-93. doi : 10.1093/brain/121.9.1687
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Socal MP, Emmel VE, Rieder CRM, Hilbig A, Saraiva-Pereira ML, Jardim LB. Intrafamilial variability of Parkinson phenotype in SCAs : novel cases due to SCA2 and SCA3 expansions. Parkinsonism Relat D. (2009) 15:374-8. doi : 10.1016/j.parkreldis.2008.09.005
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Bettencourt C, Santos C, Coutinho P, Rizzu P, Vasconcelos J, Kay T, et al. Phénotype parkinsonien dans la maladie de Machado-Joseph (MJD/SCA3) : un rapport de deux cas. BMC Neurol. (2011) 11:131. doi : 10.1186/1471-2377-11-131
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Kandel ER, Schwartz JH, Jessell TM. Principes de la science des neurones. New York, NY : McGraw-Hill (1991). p. 626-46.
Google Scholar
39. Asbury AK, McKhann GM. Maladies du système nerveux : Neurobiologie clinique. Philadelphie, PA : W.B. Saunders (1992). p. 319-341.
40. Hoover JE, Strick PL. Des canaux de sortie multiples dans les ganglions de la base. Science. (1993) 5:819-21. doi : 10.1126/science.7679223
CrossRef Full Text | Google Scholar
41. Jan C, Pessiglione M, Tremblay L, Tandé D, Hirsch EC, François C, et al. Analyse quantitative de la perte dopaminergique en relation avec les territoires fonctionnels chez les singes traités au MPTP. Eur J Neurosci. (2003) 18:2082-6. doi : 10.1046/j.1460-9568.2003.02946.x
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Rub U, de Vos RA, Brunt ER, Sebesteny T, Schols L, Auburger G, et al. Spinocerebellar ataxia type 3 (SCA3) : thalamic neurodegeneration occurs independently from thalamic ataxin-3 immunopositive neuronal intranuclear inclusions. Brain Pathol. (2006) 16:218-27. doi : 10.1111/j.1750-3639.2006.00022.x
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Rub U, Seidel K, Ozerden I, Gierga K, Brunt ER, Schöls L, et al. Affection cohérente du système somatosensoriel central dans l’ataxie spinocérébelleuse de type 2 et de type 3 et sa signification pour les symptômes cliniques et la thérapie de réadaptation. Brain Res Rev. (2007) 53:235-49. doi : 10.1016/j.brainresrev.2006.08.003
PubMed Abstract | CrossRef Full Text | Google Scholar