- Albumine sérique
- Structure
- Fonction
- Distribution
- Accumulation d’albumine dans l’interstitium tumoral
- Protéines cellulaires de liaison à l’albumine
- Albondine/gp60
- gp18 et gp30
- SPARC
- hnRNPs et Calreticulin
- FcRn
- Cubiline et Megalin
- L’albumine comme vecteur de médicament en oncologie
- Conclusion
- Déclaration de conflit d’intérêts
- Remerciements
Albumine sérique
Structure
L’albumine sérique est la protéine la plus abondante dans le plasma sanguin de tous les vertébrés, sa concentration dans le sérum humain étant de 35-50 mg/mL (Peters, 1996). L’albumine sérique humaine (HSA) a une masse moléculaire de 66 348 Da et est composée de trois domaines homologues, numérotés I, II et III (Figure 1) (He et Carter, 1992 ; Peters, 1996 ; Sugio et al., 1999). Chaque domaine est regroupé en sous-domaines A et B qui possèdent des motifs structurels communs. Les deux principales régions responsables de la liaison du ligand à l’HSA sont connues sous le nom de site I et II de Sudlow, situés dans les sous-domaines IIA et IIIA (Figure 1), respectivement (Sudlow et al., 1976 ; Peters, 1996). L’albumine est codée par un seul gène, qui est exprimé de manière co-dominante, les deux allèles étant transcrits et traduits (Hawkins et Dugaiczyk, 1982 ; Peters, 1996). Le gène de l’albumine humaine est situé sur le bras long du chromosome 4 à la position q13.3.
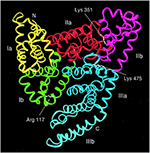
Figure 1. Structure de l’albumine sérique humaine constituée de trois domaines, chacun regroupé en sous-domaines A et B (Sous-domaine Ia, jaune ; Ib, vert ; IIa, rouge ; IIb, magenta ; IIIa, bleu ; et IIIb, cyan). Sugio et al. (1999) par permission de Oxford University Press.
Fonction
L’albumine est principalement synthétisée par le foie, le foie humain produisant ~13,9 g d’HSA par jour (Peters, 1996). L’HSA a une demi-vie approximative de 19 jours et se dégrade plus efficacement si elle est dénaturée ou si sa structure est altérée (Peters, 1996). L’albumine a une variété de fonctions importantes et est responsable de 80 % de la pression osmotique colloïdale du sang (Peters, 1996). De manière significative, l’albumine est capable de lier diverses molécules endogènes, notamment les acides gras à longue chaîne, les stéroïdes, le L-tryptophane, etc. (Kragh-Hansen, 1981 ; Peters, 1996 ; Evans, 2002). De plus, l’albumine est également impliquée dans le transport des ions dans la circulation, notamment le cuivre, le zinc, le calcium, etc. (Peters, 1996).
En outre, cette protéine vitale est capable de lier des composés exogènes et des médicaments, tels que la warfarine, l’ibuprofène, la chlorpromazine et le naproxène, l’affinité de leur liaison affectant de manière significative leur activité et leur demi-vie (Kragh-Hansen, 1981 ; Peters, 1996 ; Evans, 2002). En outre, l’albumine agit également comme un transporteur de déchets toxiques, en fixant la bilirubine, le produit de la dégradation de l’hème, pour l’acheminer vers le foie en vue de son excrétion hépatique (Peters, 1996). Il est intéressant de noter que l’albumine agirait également comme un antioxydant en raison de sa capacité à : (1) protéger les substances liées des dommages peroxydatifs (par exemple, les acides gras et les lipoprotéines) ; et (2) lier le cuivre libre, limitant son activité redox et la production de radicaux libres (Peters, 1996 ; Evans, 2002). Enfin, l’albumine est une source de thiols qui sont des piégeurs avides d’oxygène réactif et d’espèces azotées (Peters, 1996 ; Evans, 2002).
Distribution
Intéressante, l’albumine est surtout présente dans l’espace extravasculaire (~242 g) plutôt que dans l’espace intravasculaire (~118 g) (Peters, 1996 ; Evans, 2002). En fait, la protéine est prévalente dans des endroits extracellulaires tels que la peau, les intestins, les muscles, d’autres fluides (c’est-à-dire les fluides cérébrospinal, pleural, etc.) et les sécrétions (par exemple, la sueur, les larmes et le lait) (Peters, 1996). Cependant, de très faibles concentrations d’albumine sont présentes au niveau intracellulaire (Peters, 1996). L’albumine retourne de l’espace extravasculaire à la circulation via le système lymphatique, faisant ~28 « voyages » dans et hors du système lymphatique au cours de sa vie (Peters, 1996 ; Evans, 2002).
Sur sécrétion des hépatocytes, l’albumine entre dans la circulation et transloque vers l’espace extracellulaire à travers les pores de l’endothélium sinusoïdal ou fenestré dans certains organes, tels que le foie, le pancréas, l’intestin grêle et la moelle osseuse (Peters, 1996). Cependant, dans les organes où un endothélium continu prédomine, on pense maintenant que l’albumine peut traverser l’endothélium par des mécanismes transcytaires actifs, y compris des mécanismes médiés par des récepteurs (par ex, albondine ; voir la section intitulée « Protéines cellulaires liant l’albumine »).
Accumulation d’albumine dans l’interstitium tumoral
Les tumeurs solides possèdent couramment un système vasculaire immature, très perméable, sur lequel agissent des facteurs favorisant la perméabilité vasculaire (par ex, oxyde nitrique) (Carmeliet et Jain, 2000 ; Maeda et al., 2000 ; Greish, 2007 ; van der Veldt et al., 2008). Cependant, malgré cela, le drainage lymphatique est généralement insuffisant (Carmeliet et Jain, 2000 ; Maeda et al., 2000 ; Greish, 2007). Il en résulte une accumulation de macromolécules (>40 kDa) dans l’interstitium de la tumeur, ce que l’on appelle l’effet de perméation et de rétention accrues (figure 2) (Maeda et al., 2000 ; Greish, 2007). Il est intéressant de noter que Matsumura et Maeda (1986) ont démontré qu’un complexe bleu Evans-albumine injecté par voie intraveineuse s’accumulait dans les tumeurs du sarcome 180 de souris ddY. La rétention d’albumine dans les tumeurs a depuis été observée dans diverses tumeurs solides expérimentales (par exemple, sarcome, carcinome ovarien, hépatome de Novikof, etc.) en utilisant de l’albumine sérique radiomarquée ou complexée avec un colorant (Peterson et Appelgren, 1973 ; Sinn et al, 1990 ; Andersson et al., 1991 ; Schilling et al., 1992 ; Stehle et al., 1997 ; Wunder et al., 1997).
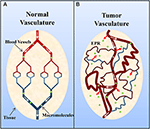
Figure 2. Représentation schématique de la vasculature (A) normale et (B) tumorale. Le tissu normal est composé de vaisseaux sanguins matures et organisés, tandis que le tissu tumoral est constitué de vaisseaux immatures, fuyants et tortueux. L’organisation altérée de la vascularisation tumorale et la désorganisation du réseau lymphatique entraînent des fuites vasculaires et l’accumulation de macromolécules (>40 kDa) dans l’interstitium, ce que l’on appelle l’effet de perméation et de rétention accrues (EPR). Adapté avec la permission de Macmillan Publishers Ltd : Nature Medicine (Jain, 2001), copyright (2001).
De plus, un certain nombre d’études ont proposé que les tumeurs soient un site de catabolisme de l’albumine (Hradec, 1958 ; Andersson et al., 1991 ; Schilling et al., 1992 ; Stehle et al., 1997). Par exemple, dans un modèle de sarcome de souris (C57/RL6J) injecté avec de l’albumine marquée au 3H-raffinose, des niveaux de 3H au moins 2 à 3 fois plus élevés ont été observés dans les lysosomes des tumeurs par rapport aux lysosomes des tissus normaux (Andersson et al., 1991). De plus, des études ont démontré que l’albumine a une demi-vie plus courte et un turnover plus élevé chez les souris porteuses de tumeurs, malgré une augmentation compensatoire de la synthèse hépatique d’albumine, par rapport aux souris non porteuses de tumeurs (Hradec, 1958). Il a donc été suggéré que les tumeurs utilisent l’albumine comme source d’énergie, en décomposant l’albumine en ses acides aminés constitutifs dans les lysosomes, qui sont ensuite utilisés par les cellules cancéreuses pour accélérer leur croissance (Stehle et al., 1997). En outre, des études ont suggéré que l’hypoalbuminémie évidente chez les patients cancéreux est le résultat du catabolisme de l’albumine par la tumeur (Stehle et al., 1997).
Néanmoins, certaines de ces études antérieures souffrent de plusieurs limitations expérimentales. Par exemple, il est difficile d’obtenir des fractions lysosomales pures et, par conséquent, il est nécessaire de reproduire ces études et de tester la pureté des fractions en utilisant des marqueurs membranaires et organites bien établis (Graham, 2002 ; Yamagishi et al., 2013). En outre, plusieurs autres facteurs in vivo peuvent affecter la dégradation et le catabolisme de l’albumine (par exemple, les niveaux de corticostéroïdes) (Peters, 1996). Par conséquent, une relation claire et nette n’a pas été établie et des études in vivo supplémentaires sont nécessaires pour soutenir la distribution intracellulaire et le catabolisme de l’albumine par les tumeurs.
Plus récemment, Commisso et al. ont observé que les cellules cancéreuses hébergeant des mutations oncogènes endogènes de Ras ont des niveaux accrus de macropinocytose in vitro et in vivo (Commisso et al., 2013). En outre, il a été démontré que l’albumine marquée au FITC était internalisée par macropinocytose et entraînait ensuite une augmentation des niveaux de glutamate et d’α-cétoglutarate dans les cellules transformées par Ras oncogène (Commisso et al., 2013). Il est intéressant de noter que la diminution de la prolifération des cellules exprimant Ras oncogène après une privation de glutamine s’est avérée être corrigée par une supplémentation en albumine extracellulaire (Commisso et al., 2013). Ces résultats suggèrent que la macropinocytose de l’albumine fournit des nutriments pour soutenir la prolifération des cellules cancéreuses (Commisso et al., 2013).
Protéines cellulaires de liaison à l’albumine
Considérant l’importance de l’albumine, un certain nombre de protéines et de récepteurs putatifs de liaison à l’albumine ont été identifiés dans divers tissus et lignées cellulaires (tableau 1), y compris le rein (Zhai et al…, 2000 ; Amsellem et al., 2010), l’endothélium (Schnitzer et Bravo, 1993), les fibroblastes (Porter et al., 1995) et les surfaces des cellules tumorales (Fritzsche et al., 2004). Plus précisément, sept protéines de liaison à l’albumine associées à la membrane ont été découvertes, à savoir : l’albondine/glycoprotéine 60 (gp60) (Schnitzer et al., 1988), la glycoprotéine 18 (gp18) (Ghinea et al., 1988), la glycoprotéine 30 (gp30) (Ghinea et al, 1988), le récepteur Fc néonatal (FcRn) (Roopenian et Akilesh, 2007), les ribonucléoprotéines nucléaires hétérogènes (hnRNP) (Fritzsche et al., 2004), la calréticuline (Fritzsche et al., 2004), la cubiline (Zhai et al., 2000 ; Amsellem et al., 2010) et la mégaline (Zhai et al., 2000 ; Amsellem et al., 2010). De plus, une protéine sécrétée liant l’albumine, connue sous le nom de protéine sécrétée, acide et riche en cystéine (SPARC), a été identifiée (Schnitzer et Oh, 1992). Compte tenu de leur importance dans l’absorption de l’albumine par les cellules, chacune de ces protéines est décrite en détail ci-dessous.

Tableau 1. Localisation des protéines de liaison à l’albumine et des récepteurs.
Albondine/gp60
L’albondine (gp60) est une glycoprotéine de 60 kDa qui agit comme un récepteur de l’albumine largement distribué, mais qui est exprimé sélectivement sur la membrane plasmique de l’endothélium continu (à l’exception du cerveau), où il opère pour augmenter la perméabilité capillaire (Ghinea et al, 1988, 1989 ; Schnitzer et al., 1988 ; Schnitzer, 1992 ; Schnitzer et Oh, 1994 ; Tiruppathi et al., 1996). Non seulement l’albondine se lie spécifiquement à l’albumine native, mais elle facilite également son internalisation et sa transcytose ultérieure (Milici et al., 1987 ; Schnitzer, 1992 ; Schnitzer et Oh, 1994 ; Tiruppathi et al., 1996).
Il a été proposé que ~50% de l’albumine quitte la lumière capillaire via l’albondine, le reste traversant cette barrière par des jonctions intercellulaires et/ou des mécanismes de phase fluide (Schnitzer, 1993 ; Schnitzer et Oh, 1994). En outre, il a été démontré que l’internalisation de l’albondine se produit par un processus endocytotique dépendant de la cavéoline qui aboutit à la transcytose et ne semble pas entrer dans le système dégradant endosome-lysosome (Schnitzer, 1993 ; Schnitzer et Bravo, 1993 ; Schnitzer et al, 1995 ; Tiruppathi et al, 1997 ; Iancu et al, 2011).
gp18 et gp30
Les deux gp18 et gp30 se lient avidement à l’albumine modifiée par conformation (c’est-à-dire, l’albumine marquée à l’or, l’albumine traitée au formaldéhyde ou à l’anhydride maléique) et n’interagissent pas de façon préférentielle avec l’albumine native, comme d’autres récepteurs de charognards connus (Ghinea et al., 1989 ; Schnitzer et Oh, 1992, 1994 ; Schnitzer et al., 1992 ; Schnitzer et Bravo, 1993). Contrairement à l’albondine, la gp18 et la gp30 sont présentes sur une variété de cellules, telles que les macrophages et les fibroblastes, et sur une gamme d’endothéliums (Schnitzer et al., 1992). De plus, on a observé que la gp18 était exprimée dans les cellules cancéreuses du sein humain MDA-MB-453 (Wang et al., 1994). Ces récepteurs fixent et dirigent les albumines modifiées vers la dégradation, peut-être dans le cadre du catabolisme des protéines ou comme une voie de protection pour éliminer les albumines modifiées, anciennes, endommagées ou potentiellement délétères (Schnitzer, 1993 ; Schnitzer et Bravo, 1993). L’albumine peut être modifiée par oxydation, glycation non enzymatique, maléylation, etc. à la suite du vieillissement normal ou comme réponse protectrice ou pathologique (Schnitzer, 1993 ; Peters, 1996). L’albumine dénaturée ou modifiée est dégradée plus rapidement et plus efficacement que l’albumine native, ce qui suggère que ces altérations sélectionnent les molécules d’albumine pour la dégradation (Peters, 1996).
SPARC
SPARC est également connu sous le nom d’ostéonectine et de BM-40 et est sécrété par plusieurs types de cellules (Brekken et Sage, 2001). Il est intéressant de noter que SPARC est fortement exprimé dans les cellules malignes et les cellules stromales associées à la néoplasie (Porter et al., 1995 ; Podhajcer et al., 2008). SPARC possède des propriétés de liaison à l’albumine et interagit spécifiquement avec l’albumine native d’une manière similaire à l’albondine, mais différente de 18 à la gp30 qui lient l’albumine conformationnellement altérée (Schnitzer et Oh, 1992). Plus précisément, les anticorps anti-SPARC reconnaissent également l’albondine, mais pas la 18 ou la gp30, ce qui suggère que SPARC et l’albondine partagent un domaine de liaison à l’albumine native (Schnitzer et Oh, 1992). Cependant, il n’y a aucune preuve que SPARC soit le médiateur de l’absorption de l’albumine dans les tumeurs. Il a été postulé que la capacité de SPARC à se lier à l’albumine dans l’interstitium de la tumeur augmente l’accumulation de médicaments liés à l’albumine dans l’espace tumoral (Desai et al., 2008, 2009). En outre, un essai clinique préliminaire a démontré que l’expression de SPARC était corrélée à la réponse au traitement par nanoparticules d’albumine chargées de paclitaxel (nab-paclitaxel ou Abraxane®), les patients SPARC-positifs ayant un meilleur résultat clinique (Desai et al., 2009). Cependant, des données contradictoires dans un modèle de souris KPfC ont remis en cause cette hypothèse, la déficience en SPARC ne modifiant pas les concentrations intra-tumorales d’Abraxane® (Neesse et al., 2014). Par conséquent, d’autres études sont nécessaires pour valider cette hypothèse, notamment des essais cliniques de plus grande envergure impliquant un plus grand nombre de patients. Actuellement, une étude de phase III (NCT00785291), par l’Institut national du cancer, évalue si l’expression de SPARC dans le sérum prédit la réponse des patients à Abraxane®, et cela pourrait approfondir notre compréhension du rôle de SPARC dans l’accumulation d’albumine par les tumeurs.
hnRNPs et Calreticulin
Cinq protéines de liaison à l’albumine différentes ont été identifiées à partir des membranes plasmatiques de lignées de cellules cancéreuses humaines (c’est-à-dire, leucémie à cellules T CCRF-CEM, mélanome MV3 et carcinome mammaire MCF7) (Fritzsche et al., 2004). Quatre de ces protéines ont été identifiées comme des membres de la famille hnRNP, y compris hnRNP A2/B1, hnRNP C1, hnRNP A1 et hnRNP A3, et la cinquième protéine s’est avérée être la calréticuline (Fritzsche et al., 2004). La calréticuline a d’abord été décrite comme une chaperonne du réticulum endoplasmique et une protéine de signalisation du calcium, mais il a été démontré depuis qu’elle est impliquée dans plusieurs fonctions cellulaires, notamment l’adhésion cellulaire, la modulation des interactions plaquettes-collagène (cicatrisation) et l’apoptose (Mendlovic et Conconi, 2010). Les fonctions de la famille hnRNP ne sont pas bien caractérisées. Cependant, la plupart des membres de la famille hnRNP ont été décrits comme des protéines nucléaires de liaison à l’ARN impliquées dans le traitement du pré-ARNm, comme l’épissage, l’exportation et la stabilité de l’ARN (Chaudhury et al., 2010). Il est intéressant de noter que les hnRNP ont été proposées pour jouer un rôle dans la carcinogenèse où leur surexpression agit comme des biomarqueurs pour la détection précoce des tumeurs (Han et al., 2013). La signification de ces résultats n’est actuellement pas claire et il reste à déterminer si ces protéines sont impliquées dans l’absorption médiée par l’albumine.
FcRn
FcRn est exprimé dans de multiples types de cellules et de tissus, y compris les cellules présentatrices d’antigènes, l’endothélium vasculaire, l’intestin, les poumons, les reins et la barrière hémato-encéphalique (BHE) (c’est-à-dire , endothélium et plexus choroïde) (Roopenian et Akilesh, 2007). Ce récepteur protège l’albumine et les IgG de la dégradation en liant les deux protéines avec une grande affinité uniquement à un faible pH (pH < 6,5) dans les endosomes acides, empêchant leur dégradation par la voie lysosomale et les renvoyant dans l’espace extracellulaire (pH 7,4) (Chaudhury et al., 2003 ; Ober et al., 2004 ; Anderson et al., 2006 ; Andersen et al., 2012). Ceci prolonge par conséquent la demi-vie de l’albumine sérique (Chaudhury et al., 2003 ; Anderson et al., 2006 ; Sarav et al., 2009). Le rôle de ce récepteur dans l’absorption de l’albumine par les tumeurs n’est toujours pas clair.
Cubiline et Megalin
La cubiline est un récepteur multiligand qui est surtout reconnu pour son implication dans l’absorption intestinale du complexe facteur intrinsèque de la vitamine B12 (Seetharam et al., 1997). De plus, il a été démontré que la cubiline est impliquée dans l’endocytose et le transport transcellulaire de nombreux ligands, y compris l’albumine (Birn et al., 2000). La cubiline est localisée dans les cellules intestinales absorbantes, le placenta, les cellules viscérales du sac vitellin et les tubules proximaux des reins (Christensen et Birn, 2002). La mégaline est une grande protéine trans-membranaire qui a également été montrée comme liant l’albumine (Cui et al., 1996). Cette protéine est plus largement exprimée que la cubiline, étant présente dans les plexus choroïdes, les cellules des tubules proximaux des reins, les thyrocytes, etc. (Tableau 1) (Christensen et Birn, 2002).
Intéressant, la mégaline se lie à la cubiline avec une haute affinité et il a été suggéré que la mégaline contribue à l’internalisation des complexes cubiline-ligand en tant que corécepteur (Moestrup et al., 1998 ; Christensen et Birn, 2002). De plus, la cubiline se lie également à la mégaline, une protéine qui est nécessaire à l’expression de la cubiline sur la membrane cellulaire (Amsellem et al., 2010). La cubiline, conjointement avec la mégaline, joue un rôle essentiel dans l’absorption de l’albumine (c’est-à-dire la réabsorption) par les tubules proximaux des reins (Zhai et al., 2000 ; Amsellem et al., 2010). Il a été démontré que la déficience en cubiline et/ou en mégaline chez la souris et le chien entraîne une diminution de l’absorption de l’albumine dans le tubule proximal, ce qui provoque une albuminurie (Birn et al., 2000 ; Amsellem et al., 2010). De plus, les patients atteints du syndrome d’Imerslund-Gräsbeck, causé par une mutation du gène de la cubiline, souffrent en général de protéinurie, ce qui démontre l’importance de la cubiline dans la réabsorption rénale des protéines (Grasbeck, 2006).
L’albumine comme vecteur de médicament en oncologie
Considérant l’effet amélioré de perméation et de rétention et l’accumulation de l’albumine dans l’interstitium tumoral, le développement de l’albumine comme vecteur de médicament est de plus en plus important à considérer en termes de livraison ciblée de la thérapie du cancer (Kratz, 2008, 2010). Il a également été proposé que les transporteurs d’albumine tirent parti de la présence d’albondine sur l’endothélium et de SPARC dans l’interstitium tumoral pour augmenter l’accumulation de médicaments dans l’espace tumoral (Desai et al., 2009 ; Kratz, 2010). Divers systèmes d’administration de médicaments avec de l’albumine ont été développés, notamment des nanoparticules d’albumine, des conjugués médicament-albumine, des dérivés de médicaments liant l’albumine et des promédicaments (pour des revues, voir Kratz, 2008, 2010).
Le développement et l’approbation du marché de la nanoparticule d’albumine chargée de paclitaxel, nab-paclitaxel ou Abraxane®, a été une percée majeure dans le domaine du développement des transporteurs d’albumine. Abraxane® a été initialement approuvé pour un usage clinique aux États-Unis en 2005 (Kudlowitz et Muggia, 2014). Cette nanoparticule d’albumine est indiquée pour le traitement du cancer du sein métastatique, après échec de la chimiothérapie combinée (Kudlowitz et Muggia, 2014). Plus récemment, Abraxane® a également été décrit pour le traitement de première ligne des patients atteints d’adénocarcinome métastatique du pancréas, en association avec la gemcitabine, et des patients atteints de carcinome pulmonaire non à petites cellules localement avancé ou métastatique, en association avec le carboplatine (Kudlowitz et Muggia, 2014). Abraxane® a un index thérapeutique supérieur à celui du paclitaxel seul, pouvant être administré à des doses plus élevées avec moins de toxicité et plus d’efficacité que le traitement traditionnel au paclitaxel (Gradishar et al., 2005 ; Socinski et al., 2012 ; Iwamoto, 2013). Abraxane® est actuellement encore en cours d’évaluation dans des essais cliniques pour d’autres tumeurs, telles que le cancer de la vessie (NCT00583349) et le myélome multiple (NCT02075021).
En outre, la liaison à l’albumine en tant que stratégie générale pour améliorer la pharmacocinétique des médicaments est également évaluée. Traditionnellement, on pense que la liaison d’un médicament à l’albumine réduit le niveau de médicament libre disponible pour exercer son activité thérapeutique (Lancon et al., 2004 ; Vuignier et al., 2010). Cependant, des études ont également démontré des mécanismes par lesquels l’albumine agit pour améliorer efficacement l’utilisation thérapeutique ou réduire la clairance rapide (Dennis et al., 2002 ; Merlot et Richardson, 2014). Par exemple, il a été démontré que la thiosemicarbazone anticancéreuse expérimentale, à savoir la di-2-pyridylcétone 4,4-diméthyl-3-thiosemicarbazone (Dp44mT) (Merlot et al., 2013a), est internalisée par les cellules cancéreuses via un transporteur/récepteur putatif (Merlot et al., 2013b ; Merlot et Richardson, 2014). Il est intéressant de noter que l’absorption, la toxicité et l’activité apoptotique de la Dp44mT sont considérablement renforcées en présence de HSA (Merlot et Richardson, 2014). Étant donné que la Dp44mT cible les lysosomes pour induire l’apoptose (Lovejoy et al., 2011), et que l’HSA subit potentiellement un catabolisme lysosomal dans les tumeurs (Andersson et al., 1991 ; Stehle et al., 1997), on peut supposer que l’HSA facilite l’acheminement de la Dp44mT vers les lysosomes, renforçant ainsi son activité anticancéreuse (Merlot et Richardson, 2014). Bien que les études doivent encore identifier le mécanisme exact du processus d’absorption stimulé par l’HSA, la liaison à l’albumine peut fournir un avantage lors de la génération d’agents de ciblage des tumeurs, ce qui nécessite une enquête plus intense.
Conclusion
L’albumine est une protéine polyvalente et captivante. Compte tenu du grand confinement de l’albumine dans l’espace vasculaire et interstitiel, la distribution intracellulaire de l’albumine est restée mal caractérisée pendant de nombreuses années. Il est possible que l’albumine, dans des conditions spécifiques ou lors d’un stress cellulaire, soit absorbée par les cellules normales et les cellules tumorales à des niveaux faibles et élevés, respectivement, en raison de leur taux métabolique. Le rôle exact de certaines protéines de liaison à l’albumine incomplètement caractérisées (c’est-à-dire les hnRNP et la calréticuline) dans la médiation de l’absorption de l’albumine reste à déterminer. Cependant, la recherche et la caractérisation des protéines de liaison à l’albumine, en particulier dans les cellules cancéreuses, présentent un intérêt considérable à la lumière du développement de l’albumine comme vecteur efficace de médicaments pour cibler les tumeurs.
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Remerciements
Angelica M. Merlot est le bénéficiaire d’une bourse de recherche de début de carrière de l’Université de Sydney. Des R. Richardson est le bénéficiaire d’une bourse de recherche principale senior et de subventions de projet du National Health and Medical Research Council (NHMRC). Danuta S. Kalinowski est le bénéficiaire d’une bourse de projet NHMRC (1048972) et d’une bourse Helen et Robert Ellis de la Sydney Medical School Foundation de l’Université de Sydney.
Amsellem, S., Gburek, J., Hamard, G., Nielsen, R., Willnow, T. E., Devuyst, O., et al. (2010). La cubiline est essentielle à la réabsorption de l’albumine dans le tubule proximal du rein. J. Am. Soc. Nephrol. 21, 1859-1867. doi : 10.1681/ASN.2010050492
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Andersen, J. T., Dalhus, B., Cameron, J., Daba, M. B., Plumridge, A., Evans, L., et al. (2012). Structure-based mutagenesis reveals the albumin-binding site of the neonatal Fc receptor. Nat. Commun. 3, 610. doi : 10.1038/ncomms1607
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Anderson, C. L., Chaudhury, C., Kim, J., Bronson, C. L., Wani, M. A., et Mohanty, S. (2006). Perspective-FcRn transports albumin : relevance to immunology and medicine. Trends Immunol. 27, 343-348. doi : 10.1016/j.it.2006.05.004
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Andersson, C., Iresjo, B. M., et Lundholm, K. (1991). Identification des sites tissulaires pour une dégradation accrue de l’albumine chez les souris porteuses de sarcomes. J. Surg. Res. 50, 156-162. doi : 10.1016/0022-4804(91)90240-M
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Birn, H., Fyfe, J. C., Jacobsen, C., Mounier, F., Verroust, P. J., Orskov, H., et al. (2000). Cubilin is an albumin binding protein important for renal tubular albumin reabsorption. J. Clin. Invest. 105, 1353-1361. doi : 10.1172/JCI8862
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Brekken, R. A., et Sage, E. H. (2001). SPARC, une protéine matricellulaire : au carrefour de la communication cellule-matrice. Matrix Biol. 19, 816-827. doi : 10.1016/S0945-053X(00)00133-5
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Carmeliet, P., et Jain, R. K. (2000). L’angiogenèse dans le cancer et d’autres maladies. Nature 407, 249-257. doi : 10.1038/35025220
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Chaudhury, A., Chander, P., et Howe, P. H. (2010). Les ribonucléoprotéines nucléaires hétérogènes (hnRNP) dans les processus cellulaires : focus sur les rôles régulateurs multifonctionnels de la hnRNP E1. RNA 16, 1449-1462. doi : 10.1261/rna.2254110
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Chaudhury, C., Mehnaz, S., Robinson, J. M., Hayton, W. L., Pearl, D. K., Roopenian, D. C., et al. (2003). Le récepteur Fc de l’IgG (FcRn) lié au complexe majeur d’histocompatibilité se lie à l’albumine et prolonge sa durée de vie. J. Exp. Med. 197, 315-322. doi : 10.1084/jem.20021829
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Christensen, E. I., et Birn, H. (2002). Megalin et cubilin : récepteurs endocytiques multifonctionnels. Nat. Rev. Mol. Cell Biol. 3, 256-266. doi : 10.1038/nrm778
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Commisso, C., Davidson, S. M., Soydaner-Azeloglu, R. G., Parker, S. J., Kamphorst, J. J., Hackett, S., et al. (2013). La macropinocytose des protéines est une voie d’approvisionnement en acides aminés dans les cellules transformées par Ras. Nature 497, 633-637. doi : 10.1038/nature12138
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Cui, S., Verroust, P. J., Moestrup, S. K., et Christensen, E. I. (1996). Megalin/gp330 mediates uptake of albumin in renal proximal tubule. Am. J. Physiol. 271, F900-F907. doi : 10.1038/nature12138
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Dennis, M. S., Zhang, M., Meng, Y. G., Kadkhodayan, M., Kirchhofer, D., Combs, D., et al. (2002). Albumin binding as a general strategy for improving the pharmacokinetics of proteins. J. Biol. Chem. 277, 35035-35043. doi : 10.1074/jbc.M205854200
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Desai, N., Trieu, V., Damascelli, B., et Soon-Shiong, P. (2009). L’expression de SPARC est en corrélation avec la réponse tumorale au paclitaxel lié à l’albumine chez les patients atteints de cancer de la tête et du cou. Transl. Oncol. 2, 59-64. doi : 10.1593/tlo.09109
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Desai, N. P., Trieu, V., Hwang, L. Y., Wu, R., Soon-Shiong, P., et Gradishar, W. J. (2008). Improved effectiveness of nanoparticle albumin-bound (nab) paclitaxel versus polysorbate-based docetaxel in multiple xenografts as a function of HER2 and SPARC status. Anticancer Drugs 19, 899-909. doi : 10.1097/CAD.0b013e32830f9046
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Evans, T. W. (2002). Article de synthèse : l’albumine en tant que médicament – effets biologiques de l’albumine non liés à la pression oncotique. Aliment. Pharmacol. Ther. 16(Suppl. 5), 6-11. doi : 10.1046/j.1365-2036.2002.00190.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Fritzsche, T., Schnolzer, M., Fiedler, S., Weigand, M., Wiessler, M., et Frei, E. (2004). Isolation and identification of heterogeneous nuclear ribonucleoproteins (hnRNP) from purified plasma membranes of human tumour cell lines as albumin-binding proteins. Biochem. Pharmacol. 67, 655-665. doi : 10.1016/j.bcp.2003.09.027
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ghinea, N., Eskenasy, M., Simionescu, M., et Simionescu, N. (1989). Les protéines endothéliales de liaison à l’albumine sont des composants associés à la membrane exposés à la surface de la cellule. J. Biol. Chem. 264, 4755-4758.
Pubmed Abstract | Pubmed Full Text
Ghinea, N., Fixman, A., Alexandru, D., Popov, D., Hasu, M., Ghitescu, L., et al. (1988). Identification des protéines liant l’albumine dans les cellules endothéliales capillaires. J. Cell Biol. 107, 231-239.
Pubmed Abstract | Pubmed Full Text
Gradishar, W. J., Tjulandin, S., Davidson, N., Shaw, H., Desai, N., Bhar, P., et al. (2005). Essai de phase III du paclitaxel lié à l’albumine sous forme de nanoparticules comparé au paclitaxel à base d’huile de ricin polyéthylée chez les femmes atteintes d’un cancer du sein. J. Clin. Oncol. 23, 7794-7803. doi : 10.1200/JCO.2005.04.937
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Graham, J. M. (2002). Préparation de fractions subcellulaires brutes par centrifugation différentielle. ScientificWorldJournal 2, 1638-1642. doi : 10.1100/tsw.2002.851
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Grasbeck, R. (2006). Syndrome d’Imerslund-Grasbeck (malabsorption sélective de la vitamine B(12) avec protéinurie). Orphanet. J. Rare Dis. 1:17. doi : 10.1186/1750-1172-1-17
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Greish, K. (2007). Perméabilité et rétention accrues des médicaments macromoléculaires dans les tumeurs solides : une porte royale pour les nanomédicaments anticancéreux ciblés. J. Drug Target. 15, 457-464. doi : 10.1080/10611860701539584
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Han, N., Li, W., et Zhang, M. (2013). La fonction de la protéine de liaison à l’ARN hnRNP dans les métastases du cancer. J. Cancer Res. Ther. 9(Suppl.), S129-S134. doi : 10.4103/0973-1482.122506
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Hawkins, J. W., et Dugaiczyk, A. (1982). Le gène de l’albumine sérique humaine : structure d’un locus unique. Gene 19, 55-58. doi : 10.1016/0378-1119(82)90188-3
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
He, X. M., et Carter, D. C. (1992). Structure atomique et chimie de l’albumine sérique humaine. Nature 358, 209-215. doi : 10.1038/358209a0
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Hradec, J. (1958). Métabolisme de l’albumine sérique chez les rats porteurs de tumeurs. Br. J. Cancer 12, 290-304. doi : 10.1038/bjc.1958.35
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Iancu, C., Mocan, L., Bele, C., Orza, A. I., Tabaran, F. A., Catoi, C., et al. (2011). Amélioration de l’ablation thermique au laser pour le traitement in vitro du cancer du foie par la délivrance spécifique de nanotubes de carbone multiparois fonctionnalisés avec de l’albumine de sérum humain. Int. J. Nanomed. 6, 129-141. doi : 10.2147/IJN.S15841
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Iwamoto, T. (2013). Application clinique des systèmes d’administration de médicaments dans la chimiothérapie du cancer : examen de l’efficacité et des effets secondaires des médicaments approuvés. Biol. Pharm. Bull. 36, 715-718. doi : 10.1248/bpb.b12-01102
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Jain, R. K. (2001). Normalisation de la vascularisation des tumeurs avec la thérapie anti-angiogénique : un nouveau paradigme pour la thérapie combinée. Nat. Med. 7, 987-989. doi : 10.1038/nm0901-987
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kragh-Hansen, U. (1981). Aspects moléculaires de la liaison des ligands à l’albumine sérique. Pharmacol. Rev. 33, 17-53. doi : 10.1038/nm0901-987
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kratz, F. (2008). L’albumine comme vecteur de médicaments : conception de promédicaments, de conjugués de médicaments et de nanoparticules. J. Control. Release 132, 171-183. doi : 10.1016/j.jconrel.2008.05.010
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kratz, F. (2010). L’albumine, un transporteur polyvalent en oncologie. Int. J. Clin. Pharmacol. Ther. 48, 453-455. doi : 10.5414/CPP48453
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kudlowitz, D., et Muggia, F. (2014). Le paclitaxel lié à l’albumine sous forme de nanoparticules (nab-paclitaxel) : extension de ses indications. Opinions d’experts. Drug Saf. 13, 681-685. doi : 10.1517/14740338.2014.910193
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lancon, A., Delmas, D., Osman, H., Thenot, J. P., Jannin, B., et Latruffe, N. (2004). Absorption du resvératrol par les cellules hépatiques humaines : implication de la diffusion passive et du processus de médiation par les transporteurs. Biochem. Biophys. Res. Comm. 316, 1132-1137. doi : 10.1016/j.bbrc.2004.02.164
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lovejoy, D. B., Jansson, P. J., Brunk, U. T., Wong, J., Ponka, P., et Richardson, D. R. (2011). L’activité antitumorale du composé chélateur de métaux Dp44mT est médiée par la formation d’un complexe de cuivre redox-actif qui s’accumule dans les lysosomes. Cancer Res. 71, 5871-5880. doi : 10.1158/0008-5472.CAN-11-1218
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Maeda, H., Wu, J., Sawa, T., Matsumura, Y., et Hori, K. (2000). La perméabilité vasculaire des tumeurs et l’effet RPE dans la thérapeutique macromoléculaire : une revue. J. Control. Release 65, 271-284. doi : 10.1016/S0168-3659(99)00248-5
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Matsumura, Y., et Maeda, H. (1986). Un nouveau concept pour la thérapeutique macromoléculaire dans la chimiothérapie du cancer : mécanisme d’accumulation tumoritropique des protéines et l’agent antitumoral smancs. Cancer Res. 46, 6387-6392.
Pubmed Abstract | Pubmed Full Text
Mendlovic, F., et Conconi, M. (2010). Calréticuline : une protéine à multiples facettes. Nature Educ. 4, 1.
Merlot, A. M., Kalinowski, D. S., et Richardson, D. R. (2013a). Nouveaux chélateurs pour le traitement du cancer : où en sommes-nous maintenant ? Antioxid. Redox Signal. 18, 973-1006. doi : 10.1089/ars.2012.4540
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Merlot, A. M., Pantarat, N., Menezes, S. V., Sahni, S., Richardson, D. R., et Kalinowski, D. S. (2013b). L’absorption cellulaire de l’agent antitumoral Dp44mT se produit via un mécanisme médié par les transporteurs et les récepteurs. Mol. Pharmacol. 84, 911-924. doi : 10.1124/mol.113.088393
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Merlot, A. M., et Richardson, D. R. (2014). Reconnaissance des récepteurs et ciblage lysosomal pour améliorer la cytotoxicité de nouveaux agents anticancéreux qui lient le fer et le cuivre. Vitam. Miner. 3:e125. doi : 10.4172/vms.1000e125
CrossRef Full Text
Milici, A. J., Watrous, N. E., Stukenbrok, H., et Palade, G. E. (1987). Transcytose de l’albumine dans l’endothélium capillaire. J. Cell Biol. 105, 2603-2612.
Pubmed Abstract | Pubmed Full Text
Moestrup, S. K., Kozyraki, R., Kristiansen, M., Kaysen, J. H., Rasmussen, H. H., Brault, D., et al. (1998). Le récepteur du facteur intrinsèque-vitamine B12 et cible des anticorps tératogènes est une protéine membranaire périphérique se liant à la mégaline et présentant une homologie avec les protéines du développement. J. Biol. Chem. 273, 5235-5242. doi : 10.1074/jbc.273.9.5235
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Neesse, A., Frese, K. K., Chan, D. S., Bapiro, T. E., Howat, W. J., Richards, F. M., et al. (2014). Libération de médicaments indépendante de SPARC et effets antitumoraux du nab-paclitaxel chez des souris génétiquement modifiées. Gut 63, 974-983. doi : 10.1136/gutjnl-2013-305559
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ober, R. J., Martinez, C., Lai, X., Zhou, J., et Ward, E. S. (2004). Exocytose de l’IgG comme médié par le récepteur, FcRn : une analyse au niveau de la molécule unique. Proc. Natl. Acad. Sci. U.S.A. 101, 11076-11081. doi : 10.1073/pnas.0402970101
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Peters, T. (1996). Tout sur l’albumine : Biochimie, génétique et applications médicales. San Diego, CA : Academic Press Limited.
Peterson, H. I., et Appelgren, K. L. (1973). Études expérimentales sur l’absorption et la location de protéines marquées dans une tumeur de rat. Eur. J. Cancer 9, 543-547. doi : 10.1016/0014-2964(73)90142-4
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Podhajcer, O. L., Benedetti, L. G., Girotti, M. R., Prada, F., Salvatierra, E., et Llera, A. S. (2008). The role of the matricellular protein SPARC in the dynamic interaction between the tumor and the host. Cancer Metastasis Rev. 27, 691-705. doi : 10.1007/s10555-008-9146-7
CrossRef Full Text
Porter, P. L., Sage, E. H., Lane, T. F., Funk, S. E., and Gown, A. M. (1995). Distribution of SPARC in normal and neoplastic human tissue. J. Histochem. Cytochem. 43, 791-800. doi : 10.1177/43.8.7622842
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Roopenian, D. C., et Akilesh, S. (2007). FcRn : the neonatal Fc receptor comes of age. Nat. Rev. Immunol. 7, 715-725. doi : 10.1038/nri2155
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Sarav, M., Wang, Y., Hack, B. K., Chang, A., Jensen, M., Bao, L., et al. (2009). Le FcRn rénal récupère l’albumine mais facilite l’élimination des IgG. J. Am. Soc. Nephrol. 20, 1941-1952. doi : 10.1681/ASN.2008090976
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Schilling, U., Friedrich, E. A., Sinn, H., Schrenk, H. H., Clorius, J. H., et Maier-Borst, W. (1992). Design of compounds having enhanced tumour uptake, using serum albumin as a carrier-Part II. In vivo studies. Int. J. Rad. Appl. Instrum. B 19, 685-695. doi : 10.1016/0883-2897(92)90103-6
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Schnitzer, J. E. (1992). gp60 is an albumin-binding glycoprotein expressed by continuous endothelium involved in albumin transcytosis. Am. J. Physiol. 262, H246-H254. doi : 10.1016/1050-1738(93)90012-U
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Schnitzer, J. E. (1993). Mise à jour sur la base cellulaire et moléculaire de la perméabilité capillaire. Trends Cardiovasc. Med. 3, 124-130. doi : 10.1016/1050-1738(93)90012-U
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Schnitzer, J. E., Allard, J., and Oh, P. (1995). NEM inhibe la transcytose, l’endocytose et la perméabilité capillaire : implication de la fusion des cavéoles dans les endothéliums. Am. J. Physiol. 268, H48-H55.
Pubmed Abstract | Pubmed Full Text
Schnitzer, J. E., et Bravo, J. (1993). Liaison de haute affinité, endocytose et dégradation des albumines conformationnellement modifiées. Rôle potentiel de gp30 et gp18 comme nouveaux récepteurs scavenger. J. Biol. Chem. 268, 7562-7570.
Pubmed Abstract | Pubmed Full Text
Schnitzer, J. E., Carley, W. W., et Palade, G. E. (1988). L’albumine interagit spécifiquement avec une glycoprotéine endothéliale microvasculaire de 60-kDa. Proc. Natl. Acad. Sci. U.S.A. 85, 6773-6777. doi : 10.1073/pnas.85.18.6773
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Schnitzer, J. E., et Oh, P. (1992). Les anticorps contre SPARC inhibent la liaison de l’albumine à SPARC, gp60 et l’endothélium microvasculaire. Am. J. Physiol. 263, H1872-H1879.
Pubmed Abstract | Pubmed Full Text
Schnitzer, J. E., and Oh, P. (1994). Albondin-mediated capillary permeability to albumin. Rôle différentiel des récepteurs dans la transcytose endothéliale et l’endocytose des albumines natives et modifiées. J. Biol. Chem. 269, 6072-6082.
Pubmed Abstract | Pubmed Full Text
Schnitzer, J. E., Sung, A., Horvat, R., et Bravo, J. (1992). Interaction préférentielle des protéines de liaison à l’albumine, gp30 et gp18, avec des albumines conformationnellement modifiées. Présence dans de nombreuses cellules et tissus avec un rôle possible dans le catabolisme. J. Biol. Chem. 267, 24544-24553.
Pubmed Abstract | Pubmed Full Text
Seetharam, B., Christensen, E. I., Moestrup, S. K., Hammond, T. G., et Verroust, P. J. (1997). Identification de la protéine cible du sac vitellin de rat des anticorps tératogènes, gp280, comme récepteur du facteur intrinsèque-cobalamine. J. Clin. Invest. 99, 2317-2322. doi : 10.1172/JCI119411
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Sinn, H., Schrenk, H. H., Friedrich, E. A., Schilling, U., et Maier-Borst, W. (1990). Conception de composés ayant une absorption tumorale améliorée, en utilisant l’albumine sérique comme support. Part I. Int. J. Rad. Appl. Instrum. B 17, 819-827. doi : 10.1016/0883-2897(92)90103-6
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Socinski, M. A., Bondarenko, I., Karaseva, N. A., Makhson, A. M., Vynnychenko, I., Okamoto, I., et al. (2012). Nab-paclitaxel hebdomadaire en association avec du carboplatine versus paclitaxel à base de solvant plus carboplatine comme traitement de première ligne chez les patients atteints de cancer du poumon non à petites cellules avancé : résultats finaux d’un essai de phase III. J. Clin. Oncol. 30, 2055-2062. doi : 10.1200/JCO.2011.39.5848
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Stehle, G., Sinn, H., Wunder, A., Schrenk, H. H., Stewart, J. C., Hartung, G., et al. (1997). Plasma protein (albumin) catabolism by the tumor itself-implications for tumor metabolism and the genesis of cachexia. Crit. Rev. Oncol. Hematol. 26, 77-100. doi : 10.1016/S1040-8428(97)00015-2
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Sudlow, G., Birkett, D. J., et Wade, D. N. (1976). Further characterization of specific drug binding sites on human serum albumin. Mol. Pharmacol. 12, 1052-1061.
Pubmed Abstract | Pubmed Full Text
Sugio, S., Kashima, A., Mochizuki, S., Noda, M., et Kobayashi, K. (1999). Structure cristalline de l’albumine de sérum humain à une résolution de 2,5 A. Protein Eng. 12, 439-446. doi : 10.1093/protein/12.6.439
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tiruppathi, C., Finnegan, A., et Malik, A. B. (1996). Isolation et caractérisation d’une protéine de liaison à l’albumine de surface cellulaire à partir de cellules endothéliales vasculaires. Proc. Natl. Acad. Sci. U.S.A. 93, 250-254. doi : 10.1073/pnas.93.1.250
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tiruppathi, C., Song, W., Bergenfeldt, M., Sass, P., et Malik, A. B. (1997). L’activation de Gp60 médiatise la transcytose de l’albumine dans les cellules endothéliales par une voie dépendante de la tyrosine kinase. J. Biol. Chem. 272, 25968-25975. doi : 10.1074/jbc.272.41.25968
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
van der Veldt, A. A., Luurtsema, G., Lubberink, M., Lammertsma, A. A., et Hendrikse, N. H. (2008). Individualized treatment planning in oncology : role of PET and radiolabelled anticancer drugs in predicting tumour resistance. Curr. Pharm. Des. 14, 2914-2931. doi : 10.2174/138161208786404344
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Vuignier, K., Schappler, J., Veuthey, J. L., Carrupt, P. A., et Martel, S. (2010). Liaison médicament-protéine : une revue critique des outils analytiques. Anal. Bioanal. Chem. 398, 53-66. doi : 10.1007/s00216-010-3737-1
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Wang, J., Ueno, H., Masuko, T., et Hashimoto, Y. (1994). Liaison de l’albumine sérique sur les cellules tumorales et caractérisation de la protéine de liaison de l’albumine. J. Biochem. 115, 898-903.
Pubmed Abstract | Pubmed Full Text
Wunder, A., Stehle, G., Sinn, H., Schrenk, H., Hoffbiederbeck, D., Bader, F., et al. (1997). Enhanced albumin uptake by rat tumors. Int. J. Oncol. 11, 497-507. doi : 10.3892/ijo.11.3.497
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Yamagishi, T., Sahni, S., Sharp, D. M., Arvind, A., Jansson, P. J., et Richardson, D. R. (2013). La glycoprotéine P est un médiateur de la résistance aux médicaments via un nouveau mécanisme impliquant la séquestration lysosomale. J. Biol. Chem. 288, 31761-31771. doi : 10.1074/jbc.M113.514091
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Zhai, X. Y., Nielsen, R., Birn, H., Drumm, K., Mildenberger, S., Freudinger, R., et al. (2000). Cubilin- et megalin-mediated uptake of albumin in cultured proximal tubule cells of opossum kidney. Kidney Int. 58, 1523-1533. doi : 10.1046/j.1523-1755.2000.00314.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text